白藜芦醇对镉诱导HEK 293T细胞自噬与凋亡的影响
王芸芸,刘小綪,邵峦峦,杨 颖,蒋琦辰,毛伟平
(南京师范大学 生命科学学院 江苏省分子医学重点实验室,江苏 南京 210046)
镉(Cd)是银白色有金属光泽不溶于水的有毒重金属,广泛用于制造电池、颜料、塑料制品以及电镀[1-3]。绝大多数淡水中镉含量很低,不会直接影响健康,但由于镉半衰期比较长,排出速度缓慢,所以易在生物体中富集,当镉进入人体后,主要在肝脏和肾脏中积聚,从而导致各种疾病[4-5]。体内外研究表明,镉进入机体后会引起机体内活性氧(Reactive Oxygen Species, ROS)增多,诱导细胞氧化应激并对机体造成损伤[6-8]。
自噬是细胞保护自己的一种方式,通过降解细胞内受损细胞器和蛋白质聚集物,形成自噬体回收成分,保护细胞免受药物、饥饿等压力的影响[9],研究报道,镉可以介导细胞自噬。Dong等[10]发现,当细胞处于饥饿状态或缺乏生长因子时会导致细胞凋亡,低浓度镉可诱导细胞自噬来保护细胞。Lim等[11]将RWI38细胞暴露于镉中,发现低剂量镉可诱导细胞自噬,并抑制细胞凋亡。最近也有研究表示,镉诱导的氧化应激有助于抑制大鼠近端肾小管细胞[12]和肝细胞[13]自噬。更重要的是,镉暴露诱导的氧化应激和自噬抑制促进了细胞凋亡的发生[14]。由此可见,不同环境、不同浓度甚至不同细胞中,镉诱导自噬与凋亡情况不尽相同,目前,镉诱导自噬和凋亡之间的关系尚不明确,有待进一步探索。
白藜芦醇(Resveratrol, RSV)是一种普遍存在于葡萄、桑椹和虎杖等植物中的多酚类化合物[15]。研究表明,RSV以游离态和结合态两种方式存在于自然界,具有抗氧化效应,对癌症、肿瘤、高血脂、动脉粥样硬化等疾病都具有一定的预防和治疗作用[16-18]。近年来有研究显示,白藜芦醇可抑制PI3K/AKT信号通路[19],降低葡萄糖吸收和代谢[20],启动细胞凋亡和自噬[21];此外,研究发现,低浓度白藜芦醇在缺氧时可增加细胞内自噬体形成,诱导心肌细胞自噬,减缓细胞凋亡,保护细胞[22]。以上结果提示白藜芦醇调控细胞生存与诱导细胞自噬途径有关,但具体分子机制仍有待探究。
本实验室前期研究发现,低浓度镉诱导细胞通过自噬保护自身,高浓度镉导致细胞凋亡,但尚未明确白藜芦醇与镉诱导的细胞自噬与凋亡之间的关系。因此,本研究对该问题进行探索,并为白藜芦醇的生物用药提供一定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞系
HEK 293T(人肾细胞)购买于ATCC细胞库并由南京师范大学生命科学学院分子医学重点实验室保存。用DMEM高糖培养液(10%胎牛血清+100 U/L青霉素+100 U/L链霉素)置于37 ℃、5%CO2培养箱中培养细胞,以1∶3消化传代。
1.1.2 试剂与仪器
高糖DMEM(天津Mediatech公司);胎牛血清、青霉素、链霉素(美国GIBCO公司);DMSO(美国Amresco公司);活性氧检测试剂盒、磷酸钙转染试剂盒、毒胡萝卜素(TG,可特异性抑制自噬体-溶酶体的融合)(上海Beyotime公司)、Annexin V-FITC细胞凋亡检测试剂盒、ECL发光液(南京Vazyme公司);环氧树脂(美国EMS公司);EX-527(SIRT1抑制剂)(美国Selleck Chemicals公司);兔抗人LC3B多克隆抗体、氯化镉、3-甲基腺嘌呤(3-MA,自噬抑制剂)、TMEMD(美国Sigma公司);羊抗兔IgG-HRP多克隆抗体、β-actin抗体、GAPDH抗体、兔抗人SIRT1多克隆抗体、兔抗人cleaved-caspase-3多克隆抗体(南京Bioworld公司)、兔抗人cathepsin L单克隆抗体、兔抗人LAMP2多克隆抗体(英国Abcam公司);常规化学试剂均产自南京化学试剂厂。荧光显微镜、激光共聚焦显微镜、TE2000-U倒置相差显微镜(日本Nikon公司);HT7800透射电子显微镜(日本Hitachi公司);流式细胞仪(美国BD公司)。
1.2 透射电镜观察细胞自噬
将HEK 293T细胞以1×105/孔密度接种于六孔板中适应性培养,将细胞随机分为对照组和实验组处理24 h,收集细胞。用预冷1×PBS洗涤3次,5%戊二醛4 ℃固定3 h,离心,吸出上清液,将样品放入60 ℃ 水浴锅中,加20 μL琼脂,搅拌均匀后取出冷凝。将冷凝为琼脂块的方块转移到玻璃瓶内,用PBS每隔15 min洗涤1次,共3次。锇酸固定,然后用梯度浓度丙酮各脱水1次,每次15 min,无水丙酮脱水2次,每次8 min。再分别用丙酮/树脂比例为1∶1和1∶2浸透样品1 h,纯树脂浸透2 h,包埋,再分别放置在30 ℃,45 ℃和60 ℃各聚合1 d。半薄切片,甲苯胺蓝染色,光镜定位。超薄切片,双染(醋酸双氧铀染色25~30 min,柠檬酸铅染色6~7 min),干燥,HT7800显微镜观察并拍照。
1.3 Western blot分析LC3B-Ⅱ/Ⅰ、cathepsin L、SIRT1、caspase-3蛋白表达
细胞收集: 吸尽六孔板内培养液,PBS漂洗细胞3次,然后将收集到的细胞按标记放入EP管中,加200 μL 预冷的细胞裂解液,超声波破碎3次,100 ℃煮样5 min。4 ℃,13 000 r/min离心2 min,弃上清并于-70 ℃ 冰箱保存。SDS-PAGE电泳分析: 取50 μg总蛋白90 V电泳90~120 min。转膜: 将蛋白转移至PVDF膜上(24 V,2 h)。封闭: 用含5%脱脂奶粉/BSA的PBST将PVDF膜封闭2 h,PBST清洗4次,每次10 min。敷对应一抗,4 ℃过夜,PBST清洗4次,敷二抗,4 ℃过夜,暗室曝光ECL显示结果。
1.4 激光共聚焦分析GFP-LC3、LAMP2表达
HEK 293T细胞在六孔板内培养,待长至60%左右时开始转染。转染前30~60 min吸去原有细胞培养液,加入新鲜的不含抗生素的完全培养液。在超净工作台内取600 μL CaCl2于无菌离心管中,再取不多于20 μL pcDNA3.1-GFP-LC3B质粒DNA加入到CaCl2溶液中,吹打均匀。将DNA-CaCl2加入到600 μL BBS溶液中(两者顺序不能颠倒),混匀,室温孵育10~20 min,平均加到六孔板中,静置4~16 h,期间轻轻摇晃几次,去六孔板中含磷酸钙沉淀的培养液,加2 mL完全培养液,培养12 h。PBS漂洗细胞3次,4%多聚甲醛室温固定20 min。吸去多聚甲醛,PBS清洗3次,1%BSA固定30 min。用激光共聚焦显微镜进行细胞观察。
1.5 活性氧检测
将HEK 293T细胞以1×105/孔密度接种于六孔板中适应性培养,随机将细胞分为对照组、不同浓度Cd2+、RSV和RSV/Cd2+共处理组处理细胞24 h。用无血清培养液对荧光探针DCFH-DA进行稀释(10 μmol/L),稀释后取出一定量将细胞重悬,置于37 ℃细胞培养箱孵育20 min(隔3~5 min颠倒混匀一次)。用无血清培养液洗涤细胞3次,酶标仪检测。
1.6 细胞活性形态学观察
将HEK 293T细胞以1×105/孔密度接种于六孔板中适应性培养,随机将细胞分为对照组、Cd2+、RSV和Cd2+/RSV共处理组处理细胞24 h,TE2000-U倒置相差显微镜观察并拍照。
1.7 流式细胞仪检测细胞凋亡
将HEK 293T细胞以1×105/孔密度接种于六孔板中适应性培养,将细胞随机分为对照组、RSV、Cd2+和Cd2+/RSV共处理组处理细胞24 h。用不含EDTA的胰酶消化细胞,4 ℃,2 000×g离心5 min,收集细胞。PBS漂洗细胞2次,加入100 μL 1×Binding Buffer重悬细胞,5 μL Annexin-V标记,混匀,避光染色10 min,再加入10 μL PI染液,吹打混匀,避光染色5 min。补加1×Binding Buffer 350 μL,1 h内用BD流式细胞仪检测。
1.8 数据处理
各组实验数据均用平均值±标准误(mean±SEM)来表示;采用Image J软件和Oringe分析;对试验组数据的均值比较采用Studentst检验,确定差异显著性。
2 结果与分析
2.1 透射电子显微镜观察镉诱导HEK 293T细胞内自噬体的形成
如图1所示,对照组细胞状态良好,细胞核位于细胞中央,核膜完整。8 μmol/L CdCl2处理组细胞其胞核周围有明显自噬空泡和自噬溶酶体形成(黑色箭头表示自噬体,白色箭头表示自噬溶酶体)。
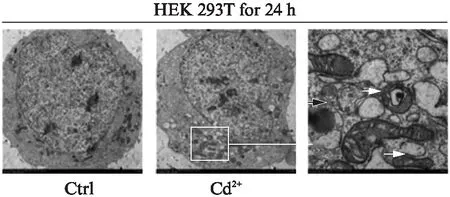
图1 HEK 293T细胞暴露于CdCl2中24 h 后透射电子显微镜观察结果Fig.1 Electron microscope of HEK 293T cells exposed CdCl2 for 24 hHEK 293T细胞暴露在8 μmol/L Cd2+中24 h,黑色箭头表示 自噬体,白色箭头表示自噬溶酶体.
2.2 白藜芦醇对镉诱导细胞自噬的影响
利用不同浓度CdCl2(0~10 μmol/L)处理及先用40 μmol/L RSV预处理1 h再用不同浓度CdCl2处理细胞24 h,Western blot检测自噬标志蛋白LC3B-Ⅱ/Ⅰ表达量,激光共聚焦检测细胞自噬质粒(pcDNA3.1-GFP-LC3B,GFP-LC 3)表达量,结果如图2(a,b)所示。图2(a) 显示,只单独使用不同浓度CdCl2处理细胞时,随着镉浓度增加,LC3B-Ⅱ表达量呈现浓度依赖性增加,在8 μmol/L时达到最大值,10 μmol/L时有所下降;RSV共处理后,与镉单独处理组相比,共处理组中LC3B-Ⅱ/Ⅰ表达量进一步增加。图2(b)显示,与单独镉处理相比,共处理组GFP-LC3表达进一步增强。随后我们选用细胞自噬抑制剂3-MA分别联合(0、8、10 μmol/L)Cd2++RSV处理HEK 293T细胞24 h,结果如图2(c)所示,与Cd2+/RSV组相比,3-MA联合处理组中LC3B-Ⅱ/Ⅰ表达水平均显著下降。10 μmol/L Cd2++RSV、10 μmol/L Cd2++RSV+3-MA组检测结果如图2(d)所示,3-MA共处理组GFP-LC3表达量也下降。以上结果表明,白藜芦醇进一步增强镉诱导的细胞自噬,3-MA能减弱这种协同效应。
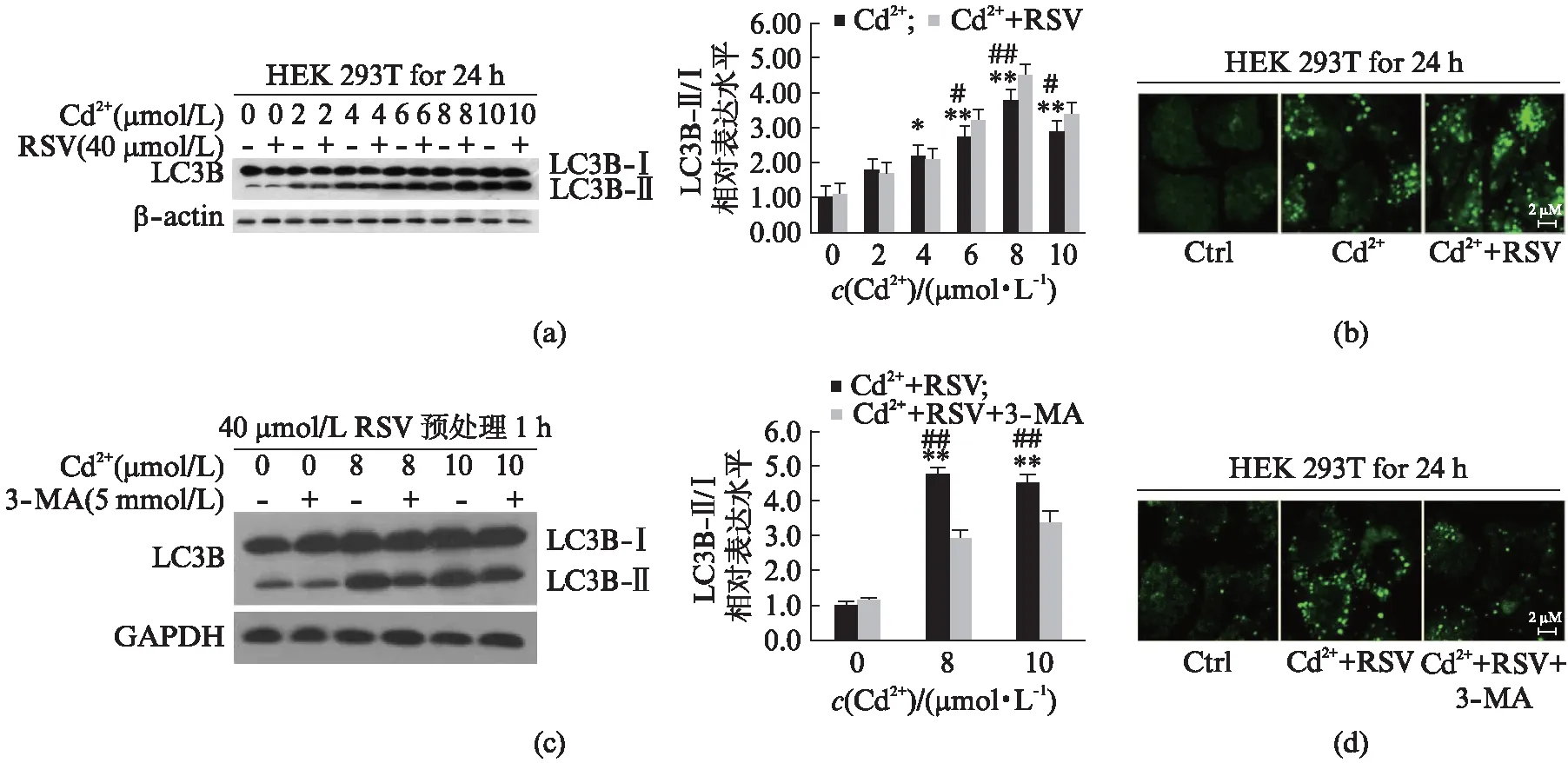
图2 Western blot和激光共聚焦检测自噬基因LC3B-Ⅱ/Ⅰ和GFP-LC3的表达水平Fig.2 The expression of autophagy genes LC3B-Ⅱ/Ⅰ and GFP-LC3 detected by Western blot and confocal microscope(a)和(b): 细胞使用或不使用RSV(40 μmol/L)处理1 h后,暴露在0~10 μmol/L CdCl2中;(c)和(d): 3-MA分别与0、8、10 μmol/L Cd2++RSV联合处理HEK 293T细胞24 h.n=3,mean±SEM;*P<0.05,**P<0.01 vs对照组;#P<0.05,##P<0.01 vs Cd2+/RSV共处理组,Students t-test.
2.3 白藜芦醇对溶酶体活性的影响
选用生理盐水、40 μmol/L RSV、5 mmol/L 3-MA、8 μmol/L和10 μmol/L Cd2++RSV、8 μmol/L和10 μmol/L Cd2++RSV+3-MA分别处理HEK 293T细胞24 h,Western blot检测LC3B-Ⅱ/Ⅰ和溶酶体标志蛋白cathepsin L表达水平,结果如图3所示。图中显示,镉处理能增强细胞中LC3B-Ⅱ/Ⅰ和cathepsin L表达,白藜芦醇加入后进一步增强,但3-MA联合处理较Cd/RSV共处理相比,LC3B-Ⅱ/Ⅰ和cathepsin L表达量均降低,表明白藜芦醇能增强镉诱导的细胞自噬中溶酶体的活性,且当细胞自噬被抑制时,溶酶体活性也会降低。

图3 Western blot检测LC3B-Ⅱ/Ⅰ和cathepsin L的表达水平Fig.3 The expression of LC3B-Ⅱ/Ⅰ and cathepsin L detected by Western blot(a) 用RSV(40 μmol/L)预处理细胞1 h,然后暴露于8、10 μmol/L Cd2+中;(b) 先用RSV(40 μmol/L)预处理细胞,利用3-MA处理或不处理1 h,再暴露于8、10 μmol/L Cd2+中.n=3,mean±SEM;*P<0.05,**P<0.01 vs 对照组;#P<0.05,##P<0.01 vs Cd2+/RSV共处理组,Students t-test.
2.4 白藜芦醇与自噬体溶酶体融合之间的关系
选用生理盐水、3 μmol/L TG、RSV、8 μmol/L和10 μmol/L Cd2++RSV、8 μmol/L和10 μmol/L Cd2++RSV+TG分别处理HEK 293T细胞24 h,Western blot检测cathepsin L、LC3B-Ⅱ/Ⅰ表达量,激光共聚焦显微镜检测对照组、10 μmol/L Cd2+、10 μmol/L Cd2++RSV和10 μmol/L Cd2++RSV+TG处理组细胞内GFP-LC3和溶酶体相关膜蛋白结合蛋白2(Lysosomal-Associated Membrane Protein 2, LAMP2)表达量,结果如图4所示。
图4(a)显示,与Cd2+/RSV处理组相比,Cd2+/RSV/TG联合处理组中cathepsin L表达量减少,说明溶酶体活性降低,但LC3B-Ⅱ/Ⅰ表达量增多,说明细胞自噬依然显著增强。图4(b)显示,与镉单独处理组相比,加入RSV/TG后GFP-LC3表达量均表现为增强,表明自噬效应是增强的,但LAMP2表达量却降低,显示溶酶体活性降低。
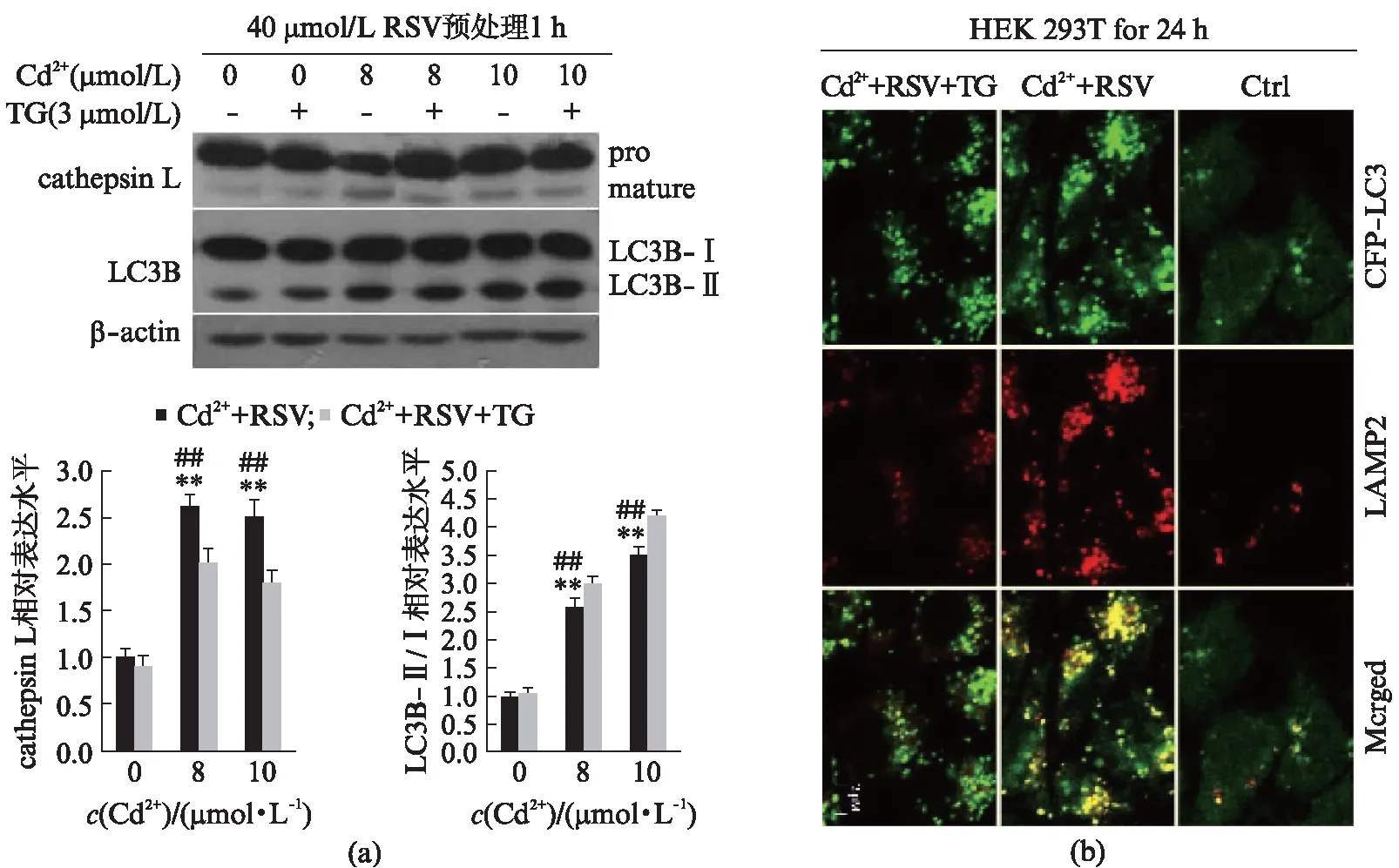
图4 Western blot与激光共聚焦显示自噬-溶酶体融合与RSV之间的关系Fig.4 The relationship between autophagosome-lysosome fusion and RSV detected by western blot and confocal microscope(a) 先用RSV(40 μmol/L)预处理细胞,利用TG处理或不处理1 h,再暴露于8或10 μmol/L Cd2+中;(b) 激光共聚焦结果.红色代表LAMP2免疫荧光,绿色代表GFP-LC3荧光.n=3,mean±SEM;*P<0.05,**P<0.01 vs 对照组;#P<0.05,##P<0.01 vs Cd2+/TG共处理组,Students t-test.
2.5 白藜芦醇能抑制镉诱导的ROS增加
选用不同浓度CdCl2(0~10 μmol/L)处理及先用40 μmol/L RSV预处理1 h再用不同浓度CdCl2处理细胞24 h,检测ROS含量,结果如图5所示,随着镉浓度增加,ROS呈现浓度依赖性增加,加入RSV后ROS含量显著下降。
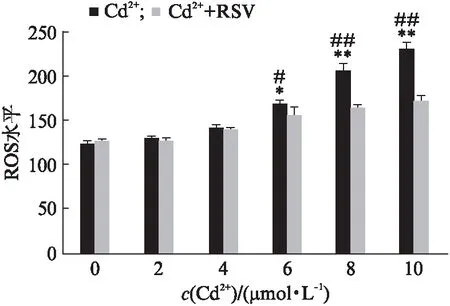
图5 白藜芦醇抑制镉诱导的ROS增高Fig.5 Resveratrol inhibits the increase of ROS which induced by cadmiumn=3,mean±SEM;*P<0.05,**P<0.01 vs 对照组;#P<0.05,##P<0.01 vs Cd2+/RSV共处理组,Students t-test.
2.6 白藜芦醇通过激活SIRT1调节镉诱导的自噬
选用生理盐水、10 μmol/L Cd2+、40 μmol/L RSV、1 μmol/L EX-527+RSV、Cd2++RSV、Cd2++RSV+EX-527、1 mmol/L H2O2、RSV+H2O2、RSV+H2O2+EX-527分别处理HEK 293T细胞24 h,利用Western blot检测LC3B-Ⅱ/Ⅰ和沉默信息调节子2相关酶1(Silent Information Regulation 2 Homolog1, SIRT1)表达,激光共聚焦观察经Cd2+、RSV/Cd2+和EX-527/RSV/Cd2+处理后的细胞荧光含量,结果如图6所示。图6(a,b)显示,不管是镉处理还是H2O2处理,单处理中LC3B-Ⅱ/Ⅰ和SIRT1蛋白表达量均增加,而EX-527联合处理会抑制这三种蛋白的增强;激光共聚焦实验也表明,RSV/Cd2+处理组中细胞内自噬体溶酶体融合较多,添加EX-527后,GFP-LC3和LAMP2表达水平均下降(图6(c))。
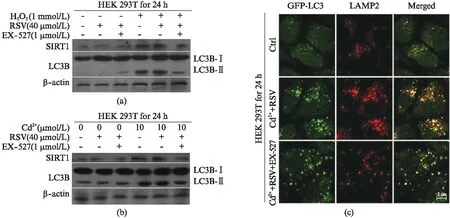
图6 白藜芦醇增强镉诱导的自噬体溶酶体融合以及STRT1的表达量变化Fig.6 The relationship between resveratrol enhances autophagy induced by cadmium and STRT1(a) RSV(40 μmol/L)/EX-527(1 μmol/L)/Cd2+(10 μmol/L)共处理细胞24 h;(b) RSV(40 μmol/L)/EX-527(1 μmol/L)/H2O2(1 mmol/L)共处理细胞24 h;(c) 激光共聚焦结果,红色代表LAMP2免疫荧光,绿色代表GFP-LC3荧光.
2.7 白藜芦醇对镉诱导的细胞凋亡的影响
选用生理盐水、10 μmol/L Cd2+、20 μmol/L Cd2+、40 μmol/L RSV以及Cd2++RSV分别处理细胞24 h后,TE2000-U显微镜观察细胞形态,Western blot分析caspase-3表达,流式细胞仪检测凋亡情况,结果如图7(见第58页)所示。图7(a)显示: RSV单独处理与对照组细胞形态没有明显变化,而镉处理组中细胞发生明显皱缩,变圆,高浓度镉处理时还出现大量漂浮,经RSV共处理后皱缩细胞数量明显减少,说明白藜芦醇能一定程度地削弱镉诱导的HEK 293T细胞形态改变。图7(b)显示镉诱导细胞中caspase-3表达量呈浓度依赖性增加,白藜芦醇共处理后有所下降。流式细胞术也表示,镉诱导细胞凋亡现象被白藜芦醇阻滞(图7(c))。
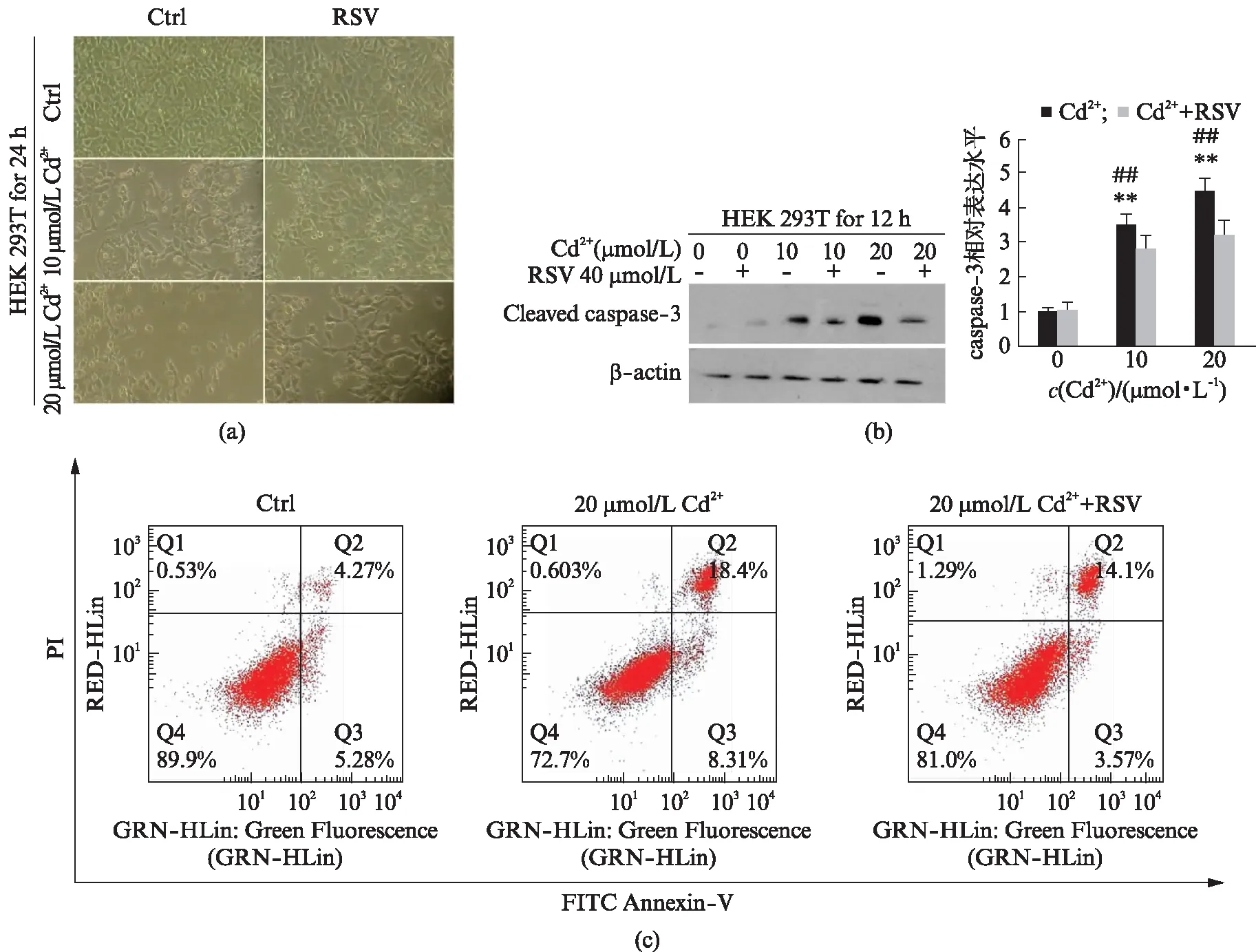
图7 白藜芦醇对镉诱导的HEK293T细胞凋亡的影响Fig.7 Effect of resveratrol on HEK293T cell apoptosis induced by cadmium细胞使用或不使用 RSV(40 μmol/L)处理1 h后,暴露在10或20 μmol/L CdCl2中.(n=3,mean±SEM;*P<0.05,**P<0.01 vs 对照组;#P<0.05,##P<0.01 vs Cd2+/RSV共处理组,Students t-test).
3 讨 论
镉作为一种工业重金属具一定毒性,且易在体内积聚,引起镉中毒。有研究表明,长期接触镉会引起组织衰老,肾功能损害,肝、脑、睾丸及胎盘等器官受损及产生肿瘤等[23]。当体内镉聚集到一定程度造成细胞损害时,会引起细胞内的一种保护机制,即细胞自噬。细胞自噬广泛存在于生物体内,在维持细胞稳定性方面起着重要作用。白藜芦醇是一种有生物化学活性的天然分子,具抗氧化、抗肿瘤功能,近年来,更有研究显示,白藜芦醇可诱导细胞自噬。本研究建立在HEK 293T细胞暴露在低浓度镉24 h,其细胞状态完好的前提下,利用透射电子显微镜、免疫印迹分析、激光共聚焦及流式细胞术等实验方法,探讨白藜芦醇与镉诱导细胞自噬和凋亡的关系及其生物学作用。
研究结果显示镉处理可以引起细胞中自噬体形成增多,推断镉可诱导HEK 293T细胞发生细胞自噬,白藜芦醇共处理后自噬标志蛋白水平进一步增强,表明白藜芦醇能够增强镉诱导的自噬效应,这与Zhong等[24]发现白藜芦醇可以增强卵巢癌细胞凋亡和自噬活性的结果是相通的。我们发现溶酶体标志蛋白cathepsin L的表达量是随着自噬的变化而变化,运用自噬体溶酶体融合抑制剂TG共处理后,细胞自噬标志蛋白活性显著增强,标明自噬依然被激活,但溶酶体活性却显著降低,推断白藜芦醇介导的细胞内溶酶体活性变化可能依赖于细胞自噬,其起作用的阶段可能发生在自噬体与溶酶体融合之前。
活性氧(ROS)被认为是许多自噬信号通路的基本自噬信号分子。SIRT1是依赖于NAD+蛋白脱乙酰基转移酶家族成员之一,在调节相关基因表达、细胞自噬和凋亡过程中发挥着重要的作用[25]。体内外很多研究结果表明,镉中毒会引起体内外各种细胞ROS水平增加,而白藜芦醇可通过调节SIRT1表达水平降低细胞ROS含量,达到抑制机体氧化应激的作用[26]。Ping等[27]也发现,通过将人HTR8/SVneo细胞系暴露于H2O2建立氧化应激体外模型,RSV共处理可通过诱导SIRT1依赖性自噬以预防H2O2诱导细胞氧化应激和凋亡。本实验结果也表明,白藜芦醇可降低镉诱导的ROS水平,并在H2O2作为阳性对照的基础上显示,白藜芦醇对镉诱导的自噬与对H2O2诱导的作用机制可能相同,依赖于其抗氧化能力,且在作用过程中SIRT1表达显著上升,说明SIRT1起着非常重要的调节作用,推测白藜芦醇可能是通过激活SIRT1来增强镉诱导的细胞自噬。这与白藜芦醇通过介导SIRT1和PI3K/AKT/mTOR信号通路增强线粒体吞噬作用,从而保护骨质疏松大鼠的成骨细胞[28]的结果一致。
除此之外,前期很多报道都表明,细胞自噬与凋亡之间存在复杂且紧密的关系,当细胞自噬水平降低时,众多蛋白质和破损细胞器累积,导致细胞凋亡[29]。在本研究中,我们将白藜芦醇与高浓度镉进行共处理,结果显示,白藜芦醇可以抑制高浓度镉诱导的细胞形态改变。caspase-3是caspase蛋白酶家族的成员之一,在真核细胞凋亡中扮演着重要角色,白藜芦醇会降低镉诱导的caspsse-3的表达,这些都表明白藜芦醇对镉诱导的细胞凋亡有一定的抑制作用。尽管如此,细胞自噬与细胞凋亡之间的关系错综复杂,涉及到众多调控通路,所以白藜芦醇在调控细胞凋亡上的具体作用还不得而知,仍需要我们进一步探索。
综上所述,白藜芦醇可以通过进一步增强镉诱导的细胞自噬达到保护细胞的作用,并且这种增强发生在与溶酶体融合之前,其作用机制与白藜芦醇的抗氧化性有关并与SIRT1激活有密切的联系,此外,白藜芦醇还阻碍了镉诱导的细胞凋亡现象,体现了白藜芦醇潜在的医用价值。

