UPLC-MS/MS法分析柴胡郁金香颗粒中9个药效成分在抑郁症大鼠体内的药代动力学研究
姜春凤,薛光辉,付丽娟,张金秋,高 颖,高 陆,
(1.长春中医药大学药学院,吉林 长春 130117;2.吉林省现代中药工程研究中心有限公司,吉林 长春 130102)
柴胡郁金香颗粒(CHYJX)为经典名方柴胡疏肝散的演变方,由柴胡、甘草、香附、郁金有效提取物和牡蛎超微粉组成,具有疏肝解郁、镇静安神、抗抑郁等作用。中医学理论表明[1],抑郁症的病因主要是“情志不舒和气机郁滞”,肝主疏泄,是调节抑郁症的主要脏器。柴胡是肝经引经药,其抗抑郁作用受到各国学者的广泛关注[2]。有研究表明,柴胡皂苷a、柴胡皂苷c、柴胡皂苷d以及甘草次酸、甘草苷、异甘草素、甘草素、芒柄花素、甘草酸具有显著的抗抑郁及肝脏保护作用[3-12]。药物的药理效应与药效成分在体内的含量变化和分布特征密切相关[13]。药代动力学反映药物在生物体内吸收、分布、代谢和排泄规律,指导药物临床应用,在疾病治疗中发挥着重要作用。因此,阐明药物中主要药效成分在疾病模型体内的药代动力学特征非常必要。目前,超高效液相色谱-串联质谱(UPLC-MS/MS)法在分析复杂的中药成分及其体内代谢物研究中具有独特优势,是药代动力学分析的有力手段[14-15]。
本研究拟采用UPLC-MS/MS法定性、定量分析慢性不可预知温和应激(CUMS)诱导的抑郁症大鼠口服CHYJX后血浆中药效成分在体内的药代动力学变化,阐明其药代动力学特征,旨为CHYJX的药效物质基础及临床应用提供理论依据。
1 实验部分
1.1 仪器与装置
Thermo Vanquish超高效液相色谱仪、TSQ Quantis三重四极杆质谱仪(配有电喷雾离子源ESI及Xcalibur数据处理系统)、ST8R型高速冷冻离心机:美国Thermo公司产品;MS205DU型十万分之一天平:梅特勒-托利多仪器(上海)有限公司产品;JJ1000型电子天平:常熟市双杰测试仪器厂产品;SB1200DT超声波清洗机:宁波新芝生物科技有限公司产品;Milli-Q超纯水系统:美国Millipore公司产品;BT25S型电子天平:德国Sartorius公司产品;HH-4型数显恒温水浴锅:常州智博睿仪器制造有限公司产品;MTN-2800D型氮吹仪:天津Auto-science仪器公司产品。
1.2 试剂与样品
CHYJX(20191008):吉林省现代中药工程研究中心有限公司产品;甘草素(20052404,99.86%)、异甘草素(20112401,99.04%)、甘草酸(20070203,98.27%)、芒柄花素(20121601,99.40%)、柴胡皂苷c(20081202,99.90%)对照品:成都格利普生物科技有限公司产品;甘草次酸(110723-201715,99.6%)、甘草苷(111610-201908,95.0%)、柴胡皂苷a(110777-201912,94.8%)、柴胡皂苷d(110778-201912,96.3%)对照品:中国食品药品检定研究院产品;甲醇和乙腈(色谱级)、甲酸(质谱级):美国Fisher公司产品。
雄性Wistar大鼠(体质量(200±20) g):长春亿斯实验动物技术有限责任公司产品。
1.3 实验条件
1.3.1色谱条件 Thermo Hypersi 1 GOLD Aq C18色谱柱(2.1 mm×100 mm×1.9 μm);流动相:A为0.1%甲酸水溶液,B为乙腈;梯度洗脱程序:0~3 min(90%A),3~10 min(90%~65%A),10~30 min(65%~35%A),30~56 min(35%~0%A),56~58 min(0%A),58~58.1 min(0%~90%A),58.1~60 min(90%A);流速0.2 mL/min;柱温30 ℃;进样量5 μL。
1.3.2质谱条件 电喷雾离子源(ESI);多反应监测(MRM)模式;喷雾电压3.5 kV;雾化气温度20 ℃;鞘气压力34.48 kPa;辅助气流速0.6 L/h;离子传输管温度275 ℃;采用Xcalibur分析软件处理数据。优化的质谱条件列于表1。

表1 化合物和内标物的MRM参数Table 1 MRM parameters of compounds and internal standard
1.4 生物样品收集
1.4.1动物实验 选择12只雄性Wistar大鼠,置于标准SPF(specific pathogen free)级动物实验室,适应环境饲养1周后,对大鼠进行一系列慢性不可预知的温和刺激,包括夹尾2 min、45 ℃水中强迫游泳5 min、10 ℃水中强迫游泳5 min、间歇性噪声(85 dB)刺激1 h、禁食24 h、禁水24 h、置于弄脏的笼子中24 h、置于45°倾斜的笼子中24 h、昼夜颠倒。每只大鼠每天随机接受2种刺激,持续35天后评价大鼠对蔗糖的偏好度和强迫游泳实验不动时间,蔗糖偏好度低下且强迫游泳实验不动时间显著延长的大鼠为抑郁症成模大鼠。
1.4.2血浆样品收集 选择6只造模成功的抑郁症大鼠,禁食禁水12 h后,灌胃给予CHYJX混悬液,依据人体临床常用剂量按体表面积法折算成大鼠剂量(0.45 g/kg),分别于给药后0.083、0.17、0.25、0.33、0.5、0.75、1、1.5、2、3、4、6、8、10、12和24 h经眼眶静脉丛取500 μL血于1.5 mL肝素化EP管中,在4 ℃下以3 500 r/min离心15 min,吸取上层血浆于EP管中,-80 ℃冰箱保存。
1.5 实验方法
1.5.1标准溶液及QC的制备 分别精密称取适量的柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、甘草次酸、甘草苷、异甘草素、甘草素、芒柄花素、甘草酸对照品,用甲醇配制成单一对照品储备液。再精密量取适量的各对照品溶液,以乙腈为稀释液,配制系列混合对照品溶液,于4 ℃冰箱保存。
1.5.2内标溶液的制备 精密称取11.08 mg地高辛对照品(相当于10.88 mg地高辛),置于10 mL容量瓶中,用乙腈定容至刻度,得到1.09 g/L地高辛储备液。以乙腈为稀释液,配制21.76 μg/L内标溶液。
1.5.3血浆样品处理 量取200 μL 1.4.2节收集的血浆样品于EP管中,加入10 μL内标溶液和600 μL乙腈,涡旋振荡2 min,在4 ℃下以13 000 r/min离心20 min,取上清液,用30 ℃氮气吹干。向残渣中加入200 μL乙腈-水溶液(1∶1,V/V),涡旋振荡2 min,以13 000 r/min离心15 min,吸取5 μL上清液进行UPLC-MS/MS分析。
1.5.4方法学考察 选择性考察:分别量取200 μL 6只大鼠空白血浆、加入10 μL被测物的大鼠空白血浆、给药1 h后的大鼠血浆,按照1.5.3节方法处理,评价方法的选择性。
残留考察:检测3次被测物的定量上限(ULOQ)样品,即表2中线性范围最高点浓度样品,再检测空白样品,评价方法的样品残留。
线性考察:分别精密吸取10 μL系列浓度的对照品溶液,加入200 μL空白血浆,按照1.5.3节方法处理后进样,记录峰面积,以被测物与内标物的峰面积比为纵坐标(y),相应的浓度为横坐标(x)进行线性回归,加权最小二乘法计算标准曲线回归方程和相关系数。
准确度考察:取大鼠的空白血浆配制被测物高、中、低和定量下限(LLOQ)4个浓度的质量控制(QC)样品,共制备3批,每批每个浓度配制6份平行样品,按1.5.3节方法处理后进样,根据标准曲线计算QC样品的浓度和方法的准确度与精密度。
提取回收率:配制6份含9个被测物的高、中、低和LLOQ 4个浓度的血浆样品,按照1.5.3节方法处理后进样分析;另取经乙腈-水溶液(1∶1,V/V)配制相同浓度的被测物和内标样品溶液进样分析。将2种处理方法得到的被测物和内标物的峰面积比值进行比较,计算方法的提取回收率。
基质效应考察:各量取200 μL 6只抑郁症大鼠的空白血浆,按1.5.3节方法处理,不加入内标溶液,氮气吹干后,向残渣中加入200 μL经乙腈-水溶液(1∶1,V/V)配制的被测物对照品溶液和内标溶液进样分析;另取经乙腈-水溶液(1∶1,V/V)配制相同浓度的被测物和内标样品溶液进样分析。记录2种方法得到的被测物和内标物的峰面积,计算被测物和内标物的基质因子,以及内标归一化的基质因子,评价方法的基质效应。
稳定性考察:取200 μL大鼠的空白血浆,加入混合对照品溶液,制备被测物高、低2个浓度的QC样品,每个浓度平行6份,按照1.5.3节方法处理,在室温下于1天内的不同时间进样测定,评估24 h内的稳定性;将QC样品于-20 ℃保存15天后测定,评估15天内的稳定性;反复冻融3次后进行测定,评价反复冻融稳定性。
2 结果与讨论
2.1 方法学考察
2.1.1选择性 选择性用以判定目标分析物和内标与基质中内源性组分或样品中其他组分区分的程度,6只大鼠的空白血浆、空白血浆加入被测物和内标物、以及给药1 h后血浆样品中被测物和内标物的检测结果示于图1。结果发现,被测物和内标物在保留时间内没有干扰,峰形良好,表明该方法具有良好的专属性。
2.1.2残留考察 重复进样3次ULOQ样品后,再进样空白样品,在空白样品中未提取到被测物的色谱峰,表明不存在被测物残留。
2.1.3线性和LLOQ 大鼠血浆中9种被测物与内标物的线性方程、线性范围和相关系数(r2)列于表2。可见,线性关系良好,相关系数为0.992 5~0.998 1,均大于0.99,线性方程可用于计算样品中被测物含量。
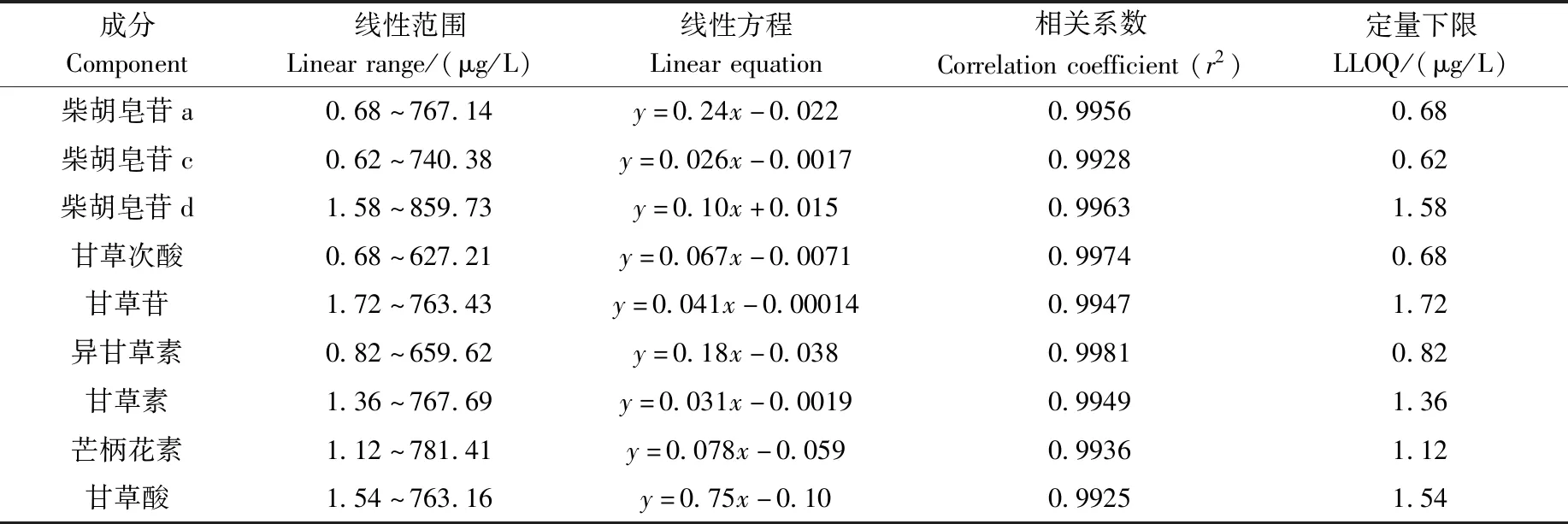
表2 线性关系考察Table 2 Investigation of linear relationship
2.1.4精密度与准确度 大鼠血浆中9种被测物的精密度与准确度列于表3。高、中、低和LLOQ浓度QC样品的批内和批间准确度在88.38%~110.94%之间,在QC样品标示值的±15%之内;精密度(RSD)在3.75%~10.74%之间,小于15%。表明本方法的精密度与准确度良好。

表3 本方法的精密度与准确度(n=6)Table 3 Precision and accuracy of this method (n=6)
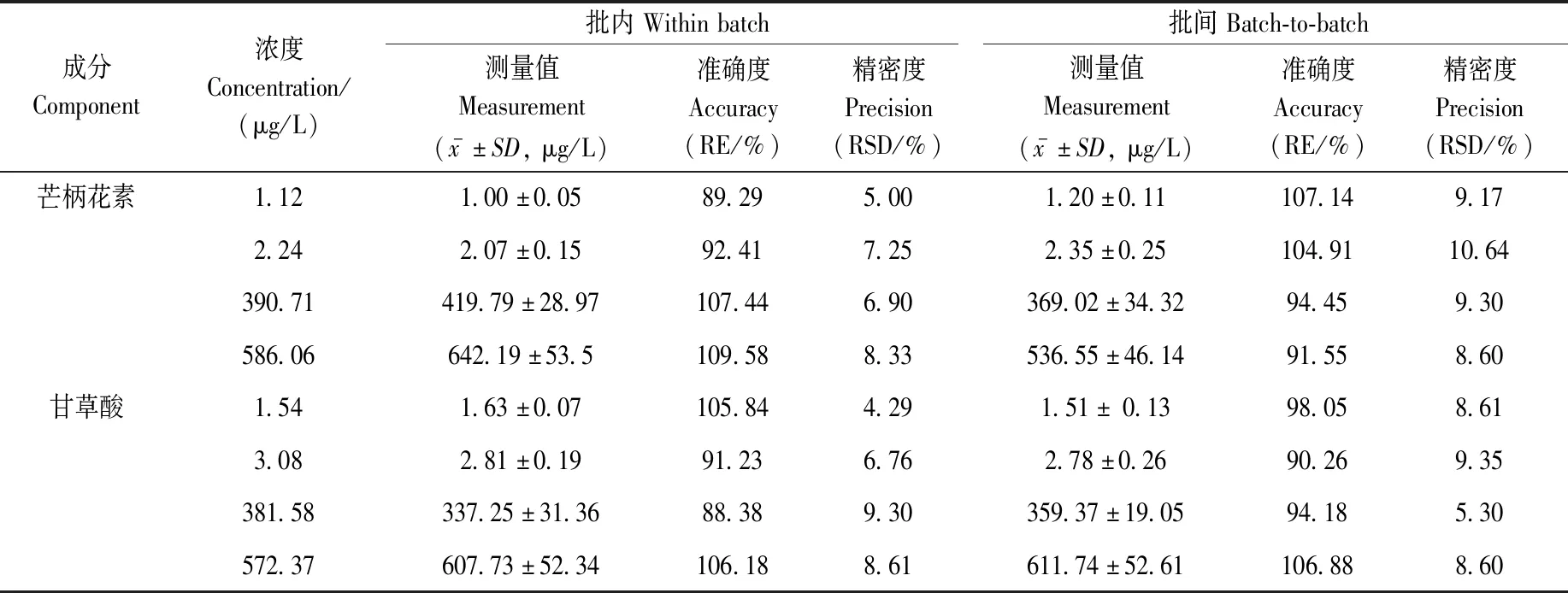
续表3
2.1.5提取回收率和基质效应 血浆中9种被测物的提取回收率和基质效应列于表4。提取回收率在88.74%~109.76%之间,RSD小于15%;基质效应在89.63%~108.34%之间,变异系数小于15%。表明本方法的提取回收率和基质效应良好。

注:a 空白血浆;b 空白血浆添加被测物和内标物;c 给药1 h的大鼠血浆图1 血浆样品的UPLC-MS/MS 色谱图Fig.1 UPLC-MS/MS chromatograms of plasma samples
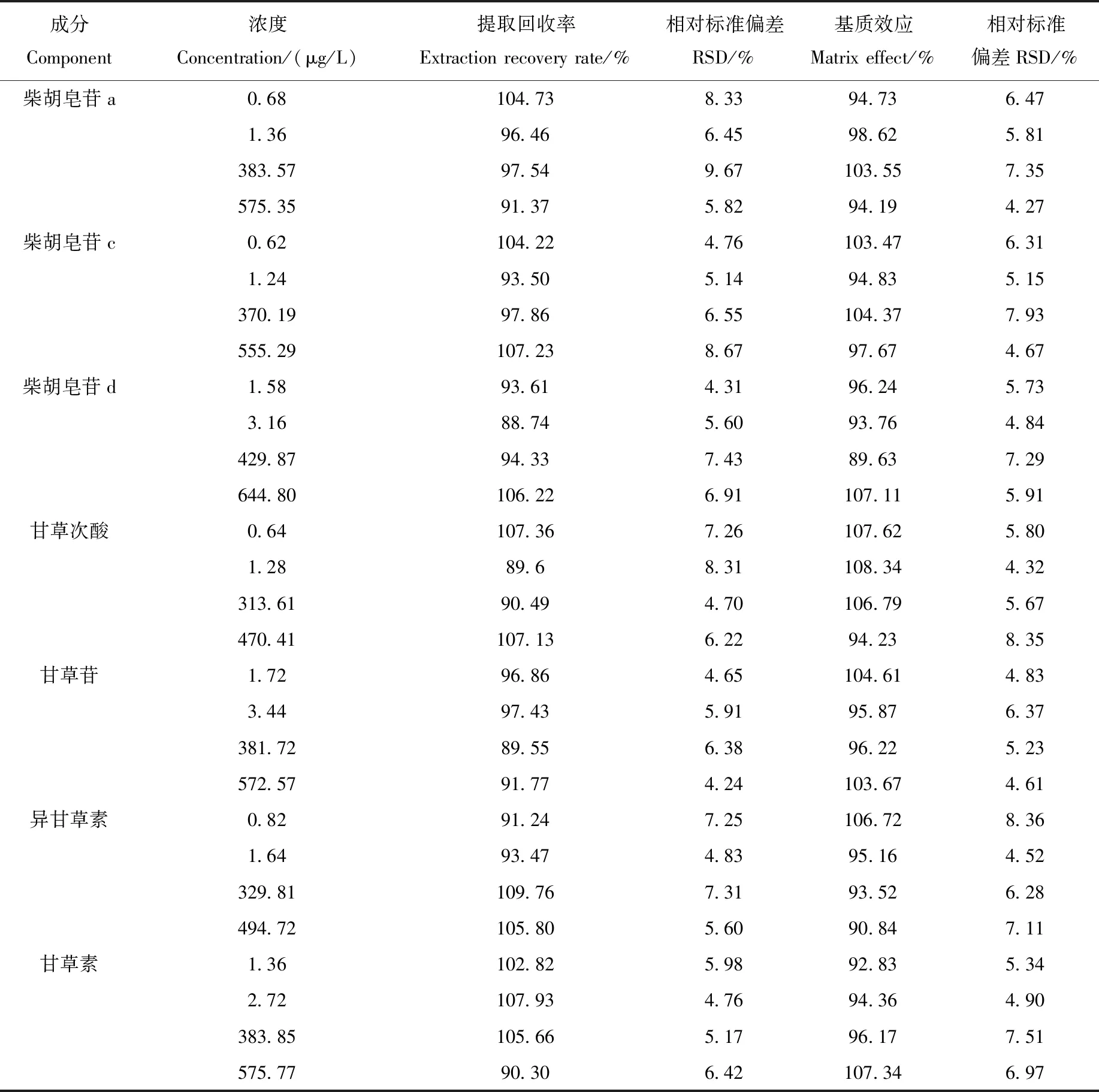
表4 方法的提取回收率(n=6)Table 4 Extraction recovery rate of the method (n=6)
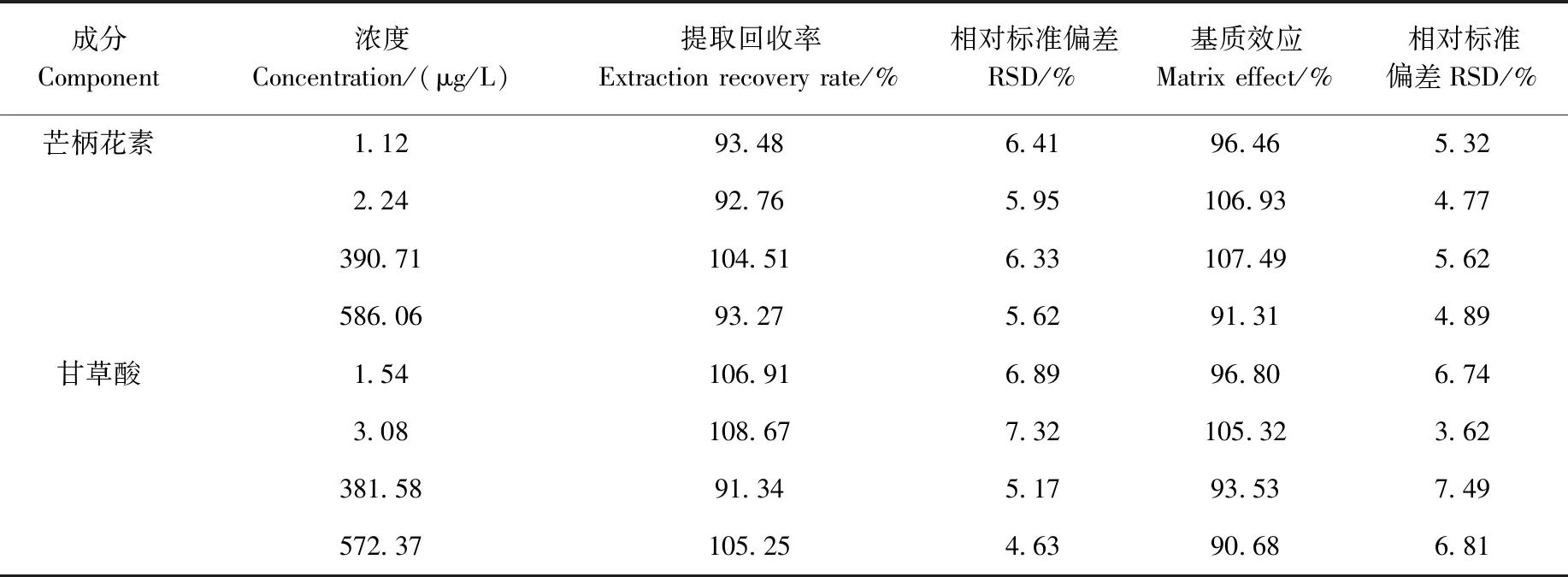
续表4
2.1.6稳定性 稳定性能够反映环境改变对样品的影响,将血浆样品在室温存放24 h,-20 ℃存放15天以及3次反复冻融,样品中9种被测物的检测准确度和精密度列于表5。准确度在90.56%~107.15%之间,在QC样品标示值的±15%之内;精密度(RSD)在3.23%~8.20%之间,小于15%。表明样品的稳定性良好。
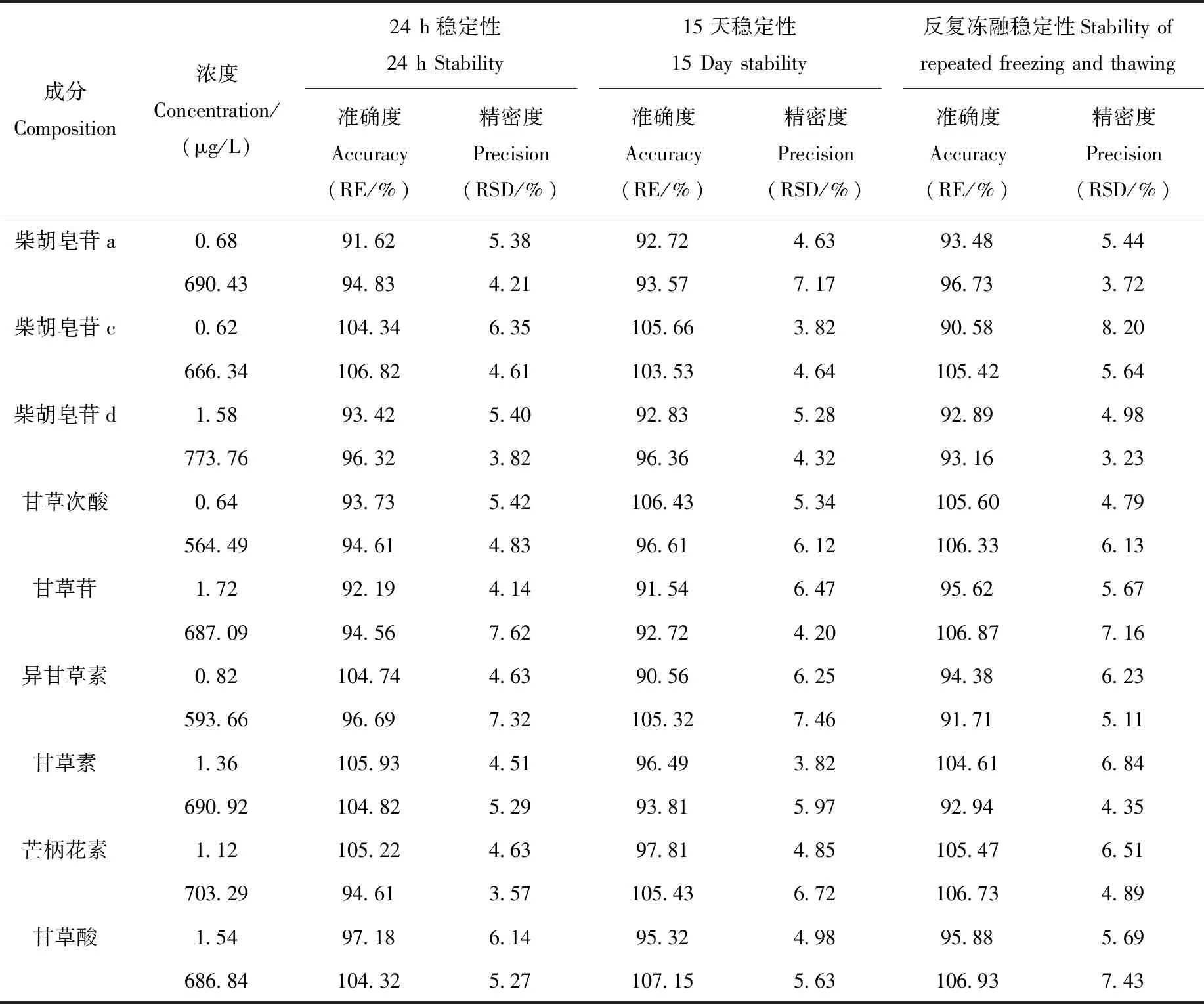
表5 化合物在大鼠血浆中的稳定性(n=6)Table 5 Stability of the compounds in rat plasma (n=6)
2.2 药代动力学研究
利用本方法检测抑郁症大鼠血浆中9种被测物在给药后不同时间点的含量,绘制平均血药浓度-时间曲线,并通过DAS 3.1.6软件计算CHYJX的药代动力学参数,结果分别示于图2,列于表6。CHYJX中9个药效成分的Tmax为0.27~4.06 h,t1/2为3.51~7.76 h,平均驻留时间MRT(0-t)为7.13~11.48 h,MRT(0-∞)为6.61~21.46 h。药时曲线下面积AUC(0-t)为70.06~1 280.4 μg·h/L,AUC(0-∞)为79.86~1 407.83 μg·h/L。其中,甘草酸的AUC(0-t)最大,tmax最小,表明甘草酸在血浆中的药物暴露量最大,并且能够在胃肠道被快速吸收,甘草酸可通过炎症机制发挥抗抑郁作用[16],是CHYJX中的重要成分。除甘草次酸外,其他8种成分的tmax均小于0.51 h,表明CHYJX能够在胃肠道被快速吸收。甘草酸在肠道菌群的作用下可转化成甘草次酸[17],本研究中甘草次酸表现出较晚的Tmax和较长的t1/2,可能与肠道菌群代谢有关,是CHYJX中的长效成分。9个成分的t1/2为3.51~7.76 h,表明单次CHYJX给药后,其在体内能够被尽快消除,不易产生残留和蓄积,药物安全性好。通过药时曲线结果发现,柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、异甘草素、甘草素、甘草酸这6个成分均具有第2个吸收峰,表明它们在体内可能发生了肝肠循环、不同化合物转化、多部位吸收或肠道外排现象。
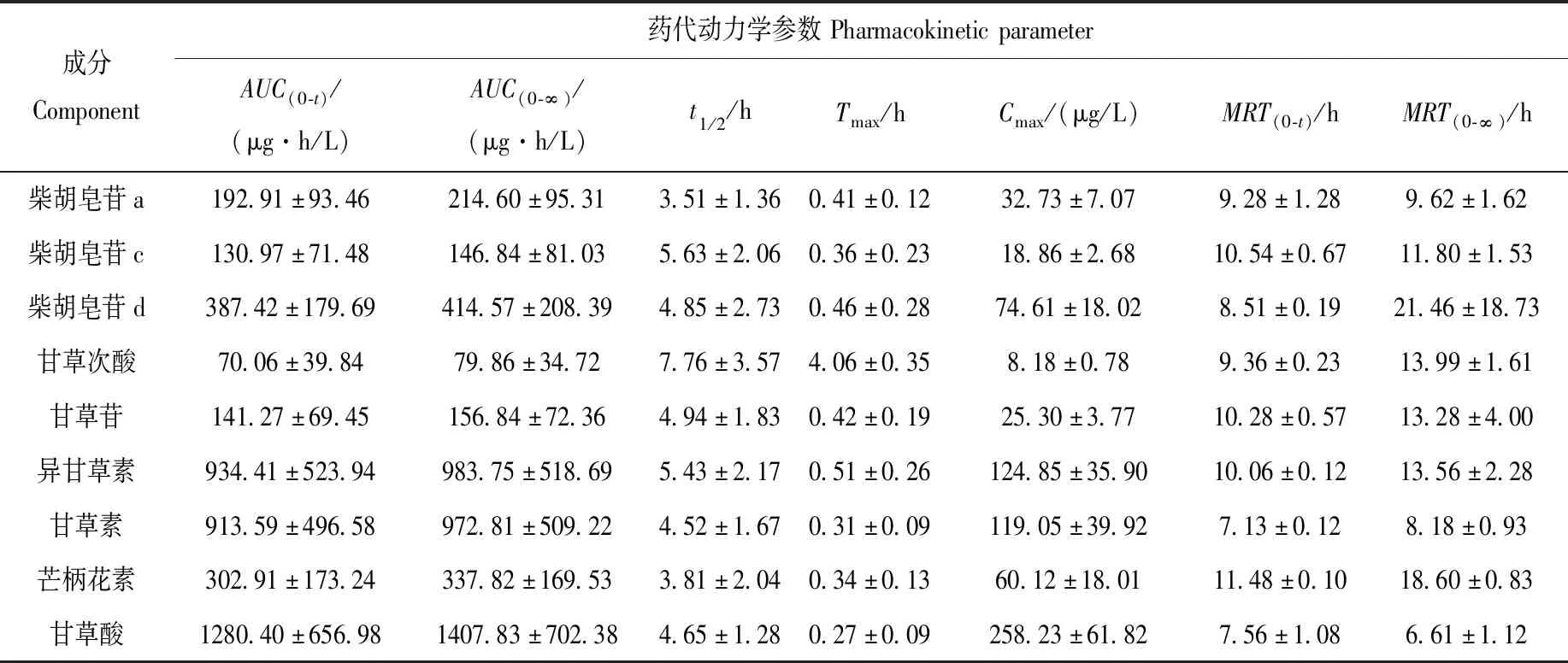
表6 抑郁症大鼠口服CHYJX后9个药效成分的药代动力学参数(x±SD,n=6)Table 6 Pharmacokinetic parameters of 9 pharmacodynamic components after oral administration of CHYJX in depressed rats (x±SD,n=6)
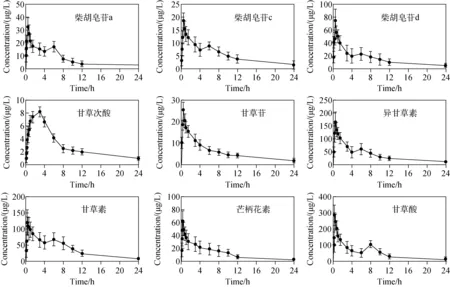
图2 抑郁症大鼠口服CHYJX后9个药效成分的平均血药浓度-时间曲线Fig.2 Average blood concentration-time curves of 9 pharmacodynamic components after oral administration of CHYJX in depressed rats n=6)
3 结论
本研究基于UPLC-MS/MS技术建立了同时定量分析大鼠血浆中柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、甘草次酸、甘草苷、异甘草素、甘草素、芒柄花素、甘草酸等9个成分的方法,该方法简单、灵敏、准确,考察的选择性、残留、线性、精密度与准确度、提取回收率和基质效应、稳定性等结果均符合生物样品定量的分析要求。采用本方法对抑郁症大鼠灌胃CHYJX后血浆中9个成分的含量进行检测。结果表明,随着时间的增加,9个成分的含量在抑郁症大鼠体内呈规律性变化。研究表明,CHYJX在胃肠道能够被快速吸收,体内消除速度较快,不易产生残留和蓄积,药物安全性好。本研究不仅为血浆中这9个成分的同时定量提供参考方法,也为CHYJX的药效物质基础研究及临床应用提供理论支撑。

