高效液相色谱-电感耦合等离子体质谱法分析人血清中的硒形态
姚晓慧,陈绍占,刘丽萍,刘 洋,李乾玉
(1.北京市疾病预防控制中心,食物中毒诊断溯源技术北京市重点实验室,北京 100013;2.首都医科大学公共卫生学院,北京 100069)
硒是人体必需的微量元素之一。Rotruck等[1]发现硒是谷胱甘肽过氧化酶(GSHPx)的必要成分,也是动物体内许多蛋白质的组成成分。硒能清除体内有害自由基,保护身体各器官。硒摄入不足会导致克山病、大骨节病、癌症、心血管疾病、免疫系统疾病等多种病症[2],摄入过量则可导致硒中毒,对人体健康造成危害。体内各种硒化物不同的迁移转化规律和生物活性不仅取决于硒总量,而且与硒的化学形态和浓度水平直接相关[3-4]。研究表明[5],不同形态的含硒化合物对人体的健康状况具有重要的指示作用,分析生物样品中硒形态对有效评估硒的营养作用具有重要意义。血清对经饮食摄入的硒水平变化敏感,是评估人体硒水平应用最多的生物指标之一[6-8]。
目前硒形态的分离检测技术主要有液相色谱-原子荧光光谱(LC-AFS)法、体积排阻色谱(SEC-HPLC)法、高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)法等,其中HPLC-ICP-MS因灵敏度高、线性范围宽、分析速度快,已成为应用最广泛的硒形态分析技术。胡良等[9]采用HPLC-ICP-MS法测定血清中4种硒形态,样品经直接稀释后超滤离心,仅检出亚硒酸盐Se(Ⅳ)。Yu等[10]采用截留分子质量为3 ku的离心浓缩装置离心过滤去除血清中大分子蛋白后,采用HPLC-ICP-MS法分析测定,发现血清中主要为无机硒。
为更全面地探究经饮食途径进入体内硒的水平及形态,本研究拟采用高效液相色谱-电感耦合等离子体质谱法分析人血清中硒酸盐(Se(Ⅵ))、亚硒酸盐(Se(Ⅳ))、硒代胱氨酸(SeCys2)、甲基硒代半胱氨酸(MeSeCys)、硒代蛋氨酸(SeMet)等5种硒形态,希望为硒与人体健康的研究提供支持。
1 实验部分
1.1 仪器与装置
1260型高效液相色谱仪、7700x型电感耦合等离子体质谱仪:美国Agilent公司产品;Milliplus 2150超纯水处理系统:美国Millipore公司产品;超声波清洗机:宁波新芝生物科技股份有限公司产品。
1.2 材料与试剂
柠檬酸、己烷磺酸钠、氨水:优级纯,国药集团化学试剂有限公司产品;甲醇(HPLC级)、蛋白酶XIV:美国Sigma公司产品;亚硒酸根离子溶液(GBW10032)、硒酸根离子溶液(GBW10033)、甲基硒代半胱氨酸(GBW10088)、硒代蛋氨酸(GBW10034)、硒代胱氨酸(GBW10087):购于中国计量科学研究院;超纯水(电阻率18.2 MΩ·cm):由超纯水处理系统制备。
1.3 样品前处理
血清样品:A为正常人血清,B为去除大分子蛋白后的人血清(经0.22 μm滤膜过滤的人血清)。
直接稀释法:取0.5 mL血清样品于15 mL离心管中,加入1 mL超纯水稀释,混匀,以9 000 r/min离心10 min,过0.22 μm水系滤膜,同时做空白对照。
超声酶解法:取0.5 mL血清样品于15 mL离心管中,加入1 mL超纯水稀释,然后加入10 mg蛋白酶XIV涡旋混匀后于37 ℃加热超声2 h,以9 000 r/min离心10 min,过0.22 μm水系滤膜,同时做空白对照。
1.4 实验条件
1.4.1色谱条件 色谱柱:Agilent ZORBAX SB-Aq C18柱(250 mm×4.6 mm×5 μm);流动相:10 mmol/L柠檬酸和5 mmol/L己烷磺酸钠(含1%甲醇,pH 4.0);流速0.8 mL/min;进样量20 μL。
1.4.2质谱条件 射频功率1 550 W;载气为高纯氩气,流速0.65 L/min;补偿气流速0.45 L/min;射频电压1.80 V;采样深度8.0 mm;泵速0.3 r/s。
2 结果与讨论
2.1 样品前处理条件的优化
本实验分别采用直接稀释法和超声水浴酶解法分析人血清样品,结果列于表1。对同一血清样品,直接稀释法仅能检出低含量的Se(Ⅳ);而采用蛋白酶XIV进行超声水浴酶解法处理样品可以检测出3种硒形态,但随着蛋白酶加入量的增加,各硒形态的浓度并未显著增加,且SeMet的含量略有降低。由于蛋白酶XIV价格较高,本研究选择蛋白酶加入量10 mg。

表1 2种前处理方法对血清中硒形态分析结果的比较Table 1 Comparison of two pretreatment methods for speciation analysis of selenium in serum
2.2 色谱条件的优化
2.2.1流动相优化 借鉴文献[11],以柠檬酸为流动相,5 mmol/L己烷磺酸钠为离子对试剂,考察10、15、20、25 mmol/L柠檬酸对硒形态分离和灵敏度的影响。实验结果表明,随着柠檬酸浓度的增加,5种硒形态的保留时间以及峰高和峰面积变化不大,但分离度越来越差。因此,选择柠檬酸浓度为10 mmol/L。
流动相pH值是影响硒形态分离的主要因素,本实验考察了流动相pH 2.0~5.5时对5种硒形态分离情况的影响,示于图1。结果表明,当10 mmol/L柠檬酸-5 mmol/L己烷磺酸钠流动相的pH值为2.0时,5种硒形态的分离时间长达20 min;随流动相pH值的增大,SeMet的保留时间缩短,但对Se(Ⅵ)和Se(Ⅳ)的分离效果有明显影响;当pH为4.0时,5种硒形态的分离效果最好,无衍生峰,且灵敏度最佳;当pH>5.0时,Se(Ⅵ)和Se(Ⅳ)不能有效分离,且出现1个衍生峰。因此,选择流动相pH 4.0。
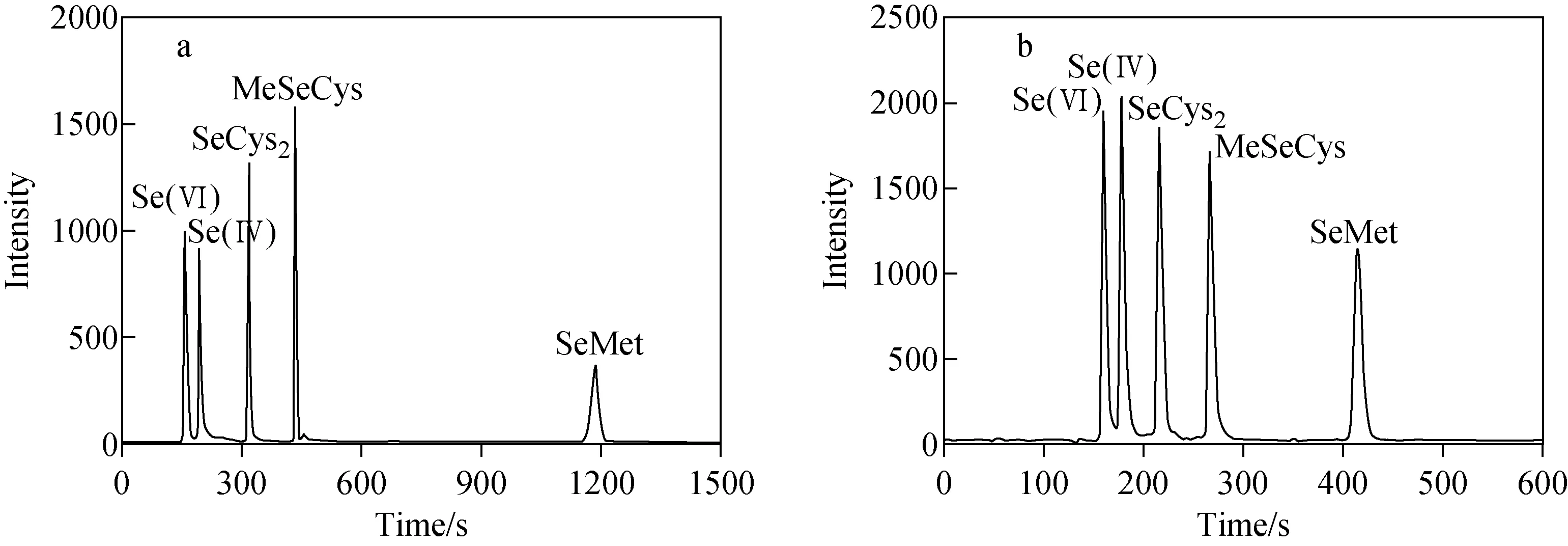
图1 流动相pH 2(a)和pH 4(b)的分离色谱图Fig.1 Chromatograms of mobile phases of pH 2 (a) and pH 4 (b)
2.2.2甲醇浓度对信号强度的影响 甲醇作为增敏剂被广泛应用于HPLC-ICP-MS检测中,本研究考察了在流动相中加入0%~5%不同浓度甲醇对硒形态信号强度的影响,趋势图示于图2。结果表明,向流动相中加入甲醇对5种硒形态具有明显的增敏效果,当加入1%甲醇后,5种硒形态的信号强度均比无甲醇时增加1倍;随着甲醇浓度的增加,增敏效果进入平台期,且在甲醇浓度大于2%时,信号强度有所下降。由于过量的甲醇会富集在ICP-MS进样锥上沉积为碳,影响测定结果,因此选择1%甲醇为增敏剂。

图2 流动相中甲醇浓度对5种硒形态信号强度的影响Fig.2 Effect of methanol concentration in mobile phases on signal intensity of five selenium compounds
2.2.3样品进样量优化 本实验考察了20、25、50、100 μL样品进样量对5种硒形态信号的影响。结果表明,随着进样量的增大,5种硒形态的峰高及峰面积都逐渐增大,但Se(Ⅳ)和Se(Ⅵ)分离效果逐渐变差。综合考虑,选择进样量为20 μL。
2.2.4流速优化 本实验考察了0.6、0.8、1.0、1.2、1.5 mL/min流速对5种硒形态分离效果的影响。结果表明,随着流速的不断增大,硒形态的保留时间逐渐缩短,造成Se(Ⅳ)和Se(Ⅵ)分离效果变差;当流速为0.8 mL/min时,各硒形态分离效果最佳,示于图3。综合考虑分离度、保留时间等因素,选择流动相的流速为0.8 mL/min。
2.3 线性范围和检出限
分别配制0.0、0.5、1.0、5.0、10.0、25.0、50.0和100.0 μg/L的Se(Ⅵ)、Se(Ⅳ)、SeCys2、MeSeCys和SeMet 5种硒形态混合标准系列溶液,在优化的实验条件下考察线性范围。结果表明,在0.0~100.0 μg/L范围内,5种硒形态的线性关系良好,相关系数(r)均大于0.999,色谱分离图示于图4。采用逐级稀释法测定方法检出限和定量限,以3倍信噪比(S/N)对应的浓度为检出限,10倍S/N对应浓度为定量限,结果列于表2。
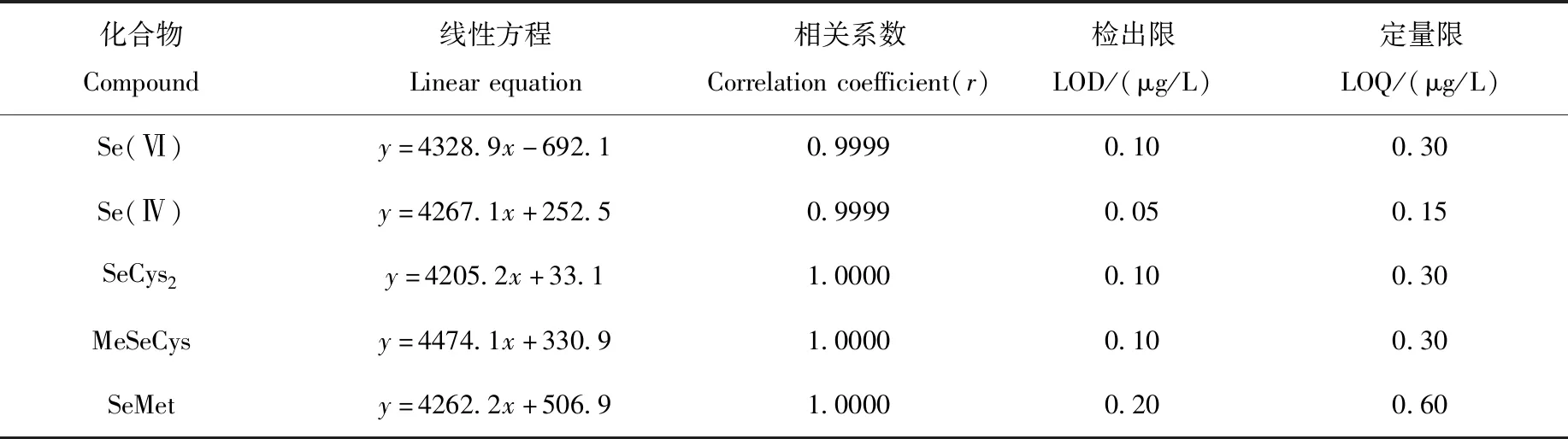
表2 线性方程、检出限及定量限Table 2 Linear equation,LODs and LOQs
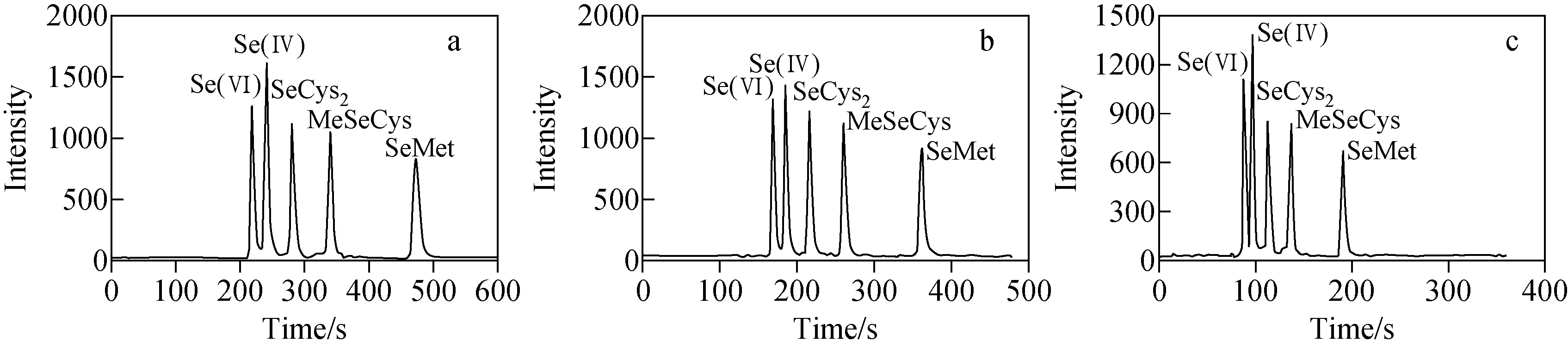
注:a.0.6 mL/min;b.0.8 mL/min;c.1.5 mL/min图3 不同流速下5种硒形态的色谱图Fig.3 Chromatograms of five selenium compounds under different flow speeds
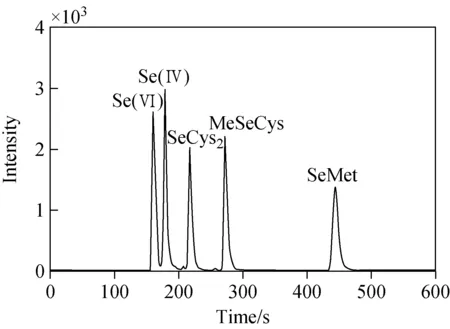
图4 5种硒形态混合标准溶液色谱图(10 μg/L)Fig.4 Chromatogram of standard solution of five selenium forms (10 μg/L)
2.4 方法的准确性和重复性
2.4.1样品加标回收率及精密度 选取血清样品A和B各1份,添加5.0、10.0、30.0 μg/L 3个不同浓度水平的5种硒形态混合标准溶液,进行加标回收和精密度实验,以考察方法的准确性和重复性,结果列于表3和表4。结果表明,血清A中,Se(Ⅳ)的加标回收率在35.1%~39.3%之间,SeCys2的加标回收率在57.7%~66.0%之间,其余3种硒形态的加标回收率在90.8%~100.0%之间;血清B中,SeCys2的加标回收率在69.5%~72.5%之间,其余4种硒形态的加标回收率在87.9%~110.3%之间;血清A和B硒形态的RSD均小于5%。添加浓度和本底的血清硒形态色谱图示于图5。
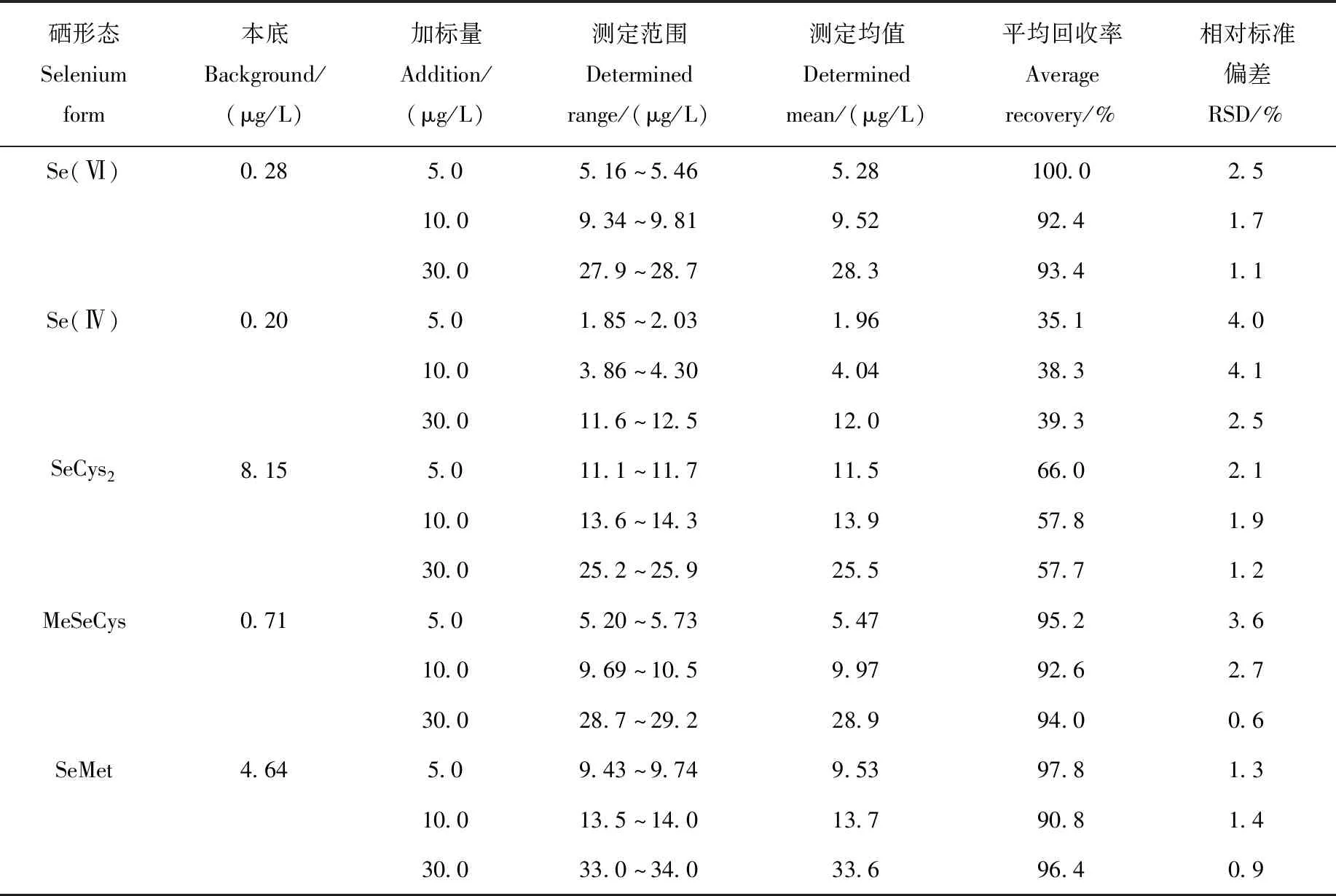
表3 血清A精密度及加标回收率测定结果(n=6)Table 3 Determination results of precision and spiked recovery of serum A (n=6)
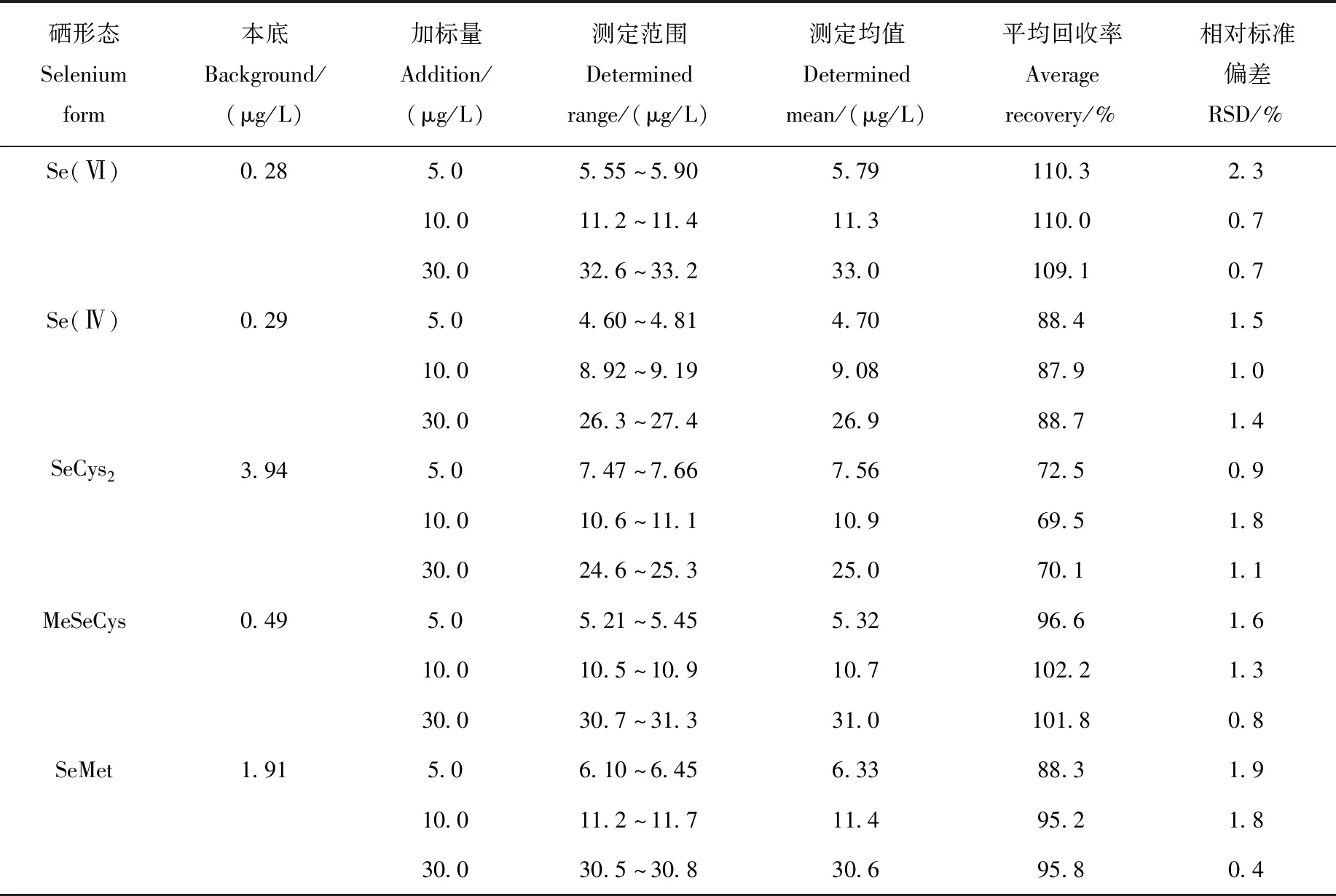
表4 血清B精密度及加标回收率测定结果(n=6)Table 4 Determination results of precision and spiked recovery of serum B (n=6)
为分析Se(Ⅳ)加标回收率较低的原因,取血清A过滤后的滤膜加酸进行消解,采用ICP-MS测定硒含量,未检出硒,表明加标的硒在过滤过程中没有损失,推测可能为加入的Se(Ⅳ)与血清样品中的蛋白结合所致。
2.4.2实际样品精密度 选取1个硒含量较高的正常血清样品,制备6个平行样品,测定硒形态的含量,并计算其RSD。实验结果表明,血清样品中各硒形态含量测定值的RSD值均小于5%,结果列于表5。
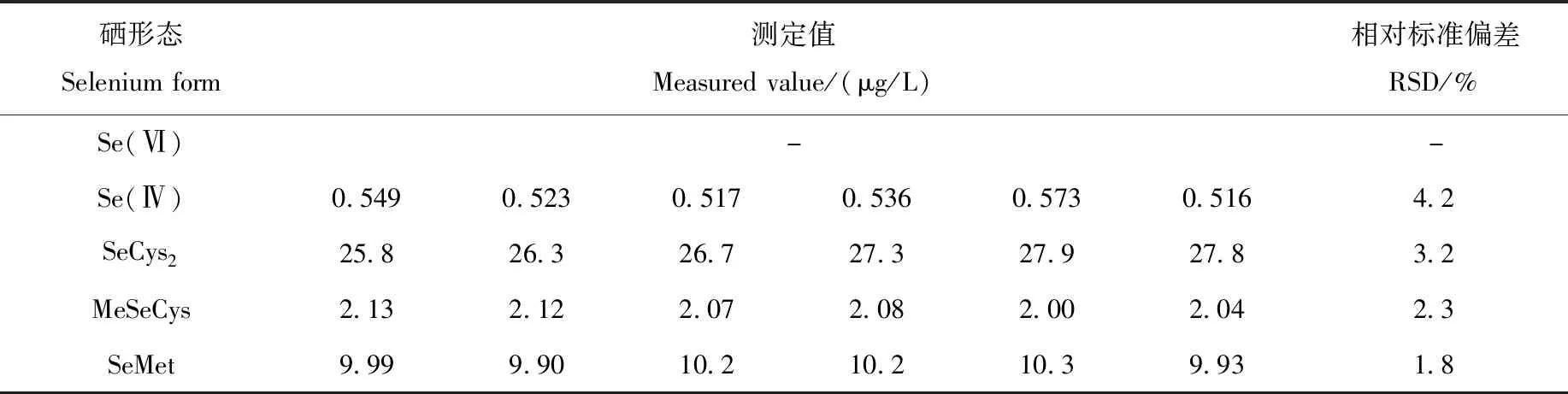
表5 血清样品精密度测定结果(n=6)Table 5 Precision measurement results of serum samples (n=6)
2.5 样品分析
采用本方法测定30例正常人的血清样品,结果表明,人血清中主要硒形态为SeCys2,其质量浓度范围在16.2~29.3 μg/L之间;其次为SeMet,其质量浓度范围在6.2~16.3 μg/L之间;另有少量的Se(Ⅵ)、Se(Ⅳ)、MeSeCys及未知硒化合物,色谱图示于图6。
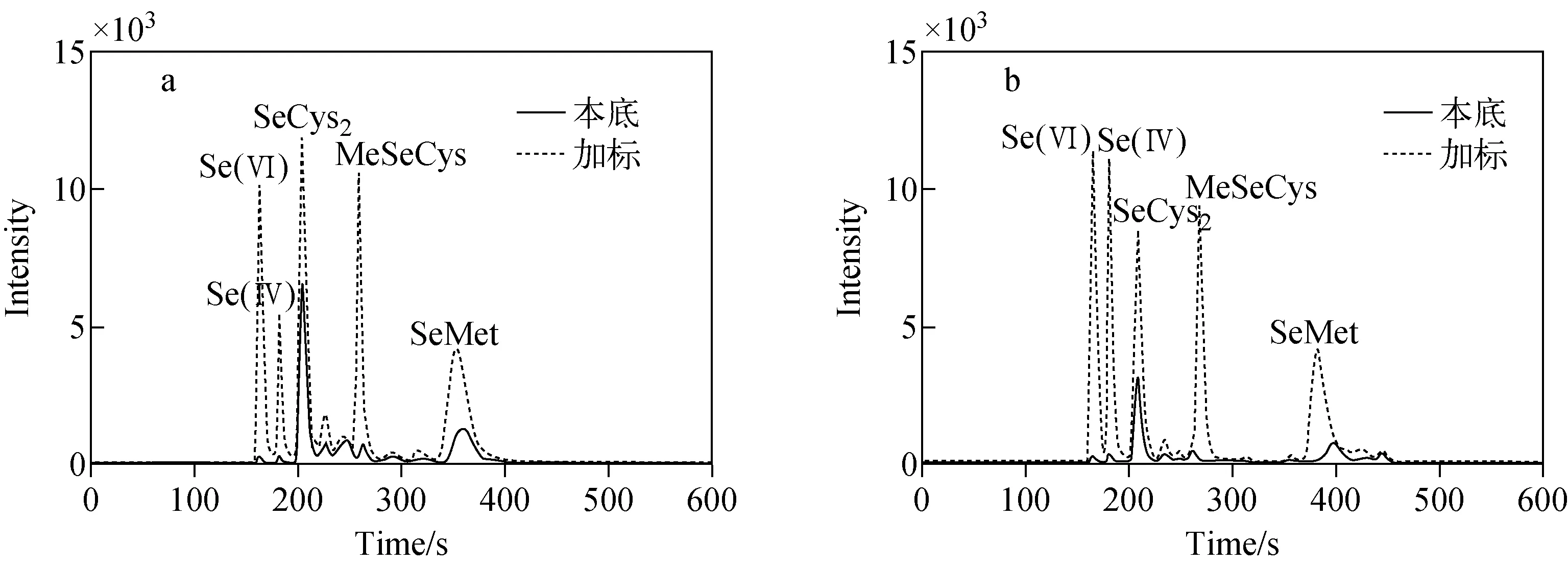
注:a.正常血清;b.去除大分子蛋白血清图5 血清硒形态色谱图Fig.5 Chromatograms of serum selenium speciation
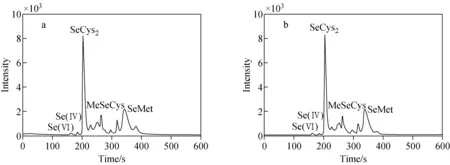
图6 血清1(a)和2(b)的色谱图Fig.6 Chromatograms of serum 1 (a) and 2 (b)
3 结论
本研究采用高效液相色谱-电感耦合等离子体质谱法分析人血清中的5种硒形态,比较了直接稀释法与超声水浴酶解法的提取效率,并优化了色谱分离条件。3个不同浓度水平的5种硒形态的加标回收实验表明,血清中Se(Ⅵ)、MeSeCys、SeMet的加标回收率均在88.3%~110.3%之间。Se(Ⅳ)在去除大分子蛋白后的人血清样品中的加标回收率为87.9%~88.7%,而在正常人血清样品中加标回收率较低,为35.1%~39.3%,推测可能是血清样品中含有的大分子蛋白与Se(Ⅳ)结合所致。2种血清样品中SeCys2的加标回收率在57.7%~72.5%之间,由于SeCys2稳定性较差,可能存在转化现象。以精密度考察方法的重复性,3个不同浓度水平的血清样品中硒形态的RSD均小于5%。通过测定正常人血清样品,发现人血清中硒形态主要以SeCys2为主,其次是SeMet,还存在少量的无机硒及其他未知硒化合物。

