miR-146b对脓毒症并发ARDS的预测及与预后的关系分析*
魏旭升,李小芳,黄 彪,王友华,陈先理
重庆市大足区人民医院重症医学科,重庆 402360
脓毒症大多因严重创伤、烧伤、外科大手术、感染等因素所致,每年患病率以1.5%~8.0%速度增长,病死率为30%~70%[1]。急性呼吸窘迫综合征(ARDS)是脓毒症的一种常见并发症,其发病机制比较复杂,受损部位主要为肺实质,急性发作表现包括双肺炎症、低氧血症,随着病情进展可引起多脏器功能衰竭[2]。研究表明脓毒症并发ARDS患者的病死率为50%~90%,预后非常差[3]。目前,我国现代医学取得了较大进展,针对该病治疗也提出了一些干预措施,虽然对控制病情有一定作用,但病死率仍居高不下[4]。因此,临床需寻求新的治疗靶点,为改善该病预后提供依据。近年来,有学者指出微小核糖核酸(microRNA,miR)在多种生物功能中均发挥了作用,与机体生理、病理改变有关,可能通过对脓毒症发病信号通路进行调控,参与该病进展[5]。动物实验发现,miR-146b参与了多脏器损伤过程,例如肺、肝、肾等,但作用机制不明[6]。而脓毒症并发ARDS可引起多脏器损伤,但现阶段临床尚未明确miR-146b与脓毒症并发ARDS之间的关系,基于此,本研究旨在分析miR-146b对脓毒症并发ARDS的预测价值及与预后的关系,为该病治疗寻求新靶点,现报道如下。
1 资料与方法
1.1一般资料 选取本院2016年9月至2020年9月收治的脓毒症患者272例作为脓毒症组,纳入同期于本院体检的健康志愿者92例作为对照组。根据脓毒症组是否发生ARDS分成ARDS组、非ARDS组。脓毒症根据脓毒症3.0标准[7]进行诊断:(1)明确诊断为感染或疑似感染,同时序贯器官功能衰竭(SOFA)评分≥2分;(2)快速序贯器官功能衰竭(qSOFA)评分包括收缩压低于100 mm Hg、呼吸频率高于22次/分、意识改变3项内容,满足其中2项。ARDS诊断标准[8]:(1)已明确临床发病,或有新发呼吸症状,或加重7 d内;(2)经CT或X线片提示双侧肺透光度减低,无法通过肿瘤、肺不张、肺结节、胸腔积液等原因解释;(3)呼吸衰竭无法通过体液超负荷、心力衰竭等原因解释,若无危险因素,则经超声心动图将高静水压性肺水肿排除;(4)氧合指数低于300 mm Hg。脓毒症组纳入标准:满足脓毒症3.0标准中关于该病的诊断标准;入院后立即行血清miR-146b检测;年龄≥18岁;入院前3个月内无免疫抑制剂、激素等治疗史。对照组纳入标准:同期体检的志愿者,身体健康状况良好;在体检当日接受血清miR-146b检测;年龄≥18岁。排除标准:诊断前有心肺复苏术、器官移植术史;合并肝硬化;患艾滋病、乙型肝炎等传染性疾病;病史不详;妊娠、哺乳期女性;既往有其他影响肺透光度的病史,如慢性阻塞性肺疾病。本研究经本院伦理委员会批准,所有研究对象或其家属自愿签署知情同意书。两组基线资料比较差异均无统计学意义(P>0.05),见表1。

表1 两组基线资料比较
1.2主要仪器与试剂 主要仪器:高速离心机(山东博科生物产业有限公司生产,TGL-16M)、微量移液器(赛默飞世尔科技公司生产,赛默飞F3系列)、离心管(赛默飞世尔科技公司生产,509-GRD-Q)、荧光定量聚合酶链反应检测仪(杭州博日科技有限公司生产,FQD-48A)。主要试剂:蒸馏水、异丙醇、无水乙醇均由江苏纳科科技有限公司提供;miRNA检测试剂、Trizol试剂、引物由赛默飞世尔科技公司提供。
1.3方法 两组受试者均采集3 mL空腹静脉血,3 000 r/min离心10 min,离心半径8 cm,分离血清,存至-70 ℃环境待检。利用实时反转录聚合酶链反应(qRT-PCR)检测血清miR-146b,具体操作如下。(1)提取总RNA:取出血清后常规复温,取400 μL血清放入无菌离心管(经RNA酶灭活),加入400 μL裂解液,混匀,在室温下反应5 min;在4 ℃环境下12 000 r/min离心10 min,取上清液于新离心管内;加入400 μL氯仿,混匀30 s,在室温下反应5 min;在4 ℃下12 000 r/min离心15 min,取无色水相于无菌离心管内,液体体积约600 μL;取无水乙醇200 μL加入,混匀,可见少量沉淀物,将沉淀物与液体移至吸附柱miRspin,室温下反应5 min,待吸附柱完全吸附混合液,在4 ℃环境下12 000 r/min离心30 s,弃吸附柱,留取流出液;取300 μL流出液备用,加无水乙醇200 μL,混匀,将混合液移至吸附柱内,室温下反应2 min,使吸附柱完全吸附溶液,4 ℃下12 000 r/min离心30 s,弃流出液,此时miRNA留置于吸附柱内。加入500 μL蛋白液,室温下反应2 min,在4 ℃下12 000 r/min离心30 s,取600 mL漂洗液加入,室温下反应2 min,在4 ℃下12 000 r/min离心30 s,弃流出液,重复上述操作,将miRNA以外的物质洗脱。将装有混合液的吸附柱置于新无菌离心管内,在4 ℃下12 000 r/min离心1 min,弃流出液;再次将吸附柱转入新无菌离心管内,加入30 μL RNase-Free ddH2O,室温下反应2 min,在4 ℃下12 000 r/min离心2 min,留取流出液,即获得总RNA,检测RNA浓度、纯度。(2)将RNA反转录为cDNA并进行PCR扩增。PCR反应条件:94 ℃预变性2 min,94 ℃变性20 s,60 ℃退火、延伸34 s,45个循环。引物序列:miR-146b上游引物序列为5′-ACACTCCAGCTGGGTGAGAACTGAATTCCA-3′,下游引物序列为5′-TGTCGTGGAGTCGGCAATTC-3′;内参引物U6上游引物序列为5′-CTCGCTTCGGCAGCACATATA CTA-3′,下游引物序列为5′-ACGAATTTGCGTGTCATCCTTGC-3′。经2-ΔΔCt计算血清miR-146b相对表达水平。
1.4观察指标 比较各组血清miR-146b水平;收集ARDS组、非ARDS组其他资料,包括性别、年龄,是否合并高血压、糖尿病,是否有吸烟史、饮酒史、泌尿系统感染、肺部感染、胰腺炎合并胰周感染、腹腔感染、感染性休克,以及SOFA评分[以均值(四舍五入)作为截断值,将患者分为<6分组和≥6分组]、氧合指数(200~300 mm Hg为轻度,100~<200 mm Hg为中度,<100 mm Hg为重度[8])、miR-146b(水平是否大于均值)的情况,分析脓毒症患者发生ARDS的危险因素。

2 结 果
2.1脓毒症组、对照组及ARDS组、非ARDS组血清miR-146b水平比较 脓毒症组血清miR-146b水平为0.90±0.35,低于对照组的1.62±0.53,差异有统计学意义(t=14.818,P<0.001)。在272例脓毒症患者中,有82例(30.15%)发生ARDS,190例(69.85%)未发生ARDS,分别纳入ARDS组、非ARDS组。ARDS组血清miR-146b水平为0.78±0.23,低于非ARDS组的0.95±0.30,差异有统计学意义(t=4.581,P<0.001)。
2.2脓毒症患者发生ARDS的单因素分析 单因素分析结果提示,ARDS组肺部感染、胰腺炎并胰周感染、SOFA评分≥6分、氧合指数<100 mm Hg、感染性休克、miR-146b<0.90的比例均高于非ARDS组(P<0.05),见表2。
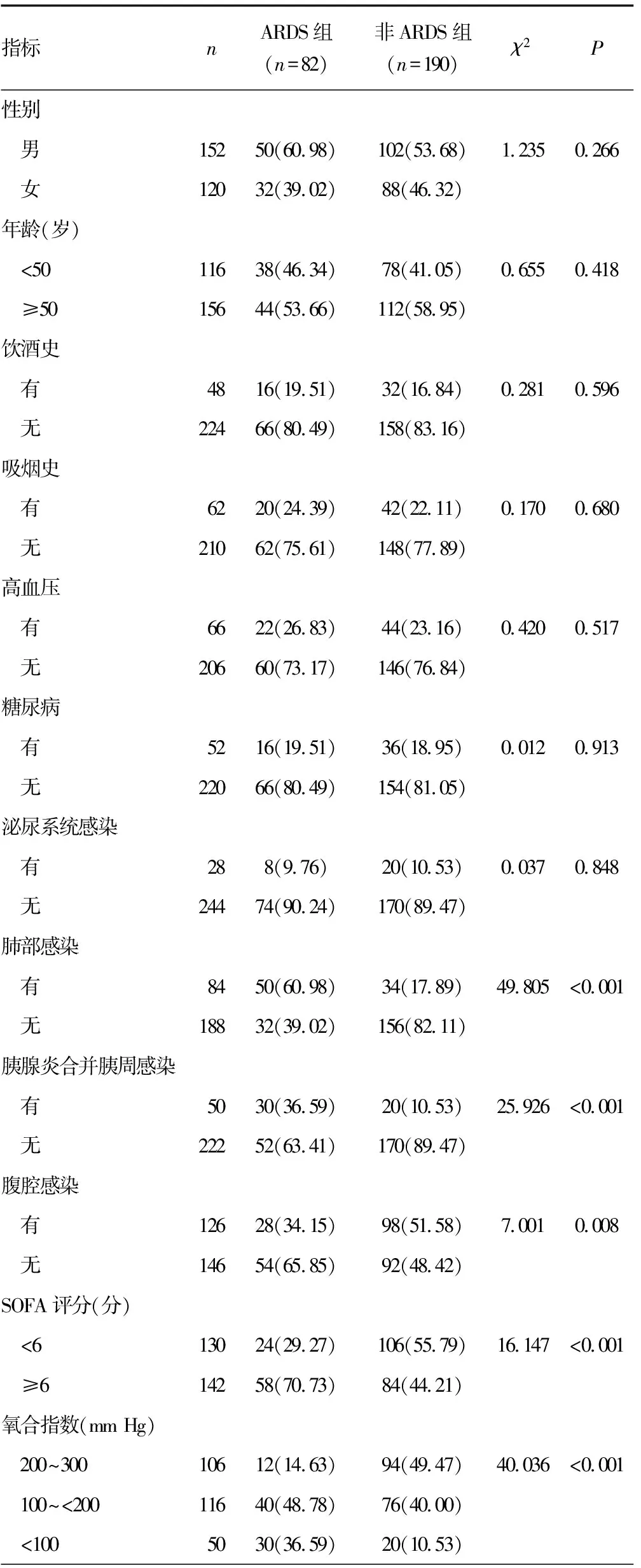
表2 脓毒症患者发生ARDS的单因素分析[ n(%)]

续表2 脓毒症患者发生ARDS的单因素分析[ n(%)]
2.3脓毒症患者发生ARDS的危险因素多元回归分析 经Logistic多元回归模型对相关变量行量化赋值,以表3中差异有统计学意义的变量为自变量X,以是否发生ARDS为因变量Y(否=0,是=1),结果提示肺部感染、胰腺炎合并胰周感染、SOFA评分≥6分、感染性休克是脓毒症患者发生ARDS的危险因素(P<0.05),而氧合指数为200~300 mm Hg、血清miR-146b水平≥0.90是脓毒症患者发生ARDS的保护因素(P<0.05),见表3。

表3 脓毒症患者发生ARDS的危险因素多元回归分析
2.4血清miR-146b对脓毒症并发ARDS风险的评估价值 血清miR-146b评估脓毒症并发ARDS风险的AUC为0.793(95%CI:0.733~0.853,P<0.001,标准误:0.030),最佳临界值为0.840,灵敏度为83.70%,特异度为70.00%。见图1。

图1 血清miR-146b评估脓毒症并发ARDS风险的ROC曲线
2.5血清miR-146b与脓毒症并发ARDS患者预后的关系分析 脓毒症并发ARDS患者血清miR-146b水平为0.78±0.23,以均值为界分成高水平组(miR-146b水平≥0.78,n=44)、低水平组(miR-146b水平<0.78,n=38)。高水平组2周内病死率为9.09%(4/44),生存率为90.91%(40/44)。低水平组2周内病死率为42.11%(16/38),生存率为57.89%(22/38)。2周内,miR-146b高水平组的生存率高于miR-146b低表达组,差异有统计学意义(Log-rankχ2=12.051,P=0.001),见图2。

图2 不同血清miR-146b表达患者的生存函数图
3 讨 论
脓毒症是比较常见的急危重症,治疗难度非常大,病死率高,ARDS是脓毒症的一种严重并发症,它可增加脓毒性患者感染性休克的发生率与病死率。ARDS的发病机制可能如下:(1)机体发生感染后,可导致中性粒细胞在肺部大量聚集,促进炎症介质释放,致肺损伤加重,一旦炎症、毒素侵害肺泡巨噬细胞,则会进一步释放氧自由基,加重炎症,从而诱发ARDS;(2)机体发生感染后,大量白细胞介素、肿瘤坏死因子等释放,对炎性反应有诱导作用,导致抗炎、促炎介质处于失衡状态,炎症细胞的激活过度能诱发全身炎性反应,参与ARDS的发生过程[9]。脓毒症所致的ARDS已成为重症监护病房(ICU)病死率增加的重要因素,既往大多给予机械通气、控制感染、维护脏器功能等干预,但病死率未得到良好控制,因此,临床需积极寻求新的治疗靶点,探索新的治疗思路。研究表明miR-146b在脏器功能损害过程中可能发挥了一定作用,其可能通过调节炎症相关的信号通路,参与脏器病变进展过程[10]。因此,本研究考虑分析miR-146b在脓毒症并发ARDS中的作用机制,更深入了解该病的潜在机制,以便改善预后。
本研究结果发现,脓毒症患者的血清miR-146b水平低于健康者,且ARDS患者的血清miR-146b水平低于非ARDS患者。有学者发现,在激活、上调人单核细胞后,miR-146b水平会迅速增高,且能靶向作用于肿瘤坏死因子受体相关因子6(TRAF6),负反馈调节炎症通路,具有抑炎作用[11]。脓毒症及ARDS的发生过程则均有炎症介质参与,例如彭婷婷等[12]指出脓毒症的发生及严重程度与炎症因子水平有关,王川江等[13]则认为ARDS患者可能存在失控性炎症。在本研究中,脓毒症及脓毒症并发ARDS患者的血清miR-146b水平相对较低,这可能是因为患者机体存在炎性反应所致,血清miR-146b水平下调提示抗炎作用削弱,导致病情进展。动物实验提示,miR-146b-3p上调能对磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶信号通路介导的炎症进行抑制,从而改善脓毒症小鼠的ARDS症状,这也表明miR-146b水平与脓毒症并发ARDS有关[14]。
本研究结果显示,脓毒症患者发生ARDS可能与肺部感染、胰腺炎并胰周感染、SOFA评分、感染性休克、氧合指数有关,这些均为常见因素,与既往研究[15]结果一致。此外,本研究证实脓毒症患者发生ARDS还与miR-146b水平有关,且血清miR-146b水平对ARDS的发生存在预测价值。miR-146b可能通过负性调节炎症通路参与ARDS的发生,其水平越高,则对机体炎症的抑制作用越好,而水平越低则会加重炎症,增加发生ARDS的风险。本研究证实血清miR-146b与脓毒症并发ARDS患者预后相关,其水平≥0.90的患者生存率更高。李林成等[16]发现,miR-146b转染之后能提升脓毒症小鼠的miR-146b水平,抑制炎症介质生成,使脏器受损程度减轻,表明miR-146b对脏器功能有保护作用,也更加论证了本研究结论的可靠性。在以后的脓毒症并发ARDS治疗中,miR-146b有望成为新的治疗靶点。
综上所述,miR-146b在脓毒症并发ARDS患者血清中的表达明显下降,其对脓毒症患者并发ARDS的风险及预后均有一定评估价值。本研究局限性为收集的影响ARDS发生的单因素较少,且脓毒症并发ARDS的病例数偏少,未来还需进一步完善临床资料的收集,并扩大样本量进行深入探讨。

