急性缺血性脑卒中患者入院时血清omentin-1水平与病情严重程度及预后的关系*
庄 月,黄红伟
江苏省人民医院溧阳分院/溧阳市人民医院神经内科,江苏溧阳 213399
缺血性脑卒中是我国发病率、致残率和致死率均较高的脑血管疾病,动脉粥样硬化形成是脑卒中发生的主要原因[1]。最近研究发现,多种脂肪活性细胞因子在脑卒中的发生和发展中发挥重要作用[2]。脂肪细胞因子与缺血性脑卒中的疾病诊断和神经功能预后有关[3-4]。omentin-1是一类重要的脂肪因子,在动脉粥样硬化和缺血性心脏病患者中的水平显著降低,并且在重度动脉粥样硬化患者中的水平比轻度动脉粥样硬化患者和非动脉粥样硬化患者明显降低,推测omentin-1可能是动脉粥样硬化的重要保护因素[5]。 omentin-1水平与颈动脉斑块的不稳定性呈负相关,可作为颈动脉粥样硬化性病变的独立预测因子[6]。血清omentin-1水平与缺血性脑卒中的严重程度直接相关,不同类型的脑卒中患者血清omentin-1水平可能存在较大差异,其中心源性脑卒中患者的血清omentin-1水平比其他类型脑卒中患者下降更明显[7]。然而,血清omentin-1水平易受心力衰竭、房颤等多种因素的影响,不能从心源性脑卒中患者血清omentin-1的水平变化直接推断出其与缺血性脑卒中的直接关系[8]。还有,大动脉粥样硬化患者与小动脉粥样硬化患者的血清omentin-1水平也可能存在较大差异,中重度颈动脉粥样硬化患者血清omentin-1水平明显降低[8],但是没有进一步探讨小动脉粥样硬化患者是否有不同程度的变化。本研究主要分析急性缺血性脑卒中患者入院时血清omentin-1水平与病情严重程度及预后的关系,旨在为疾病早期诊断和预后评估提供敏感的生化指标。
1 资料与方法
1.1一般资料 选择2016-2019年在本院初次确诊并住院的急性缺血性脑卒中患者共102例作为观察组,其中男58例、女44例,年龄48~73岁、平均(58.6±7.4)岁。纳入标准:(1)经颅脑CT或MRI确诊缺血性脑卒中,有明确的梗死病灶;(2)初次发病,既往无脑卒中病史,发病时间24~72 h;(3)根据指南推荐进行综合药物治疗和功能康复;(4)获得知情同意权,临床资料完整。排除标准:(1)其他脑源性疾病,如脑出血、脑肿瘤、脑动静脉畸形;(2)房颤、心源性卒中以及其他不明原因的脑卒中;(3)病情较重,预计生存期不足1个月;(4)严重肝肾功能障碍、营养代谢性疾病、自身免疫性疾病、严重感染;(5)妊娠或哺乳期女性;(6)近期服用药物,可能影响omentin-1检测。选择同期性别和年龄相匹配的在本院体检的50例体检健康者作为对照组,其中男28例、女22例,年龄45~76岁、平均(56.9±7.2)岁。两组性别、年龄差异均无统计学意义(P>0.05),具有可比性。本研究经过本院伦理委员会批准,所有研究对象知情同意。
1.2方法 急性缺血性脑卒中患者于入院时、体检者于体检时,采集外周肘静脉血10 mL于抗凝管中,室温下2 000×g离心15 min,取上清液于-80 ℃保存集中送检。采用上海酶联生物有限公司提供的试剂盒检测血清omentin-1水平,根据试剂盒说明进行操作。
从病历系统中收集急性缺血性脑卒中患者共患疾病(高血压、糖尿病、冠心病)、疾病分型[大动脉(LAA)/小动脉(SAA)]、入院时美国国立卫生研究院卒中量表(NIHSS)评分、CT检测梗死体积,以及生化指标如总胆固醇、低密度脂蛋白(LDL)、同型半胱氨酸(Hcy)、糖化血红蛋白(HbA1c)、平均血糖水平。
NIHSS评分用于评估入院时神经功能损害的严重程度,总分0~16分,分值越高表示神经损伤越严重[1]。采用磁共振弥散加权成像(DWI)序列定量计算梗死体积,手动勾画感兴趣区,将DWI异常区域相加并乘以截面厚度(mm)和交叉间隙(mm),将体积测量值的平均值作为梗死区域的体积,每例患者分别由两名经验丰富的影像科医师进行独立计算,结果取其平均值。
分析观察组入院时血清omentin-1水平与NIHSS评分的相关性;根据观察组治疗90 d后改良Rankin量表(mRS)评分[1]分为预后良好组(0~2分)和预后较差组(3~6分),比较两组临床资料和入院时血清omentin-1水平;观察组根据病变相关动脉分为LAA和SAA[2]亚组,分别比较两组预后良好与较差患者的入院时血清omentin-1水平;采用多因素Logistic回归分析筛选观察组治疗90 d预后[1]的主要影响因素;采用受试者工作特征(ROC)曲线分析入院时血清omentin-1水平预测治疗90 d预后的效能。
2 结 果
2.1各组血清omentin-1水平比较 观察组入院时血清omentin-1水平为(41.1±8.5)ng/mL,明显低于对照组的(78.8±12.9)ng/mL,差异有统计学意义(t=19.215,P<0.001)。见图1。观察组治疗90 d后预后良好组81例,预后较差组21例。预后良好组入院时血清omentin-1水平明显高于预后较差组(P<0.05);与预后较差组相比,预后良好组NIHSS评分降低,梗死体积缩小,差异均有统计学意义(P<0.05)。见表1。

图1 观察组与对照组血清omentin-1水平比较

表1 不同预后组间临床资料的比较
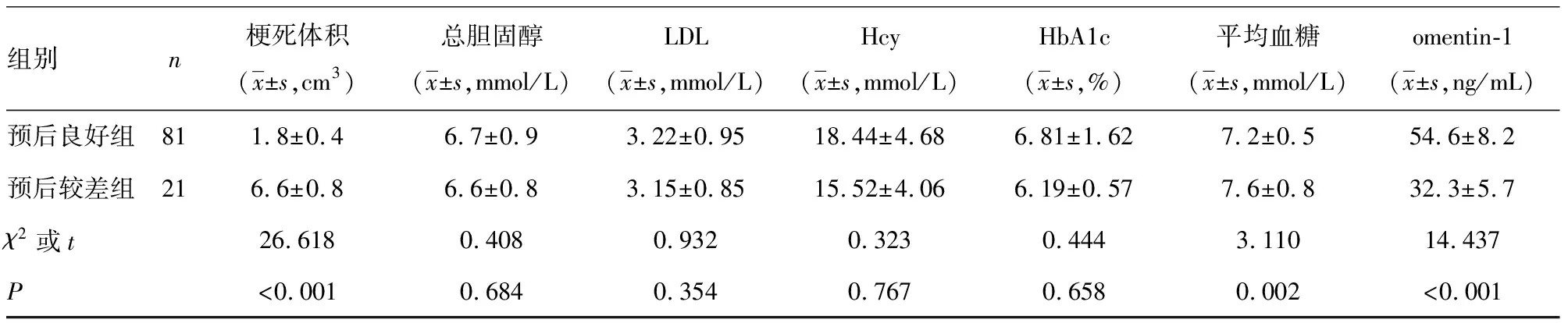
组别n梗死体积(x±s,cm3)总胆固醇(x±s,mmol/L)LDL(x±s,mmol/L)Hcy(x±s,mmol/L)HbA1c(x±s,%)平均血糖(x±s,mmol/L)omentin-1(x±s,ng/mL)预后良好组811.8±0.46.7±0.93.22±0.9518.44±4.686.81±1.627.2±0.554.6±8.2预后较差组216.6±0.86.6±0.83.15±0.8515.52±4.066.19±0.577.6±0.832.3±5.7χ2或t26.6180.4080.9320.3230.4443.11014.437P<0.0010.6840.3540.7670.6580.002<0.001
2.2观察组入院时血清omentin-1水平与NIHSS评分的相关性 Spearman相关分析显示,观察组入院时血清omentin-1水平与NIHSS评分呈负相关(r=-0.400,P<0.001)。见图2。
2.3LAA和SAA亚组不同预后患者入院时血清omentin-1水平的比较 LAA亚组预后良好(30例)患者入院时血清omentin-1水平为(50.8±7.6)ng/mL,明显高于预后较差(9例)患者的(27.6±3.6)ng/mL,差异有统计学意义(t=8.860,P<0.001)。SAA亚组预后良好(51例)患者的血清omentin-1水平为(56.8±7.9)ng/mL,明显高于预后较差(12例)患者的(35.8±4.3)ng/mL,差异有统计学意义(t=8.852,P<0.001)。见图3。
2.4影响急性缺血性脑卒中患者治疗 90 d预后的主要因素分析 Logistic回归分析显示,入院时血清omentin-1水平和NIHSS评分是影响急性缺血性脑卒中患者治疗90 d预后的主要因素(P<0.05)。见表2。
2.5omentin-1水平评估预后的效能 ROC曲线分析显示,入院时血清omentin-1水平预测急性缺血性脑卒中患者治疗90 d预后的AUC为0.867,95%CI:0.822~0.936,P<0.001,灵敏度为80.5%,特异度为73.6%,最佳临界值为40.2 ng/mL。见图4。

图2 观察组入院时血清omentin-1水平与NIHSS评分的相关性

图3 LAA和SAA亚组不同预后患者入院时血清omentin-1水平的比较
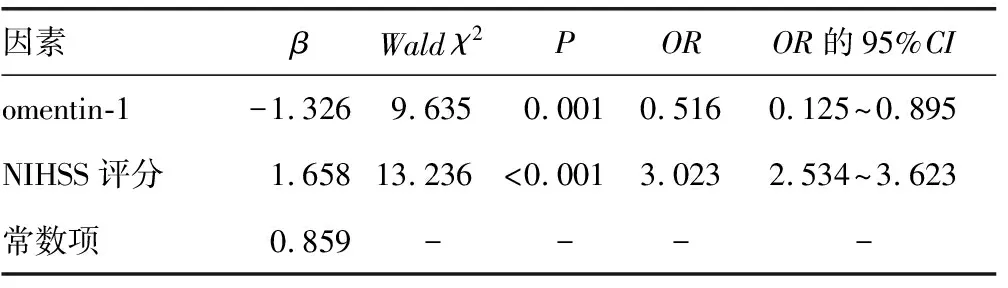
表2 影响急性缺血性脑卒中患者治疗90 d预后的主要因素分析

图4 急性缺血性脑卒中患者入院时血清omentin-1水平评估治疗90 d预后的ROC曲线
3 讨 论
脂肪组织不仅是重要的储能器官,也是机体最大的内分泌器官,脂肪组织分泌的细胞因子称为脂肪因子。脂肪因子可以作用于血管平滑肌细胞、血管内皮细胞和巨噬细胞,影响血管壁的弹性状态,参与动脉粥样硬化的形成和进展。XU等[9]通过前瞻性临床随访观察303例缺血性脑卒中患者发现,基线omentin-1水平从低到高的1年累积病死率分别为12.0%、3.7%和2.1%(P=0.006),提示omentin-1低水平的患者生存结局更差。omentin-1水平与动脉粥样硬化程度及颈动脉内膜中层厚度密切相关,推测其机制是通过抑制肿瘤坏死因子介导的内皮功能障碍而发挥相应的生理和病理作用[10-13]。omentin主要表达于内脏脂肪间质血管细胞,在肺、心脏等组织也有表达,有2个高度同源异构体,omentin-1是主要的循环亚型[14-15]。临床上多个因素可能影响omentin-1的表达,例如心脑血管疾病如房颤、心力衰竭可能直接影响omentin-1的表达;并且不同类型的脑卒中如LAA/SAA亚型也可能对omentin-1表达有不可估量的影响[16]。因此,本研究进一步分析急性缺血性脑卒中患者入院时血清omentin-1水平与病情严重程度和治疗90 d预后的关系。
本研究显示,观察组入院时血清omentin-1水平明显低于对照组(P<0.05),与既往研究结果一致[16]。但由于不同中心的入组对象和检测手段不同,血清omentin-1水平呈现一定差异性,这就需要更大样本数据计算出总体人群的参考范围以便于指导临床应用。本研究的优点是排除了基础心源性疾病尤其是房颤、心力衰竭等对血清omentin-1水平的影响,因此,结果可靠性更高。相关分析显示,观察组入院时血清omentin-1水平与NIHSS评分呈负相关。NIHSS评分是目前临床应用最广泛的评估发病初期神经损伤严重程度以及生存预后的定量工具,NIHSS评分越高提示神经功能损伤越严重,预后越差,同时患者血清omentin-1水平越低。但是,omentin-1水平降低是脑卒中发生的结果还是诱发因素,目前尚无统一定论,希望通过动物或者细胞实验揭示内在作用规律。
本研究显示,观察组治疗90 d后,预后良好组入院时血清omentin-1水平明显高于预后较差组(P<0.05);与预后较差组相比,预后良好组NIHSS评分降低,梗死体积减小,差异均有统计学意义(P<0.05)。提示入院时血清omentin-1高水平的患者短期预后较好。目前研究表明omentin-1可能通过以下机制发挥保护作用:可能直接或间接抑制炎性反应,减少不稳定斑块的形成和破裂,预防脑血管事件的发生[17];抑制血管平滑肌细胞的氧化应激反应,具有抗动脉粥样硬化作用,并抑制线粒体氧化应激,促进内皮释放生物活性物质,调节内皮功能,改善血管舒缩功能[18];还可以抑制碱性磷酸酶活性和骨钙素生成,从而抑制血管平滑肌细胞向成骨样细胞分化,阻止血管的形成和钙化[19];此外,还能促进缺血状态下的血管重塑,从而改善内皮功能,减少梗死体积和细胞凋亡[20]。对脑卒中靶血管来源进行亚组分析同样发现,无论是LAA亚组还是SAA亚组预后良好患者的入院时血清omentin-1水平均明显高于预后较差的患者(P<0.05),提示无论是LAA还是SAA来源的急性缺血性脑卒中患者入院时血清omentin-1低表达均预示较差的生存结局。
本研究Logistic回归分析结果显示,入院时血清omentin-1水平和NIHSS评分是影响急性缺血性脑卒中患者治疗90 d预后的主要因素(P<0.05)。ROC曲线分析显示,入院时血清omentin-1水平预测治疗90 d预后的AUC为0.867(P<0.05)。提示入院时血清omentin-1水平降低是急性缺血性脑卒中患者短期预后不良的主要危险因素,评估准确性较好。本研究不仅探讨了入院时血清omentin-1水平降低与急性缺血性脑卒中的发生和严重程度密切相关,而且与患者的生存结局也有一定的关系,为临床筛选预后不良的高危患者提供了新的参考依据。
综上所述,急性缺血性脑卒中患者入院时血清omentin-1水平降低与疾病发生、严重程度以及治疗90 d预后有紧密联系,可作为临床早期诊断急性缺血性脑卒中和判断患者短期预后的重要生化指标。该研究也有一定的局限性:首先单中心数据有一定的选择性偏倚,样本量有限,随访时间较短,未能动态检测血清omentin-1水平变化,无法判断最佳的监测时间点;此外,omentin-1仅仅是脂肪因子的一种,是否存在其他灵敏度和准确性更高的因子还有待进一步挖掘。

