外泌体miRNA应用于甲状腺乳头状癌诊断的研究*
周亚萍,李 翔,赵红梅,王 芳,张天一,李 娜,黄梦君,伏建峰
1.石河子大学医学院,新疆石河子 832000;2.新疆军区总医院临床检验诊断中心,新疆乌鲁木齐 830000;3.新疆生产建设兵团第十三师哈密红星医院检验科,新疆哈密 839000;4.新疆军区总医院普外科,新疆乌鲁木齐 830000;5.新疆医科大学研究生院,新疆乌鲁木齐 830000
根据WHO发布的2020年全球癌症数据,全世界女性人群中新发甲状腺癌达45万例[1]。国内相关数据显示,2020年我国甲状腺癌发病率高达8.49%,在女性人群新发肿瘤中位列第四,其中,乳头状癌占所有病理类型的85%[2]。目前,临床上应用最广、准确率最高的诊断甲状腺结节的方法是超声引导下细针穿刺细胞学检查(FNAC)。通过术前FNAC,仍有约20%的甲状腺结节性质无法确定,加上患者对于侵入性的有创检查方法接受度普遍较低。因此,传统的诊断方法有明显的限制,制约着甲状腺癌的临床诊断效能。有研究表明,外泌体miRNA可作为多种肿瘤早期诊断、治疗效果监测及预后分析的生物标志物,如乳腺癌、胃癌、膀胱癌等[3-5]。近期有文献报道,外泌体miRNA在甲状腺乳头状癌(PTC)患者血清、血浆中的表达水平可发生显著性变化,提示其可能是PTC诊疗过程中潜在的理想生物标志物[6-7]。基于以上认知和PTC的临床诊断现状,本研究依托高通量测序技术和生物信息分析平台,全面分析PTC患者血清外泌体miRNA图谱,以期获得有利于PTC诊断的外泌体miRNA生物标志物。
1 资料与方法
1.1一般资料 选取2021年1月1日至3月31日新疆军区总医院普外科收治的PTC患者6例(年龄29~40岁,中位年龄33岁)作为PTC组,选取体检健康者6例(年龄26~35岁,中位年龄29岁)作为对照组。入组的PTC患者均经过病理活检确认,并且在标本采集前均未进行手术治疗、放疗、化疗和药物治疗。对照组按照PTC组患者的性别、年龄1∶1匹配,均未患有其他甲状腺疾病及恶性肿瘤,甲状腺功能无明显异常。本研究通过新疆军区总医院伦理委员会审查,入组研究对象均签署知情同意书。
1.2仪器与试剂 超速离心机CP80WX购自日本Himac公司;低速离心机TDZ5-WS购自湖南湘仪有限公司;超低温冰箱Forma 900 series购自美国Thermo Fisher Scientific公司;透射电子显微镜G2 spititi购自美国FEI公司;纳米粒度电位仪Zetasizer Ultra购自英国Malvern公司;垂直电泳槽-1658004购自美国BIO-RAD公司;Agilent 2200 TapeStation系统购自美国Agilent公司;测序平台HiSeq 2500购自美国Illumina公司;普通碳支持膜BZ11022A购自北京中镜科仪技术有限公司;miRNA分离提取试剂盒R4163购自广州Magen生物公司;CD63抗体、TSG101抗体购自美国Affinity公司。
1.3方法
1.3.1标本处理 无添加剂的外周全血标本采集后10 min内移至4 ℃冰箱静置3~4 h;20 ℃ 2 000×g离心10 min,收集淡黄色上清液,然后4 ℃ 10 000×g离心10 min,尽可能清除细胞碎片,保证血清的质量。将血清按照500 μL每管分装至EP管,置于-80 ℃冰箱冻存。
1.3.2血清外泌体提取 按照金标准差速超高速离心法从血清中提取纯化外泌体囊泡:于超净工作台中取2 mL血清和10 mL PBS溶液至15 mL离心管,4 ℃ 300×g离心10 min,上层上清液转移至新的15 mL离心管;然后4 ℃2 000×g离心10 min,收集上清液于10 mL离心管,4 ℃ 12 000×g离心30 min,吸取上清液至新的10 mL离心管;4 ℃ 120 000×g离心70 min,收获下层透明沉淀,并用100 μL PBS溶液进行重悬,将收获的外泌体置于-80 ℃储存。
1.3.3血清外泌体鉴定
1.3.3.1透射电子显微镜法 将收获的血清外泌体取出后置于冰盒上,吸取15 μL外泌体于铜网上静置60 s,用滤纸吸干多余的液体,然后加入15 μL 2%醋酸双氧铀染色液,室温下染色1 min,再用滤纸反复吸去多余液体,将负染后的外泌体置于灯下烤10 min,最后通过电镜观察囊泡并拍照。
1.3.3.2外泌体粒径分析 将提取的血清外泌体稀释于1 mL PBS溶液中,将其缓慢注入样品池,通过纳米粒度电位仪对外泌体的纳米粒子进行跟踪分析,计算外泌体的颗粒浓度和尺寸分布曲线。
1.3.3.3蛋白印迹分析 通过添加苯甲基磺酰氟(PMSF)及蛋白酶抑制剂(Cocktail)的放射免疫沉淀分析(RIPA)方法提取总蛋白,之后行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,切除浓缩胶后将蛋白转移至NC膜。抗CD63、抗TSG101抗体和二抗用封闭液按比例稀释,NC膜与稀释抗体室温条件下孵育60 min;然后将超灵敏ECL发光液和稳定液按1∶1体积混合,滴加到NC膜上,最后在凝胶成像系统上曝光拍照。
1.3.4RNA提取 根据miRNA分离提取试剂盒的说明书从外泌体标本中提取总RNA,将收获的RNA样品分装至EP管,-80 ℃储存备用。
1.3.5文库制备和RNA测序 用8 μL的RNA样品建立RNA测序文库。向提取的RNA片段样品加入3′接头、反转录引物和5′接头,反转录生成互补单链cDNA,之后行PCR反应,以丰富目标基因片段;通过Qubit 荧光计定量仪和Agilent 2200 TapeStation系统,对RNA进行质量控制;质检合格的样品上机HiSeq测序仪,完成全基因组测序过程。
1.3.6生物信息学分析 通过DESeq2软件行生物信息分析,首先对上机得到的初始数据过滤筛选:去除读数两端的接头、片段长度<17 nt的读数等,以获取高质量的洁净数据;然后将洁净数据与参考基因组进行对比,进而获取全基因组读数分布图谱,对洁净数据进行ncRNA分类注释。以P<0.05且表达倍数|log2(FoldChange)|>1为差异表达显著界定标准,分析miRNA的特征并计算其具体的表达量[5-6]。最后预测差异显著miRNA的靶基因,并对目标基因行基因功能GO分析和KEGG分析。
1.4统计学处理 通过R语言软件包对血清标本中的差异表达外泌体miRNA进行特征分析和表达量计算,采用泊松分布、Fisher精确检验、似然比检验鉴定差异表达的miRNA。
2 结 果
2.1血清外泌体分离和鉴定 采用粒径分析仪、透射电子显微镜和蛋白印迹技术鉴定获得的血清外泌体,以确保所提取外泌体的质量:粒径分析结果显示,研究体系的粒子分散程度适宜,追踪结果可信,PTC组和对照组样品颗粒的峰面积占比分别为 97.9%、98.0%,粒径主峰分别为114.8 nm和112.0 nm,见图1;外泌体负染后经透射电镜观察,粒径20~200 nm外泌体显示典型双层膜结构,见图2;蛋白印迹试验进一步确证外泌体的生物标记物,PTC组和对照组血清外泌体均具有显著可检测的CD63和TSG101,见图3。

注:A为PTC组外泌体粒径分析;B为对照组外泌体粒径分析。

注:白色实线为200 nm刻度条。
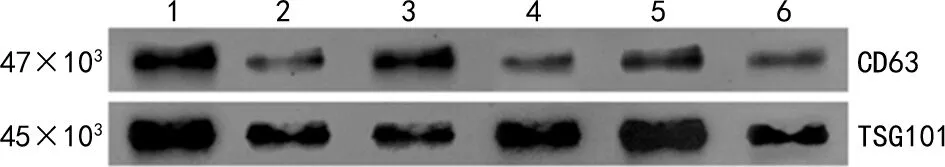
注:1~3为PTC组,4~6为对照组。
2.2RNA测序数据特征 结果显示,血清外泌体标本中共产生约8.88千万个原始测序读数,去掉原始数据中多余的接头序列、含有过多低质量碱基和污染部分,得到约7.99千万个洁净读数用于进一步分析。测序数据质量控制分析显示,Q20的平均值为97.01%,Q30的平均值为94.00%,GC百分比平均值为52.66%。进而将质控分析后的洁净读数与miRNA/rRNA/tRNA/snRNA/snoRNA权威数据库进行比对注释,结果表明miRNA约占20.02%,其他类型RNA约占79.98%。
2.3血清外泌体miRNA的表达特征 经RNA鉴定、测序数据特征分析,共获得795个miRNA,依托DEGSeq软件完善miRNA生物信息特征分析,并计算其标准表达量。结果显示,以对照组为参照,共有47个外泌体miRNA在PTC组血清的表达中呈现出明显差异(P<0.05),其差异表达倍数|log2(FoldChange)|>1且P<0.05,30个miRNA表达显著上调,17个miRNA表达显著下调。其中15个miRNA差异表达倍数|log2(FoldChange)|>2且P<0.05:miRNA-1289、miRNA-519b-5p、miRNA-519a-5p、miRNA-522-5p、miRNA-518e-5p、miRNA-519c-5p、miRNA-523-5p、miRNA-124-3p、miRNA-6729-5p、miRNA-487a-5p在PTC患者血清外泌体中表达显著上调;而miRNA-122-3p、miRNA-4669、miRNA-3680-3p、miRNA-455-3p、miRNA-3179在PTC患者血清外泌体中表达则显著下调,有可能是PTC诊断的生物标志物。
2.4差异miRNA的靶基因 采用TargetScan、miRDB、miRarBase、miRwalk 4款软件分析预测差异外泌体miRNA(|log2(FoldChange)|>1且P<0.05)的靶基因。结果显示,靶基因数目范围为20~1 643,中位数为415。进一步对差异显著的外泌体miRNA目标基因行KEGG分析,以期了解其具体的生物学作用。结果表明,所预测的目标基因被聚集于30条信号路径中,其中MAPK信号通路、Ras信号通路和PI3K/Akt 信号通路等多条通路与恶性肿瘤关系密切。
采用GO功能注释,为候选靶基因提供功能注释,以认识候选靶基因的潜在生物性能。结果显示,差异外泌体miRNA的靶基因富集于细胞形态和代谢调控、生物合成调控、蛋白信号转导等过程。依据靶基因预测结果,绘制了基因调控网络图,结果显示miRNA-511-5p、miRNA-543、miRNA-1290、miRNA-16-2-3p、miRNA-193b-5p、miRNA-625-3p、miRNA-455-5p、miRNA-654-3p、miRNA-4669的靶基因可以通过共同基因相互连接,靶基因富集的信号通路相互串联,以达到传递生物信号、调节生理生化过程等目的,也可能是PTC重要的致病机制。
3 讨 论
理想的肿瘤生物标记物应具有灵敏度高、特异性强、方便获取、创伤性小,患者接受度高等优点。根据《甲状腺癌诊疗规范(2018年版)》,癌胚抗原(CEA)、甲状腺球蛋白(Tg)诊断甲状腺癌时特异度较低,临床上一般用于甲状腺肿瘤切除术后的病情监测和甲状腺髓样癌的治疗效果评价[8]。目前,临床诊疗过程中尚无明确的能用于PTC诊断的特异性生物标记物。游离DNA用于多种疾病诊断是近年来体液活检研究的一个热点,其可准确评估非小细胞肺癌患者表皮生长因子受体(EGFR)的突变状态,但是该方法不适用于PTC,因为PTC患者的游离DNA突变率和检出率都极低[9]。此外,循环体液中的RNA分子性质不稳定,容易被核酸酶水解,限制了游离RNA分子作为肿瘤生物标记物的应用[10]。基于以上临床应用和研究现状,无创、有效、可控的生物标志物应用于甲状腺结节性质的诊断和鉴别诊断一直是临床检验诊断学关注的焦点。
高通量测序是目前常用的一种筛选方法,与基于聚合酶链反应的分析方法或基于杂交原理的检测方法相比具有明显的技术优势。首先,二代测序技术可以识别外泌体囊泡中低丰度的miRNA,进而提供一个更加完整的外泌体miRNA表达图谱。其次,高通量测序技术可以快速、高效、全方位地分析外泌体miRNA表达水平,加之其可以独立于目前已有的参考数据库,从而利于识别既往未发现的miRNA。
外泌体囊泡具有细胞类型特异性、稳定性、可获得性等特点[11]。囊泡独特的双层膜结构,对其运载物质发挥持续保护作用,其衍生的miRNA以高度稳定的形式在体液中循环,目前有研究分析了膀胱癌、胶质瘤、乳腺癌的外泌体miRNA表达谱,但PTC血清外泌体miRNA的文献报道较少。PAN等[6]通过二代测序,发现了一组以miRNA-5189-3p为代表的差异表达miRNA,可能是判断甲状腺结节性质的候选标志物。同时有研究表明,miRNA-21在PTC患者血浆外泌体中过度表达,有助于PTC和滤泡性甲状腺癌的鉴别[12]。此外,有学者证实,与正常甲状腺滤泡细胞相比,PTC细胞衍生的外泌体富含miRNA-146b和miRNA-222,可用于PTC的长期监测[13]。上述研究表明,PTC与外泌体miRNA的相关研究尚处于初期阶段,研究的层次、深度和力度有待进一步加深。因此,本研究基于外泌体内容物miRNA开展,以期获得新型PTC诊断生物标志物。
本研究结果表明,相对于对照组,PTC组的外泌体miRNA具有独特的表达特点,据此拓展研究的深度和层次,寻求可用于PTC诊断的分子标记。研究中筛选到的多个差异表达外泌体miRNA与文献研究结果一致,如miRNA-124-3p、miRNA-455-3p、miRNA-625-3p、let-7b-3p等。有学者通过miRNA芯片方法证实,血清中表达明显上调的miRNA-124-3p可能是PTC诊断的候选标志物[14]。体外细胞转染实验表明miRNA-625-3p通过增强星形胶质细胞基因1(AEG-1)表达,靶向激活下游的JNK信号路径,从而促进甲状腺癌的发生、增殖、迁移和侵袭[15]。本研究结果与既往研究取得了较好的一致性,对筛查有助于PTC诊断的外泌体miRNA奠定了一定的研究基础。
本研究还获得了一些新的PTC相关差异表达miRNA,如miRNA-1290、miRNA-323a-3p、miRNA-543等,虽然未见这些miRNA与PTC关系的相关文献,但是在其他疾病中时有报道。如外泌体miRNA-1290可介导NKD1促进胃癌细胞的增殖和侵袭[16]。miRNA-323a-3p可调节靶基因UHMK1表达促进结直肠癌进展[17]。因此,这些miRNA在PTC中的作用机制值得进一步探索。
肿瘤细胞源性的外泌体miRNA可以在细胞间穿梭,以达到信息交流和遗传物质交换的目的。外泌体携带运输的miRNA还可以运输至远处器官、组织,从而参与肿瘤的发展进程。因此,外泌体miRNA可根据其不同的靶基因发挥癌基因致癌或者抑癌作用。本研究结果显示,差异表达miRNA靶基因富集的多条信号途径与恶性肿瘤联系紧密,其中包括经典的MAPK信号路径,该信号通路通过一系列蛋白激酶将生物信号有效传递至细胞核,控制细胞生长周期、分化、炎症等基本生理生化过程,是甲状腺肿瘤发生的重要激活通路[18]。而差异miRNA靶基因富集的PI3K/Akt通路则可调节癌细胞的存活状态和增殖进程,在癌细胞发生黏附、迁徙、毛细血管生成等过程发挥至关重要的作用[19]。因此,外泌体miRNA涉及的多种信号通路之间存在相互连接作用,为PTC靶向精确治疗提供了新的方向。
受限于多方面因素的制约,本研究具有一定局限性。虽然在血清外泌体中发现了一组具有PTC诊断应用前景的miRNA,但是尚未在更大的队列分析中做进一步的研究。在下一步的工作中,本课题组将在更大的队列样本中对候选的差异miRNA进行PTC诊断效能评估。此外,外泌体miRNA的表达丰度是否受肿瘤大小、分期、淋巴结转移的影响,也将是随后研究的一个关注点。
综上所述,本研究检测、分析了PTC患者和健康对照者间的血清外泌体miRNA表达特征,经筛选获得了一组有利于PTC诊断的潜在血清生物标志物,可为新型PTC诊断生物标志物的获取提供参考和借鉴。
——外泌体与老年慢性疾病相关性的研究进展

