海南热带雨林土壤细菌组成与多样性分析
杜昊楠 兰国玉 吴志祥 陈伟 杨川









摘要:【目的】明确海南热带雨林土壤细菌的组成与多样性、时空分布规律及对土壤理化性质的响应和功能结构,为海南地区热带雨林的管理和保护提供理论依据。【方法】对海南五大热带雨林吊罗山、五指山、鹦哥岭、霸王岭和尖峰岭的土壤进行采样,每个样地采集13份样本,分旱、雨两季,共130份样本;通过高通量测序技術,分析土壤样本微生物中的细菌组成与多样性随空间位置和季节的变化,应用PICRUSt2功能预测分析土壤细菌功能。【结果】OTU分类统计显示,旱季的细菌OTU数目为10958,雨季的细菌OTU数目为11533,两个季节间差异不显著(P>0.05)。在细菌门水平,热带雨林旱季和雨季土壤细菌的优势菌群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia);两个季节间的拟杆菌门(Bacteroidetes)、放线菌门和蓝藻菌门(Cyanobacteria)丰度差异极显著性((P<0.01,下同)。在细菌纲水平,热带雨林旱季和雨季土壤细菌的优势菌纲为放线菌纲(Actinobacteria)、酸杆菌纲(Acidobacteria)、α-变形菌纲(Alphaproteobacteria)、浮霉菌纲(Planctomycetacia)和斯巴托菌纲(Spartobacteria);两个季节间的浮霉菌纲、鞘脂杆菌纲(Sphingobacteriia)、纤线杆菌纲(Ktedonobacteria)和放线菌纲丰度差异极显著。冗余分析(RDA)表明pH和全钾对土壤中细菌的贡献度较高,解释率分别为5.03%和4.28%。ANOSIM和Adonis分析显示不同季节细菌多样性差异不明显,不同地点细菌多样性差异明显。KEGG通路显示吊罗山样本中的细菌功能丰度较其他4个样点少。【结论】海南热带雨林土壤细菌在不同地理位置(取样点)的多样性差异明显,季节变换对土壤细菌的组成影响不明显,pH和全钾是土壤中细菌旱、雨季多样性的重要环境因子。
关键词: 土壤微生物;微生物多样性;时空分布;热带雨林;海南
中图分类号: S757 文献标志码: A 文章编号:2095-1191(2022)03-0840-10
Study on soil bacterial composition and diversity of tropical rainforest in Hainan Island
DU Hao-nan LAN Guo-yu WU Zhi-xiang CHEN Wei YANG Chuan
(1Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101,China; 2School of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 3Scientific
Observation and Experimental Station of Tropical Crops in Danzhou, Ministry of Agriculture and
Villages, Danzhou, Hainan 571737,China)
Abstract:【Objective】To clarify the soil bacterial composition, diversity, spatio-temporal distribution, response to soil physical and chemical properties and functional structures in tropical rainforests of Hainan Island, so as to provide a theoretical basis for the management and protection of the tropical rainforests in Hainan. 【Method】Soil samples were collected from Diaoluoshan, Wuzhishan, Yinggeling, Bawangling and Jianfengling tropical rainforest reserves in Hainan. Thirteen samples were collected from each reserve in both the dry and wet seasons, producing a total of 130 samples. The composition and diversity of bacteria in soil microorganisms were analyzed with a high-throughput sequencing technique and the function of soil bacteria was predicted and analyzed by PICRUSt2 software. 【Result】Operational taxonomic unit (OTU) classification statistics show that the number of bacterial OTU in the dry season is 10958 and that in rainy season this increases to 11533. There was no significant difference between the two seasons (P>0.05). At the level of bacteria phylum, the dominant flora of soil bacteria in tropical rain forest in dry season and rainy season were Proteobacteria, Acidobacteria, Actinobacteria, Planctomycetes and Verrucomicrobia. The abundance of Bacteroidetes, Actinobacteria and Cyanobacteria in two seasons showed significant differences(P<0.01,the same below). At the level of bacterial class, the dominant classes in the dry and rainy seasons were Actinomycetia, Acidobacteriia, Alphaproteobacteria,Planctomycetia and Spartobacteria. There were significant differences among the classes Planctomyceteria, Sphingobacteriia, Ktedonobacteria and Actinomycetia. Redundancy analysis (RDA) showed that pH and total potassium (TK) affected the soil bacterial composition substantially, with explanation rates of 5.03% and 4.28% respectively. ANOSIM and Adonis analysis showed that there was no significant difference in bacterial diversity in the different seasons, but significant difference in bacterial diversity in different places. KEGG pathway showed that the bacterial functional abundance in the Diaoluoshan samples was less than that from the other four reserves. 【Conclusion】The diversity of soil bacteria in Hainan tropical rainforests is significantly different in different geographical locations (sampling sites), whereas the seasonal change does not affect the composition of soil bacteria significantly. Soil pH and total potassium (TK) content have important effects on the soil bacterial diversity in the dry and rainy seasons.
Key words: soil microbial; microbial flora; space-time distribution; tropical rainforest; Hainan
Foundation items:National Natural Science Foundation of China (31770661); Special Project for the Construction of Modern Agricultural Industrial Technology System (CARS-33-ZP3); Hainan Provincial Key Research and Development Plan Social Development Direction Project (ZDYF2019145); Hainan Natural Science Foundation (High-level Talent Program) (320RC733)
0 引言
【研究意義】海南岛位于我国最南边,是我国第二大岛屿,属热带季风海洋性气候,是国际生物多样性研究的热点地区之一。研究海南热带雨林的大多数学者认为,海南热带雨林是我国面积最大、最典型的热带雨林(朱华和周虹霞,2002),岛内最丰富的植物资源也在热带雨林植物群落类型中(刘明航等,2018)。土壤微生物可改良土壤结构,提高土壤的保肥能力,对地表植物生长也有重要的促进作用(程文文等,2020)。土壤中微生物的总量和多样性不仅是土壤肥力的重要指标,也可为土壤类型、植被类型、土层深度、土地利用变化及林龄等研究提供参考(李君等,2016);土壤微生物地理学研究土壤微生物多样性、群落组成和功能属性在时空尺度下的分布格局,其研究有助于理解微生物多样性在地理层面上的维持机制和生态系统中的重要作用(褚海燕等,2020)。热带雨林土壤细菌群落的多样性在大尺度地理位置和不同季节是否发生显著变化,以及如何影响尚不清楚。因此,开展海南热带雨林土壤细菌组成与多样性研究,明确其土壤微生物的时空分布,可为橡胶林土地的管理、保护及后续的橡胶林根际微生物研究提供参考。【前人研究进展】在热带雨林的土壤微生物组成上,马萍等(1997)对西双版纳橡胶、胡椒和咖啡根际土壤的放线菌区系进行研究,发现链霉菌的分离频率最高,且分离频率旱季高于雨季;王春香等(2010)对西双版纳地区热带雨林土壤微生物研究发现,酸杆菌门在根系和自然土壤中分布广泛,在自然环境中有其特定的生态功能;Lan等(2017,2020a,2020b)对热带雨林土壤微生物群落进行了深入研究,结果表明担子菌门和子囊菌门是西双版纳热带土壤微生物(真菌)中数量最多的门,热带雨林转变为橡胶林后,土壤中细菌的多样性会增加,但微生物总生物量有所下降。在影响热带雨林土壤微生物的环境因子中,对于地上植被部分的研究,吴溪玭(2015)在南亚热带5种人工林林下植物与土壤微生物群落变化研究中发现,影响土壤微生物群落组成的主要因子有林分类型、林分公顷断面积、叶面积指数、平均叶倾角、透射系数。对于地下土壤的研究,杨帆(2016)在热带雨林转变为橡胶林对土壤微生物的影响研究中发现,微生物分布差异受土壤理化性质变化影响。时空分布对土壤微生物组成有显著影响。空间分布在大尺度上,Liu等(2013)研究证实土壤性质、气候条件、地貌和土地利用等促使土壤微生物多样性产生多重空间异质性;Xue等(2018)对亚热带河流微生物群落构成研究发现,微生物群落组成在中到大尺度数据分析时存在显著差异,随着地理距离的增加,微生物群落成分的相似性也有所下降。空间分布在小尺度上,王晓雯等(2016)通过对贵州地区葡萄园土壤微生物多样性研究发现,0~5 cm土层土壤的细菌群落结构与10~20 cm及20~40 cm土层土壤细菌群落结构具有明显差异。土壤微生物对时间的变化也具有明显的尺度效应,姚琦等(2017)研究发现,海南红树林生态系统中土壤微生物功能多样性随着时间尺度的变化而变化;谭雪莲等(2019)对东莞城市森林土壤的研究发现,土壤微生物的组成与多样性受季节变化的影响十分明显,湿季土壤微生物虽然数量低于干季但多样性和群落结构更丰富;杨泽良等(2020)对玉米根际土壤微生物的研究发现,微生物多样性从春到冬呈先增加后减小的变化趋势。【本研究切入点】目前对海南地区土壤微生物多样性的时空分布有部分研究,但多为对单一地区如儋州,单一树种如橡胶林和红树林的土壤微生物研究,方法也多为传统方法如稀释平板分析法,传统方法对微生物的培养困难,对微生物多样性的研究也难以全面。运用最新的高通量测序技术,研究海南大尺度空间分布和季节变化对热带雨林土壤细菌组成与多样性影响的研究鲜有报道。【拟解决的关键问题】通过高通量测序技术对海南热带雨林土壤细菌组成与多样性进行分析,探索季节变换和地理分布对土壤微生物的影响,明确关键的环境因子,并进行KEGG功能预测,为海南地区热带雨林土壤微生物和预测海南陆地生态系统微生物的群落演化等研究提供基本信息。
1 材料与方法
1. 1 取样方法
选取海南五大热带雨林五指山、霸王岭、尖峰岭、吊罗山和鹦哥岭样地,具有典型性和代表性。每个样地随机选取一个点作为第1个样本点采集土样,然后在该点北、东南、西南3个方向各采集距离第1个样本点0.1、1.0、10.0和 100.0 m左右4个点的土样,每个样点去除枯枝落叶层和表层5 cm的土壤,随机采集5~20 cm土壤层土样200 g,等量均匀混合为1个样本,得到13份样本,可用于生态位的研究,每份样本可看作独立样本。热带雨林地区每年5月底—10月底为雨季,11月—次年4月初为旱季,4月是旱季和雨季的交互时段。选择1月(旱季)和7月(雨季)作为采样时间,有下雨天取雨后72 h晴天土样,共5个样地,总样本130份。
1. 2 样本分析和数据处理
1. 2. 1 土壤理化性质测定 采用常规分析法(鲁如坤,2020)测定土壤的理化性质指标。土壤水分采用重量法测量;土壤pH采用酸度计电位法测定(在1∶2.5的土水比溶液中);有机质含量采用高温外热重铬酸钾氧化—容量法测定;硝态氮含量采用水蒸气蒸馏法测定;铵态氮含量采用靛酚蓝比色法测定;速效磷含量采用碳酸氢钠浸提—钼锑抗比色法测定;速效钾含量采用醋酸铵浸提—火焰光度计法测定;全氮含量采用纳氏比色法测定;全磷含量采用钼锑抗比色法测定;全钾含量采用火焰光度计法测定。每份样本各项指标重复测定3次。
1. 2. 2 高通量测序分析 土壤样本由上海美吉生物医药科技有限公司进行高通量测序。采用引物515FmodF(5'-GTGYCAGCMGCCGCGGTAA-3')和806RmodR(5'-GGACTACNVGGGTWTCTAAT-3')进行PCR扩增。对获得的原始序列进行优化,在97%序列相似性基础上将有效序列进行OTU聚类(全飞等,2020)。在OTU水平上计算土壤样本的覆盖度指数(Coverage)、序列分析得到的物种数(Sobs)、丰富度指数(Chao)和多样性指数(Simpson和Shannon-wiener),在门水平上进行细菌群落组成组间差异检验分析,在门和纲水平上进行细菌群落组成分析,在门水平上进行细菌群落与土壤养分分析。
1. 2. 3 统计和生物信息学分析 采用RDP classifier贝根斯算法对97%相似水平的OTU代表序列进行分类学分析,群落丰富度用Chao和Ace指数估计土壤细菌群落中OTU数目,群落均匀度用Shannon和Simpson指数等计算土壤微生物群落的多样性。运用R软件中的Vegan软件包对土壤微生物群落与环境因子进行冗余分析(RDA),同时应用主轴邻距法(Principal coordinates of neighbor matrices,PCNM)分解空间距离和环境等因素对土壤微生物群落构建变量的贡献率。不同地理位置对土壤微生物群落结构的影响采用Adonis分析(即置换多因素方差分析或非参数多因素方差分析),利用距离矩阵对总方差进行分解,分析不同分组因素对样本差异的解释度,并使用置换检验对划分的统计学意义进行显著性分析。应用PICRUSt2功能预测分析土壤细菌功能,利用KEGG数据库进行序列功能分析。
2 结果与分析
2. 1 旱季和雨季海南热带雨林土壤细菌群落各分类单元的物种丰富度特征
对5个样点130份土壤样本的细菌序列数据进行分析,结果(表1)共获得13294个OTU,其中雨季的细菌OTU数目比旱季多,但两个季节的OTU数目差异不显著(P>0.05,下同)。
2. 2 海南热带雨林不同季节土壤细菌群落结构
由图1-A可知,在细菌门水平上,热带雨林旱季和雨季土壤细菌的优势菌群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia)。其中,旱雨两季拟杆菌门(Bacteroidetes)、放线菌门和蓝藻菌门(Cyanobacteria)的丰度差异极显著(P<0.01,下同),浮霉菌门和装甲菌门(Armatimonadetes)的丰度差异显著(P<0.05,下同);浮霉菌门、拟杆菌门和蓝藻菌门旱季丰度大于雨季,放线菌门和装甲菌门雨季丰度大于旱季。
由图1-B可知,在细菌纲水平上,优势菌纲为放线菌纲(Actinobacteria)、酸杆菌纲(Acidobacteria)、α-变形菌纲(Alphaproteobacteria)、浮霉菌纲(Planctomycetacia)和斯巴托菌纲(Spartobacteria)。其中,旱雨两季放线菌纲、浮霉菌纲、鞘脂杆菌纲(Sphingobacteriia)和纤线杆菌纲(Ktedonobacteria)丰度差异极显著,γ-变形菌纲(Gammaproteobacteria)和梭状芽孢杆菌纲(Clostridia)丰度差异显著。浮霉菌纲、纤线杆菌纲和鞘脂杆菌纲旱季丰度大于雨季,放线菌纲、γ-变形菌纲和梭状芽孢杆菌纲雨季丰度大于旱季。
2. 3 海南热带雨林土壤微生物α多样性评估结果
由图2可知,海南热带雨林土壤微生物Shannon指数和Ace指数旱雨季间无显著差异。由图3可知,在不同地区,土壤微生物Shannon指数除霸王岭与尖峰岭间无显著差异,ACE指数除吊罗山与霸王岭、尖峰岭与五指山、鹦哥岭与霸王岭间无显著差异外,其余地区间差异显著。
2. 4 热带雨林不同取样位置的土壤细菌群落结构相似性分析结果
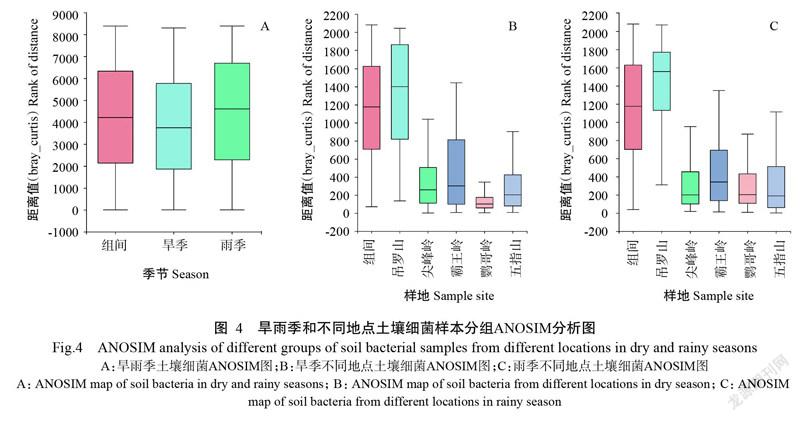
对旱雨两季和不同地点的土壤微生物进行样本分组比较分析。由图4-A可知,土壤细菌旱雨季组间距离与组内距离无明显差异;旱雨季分组对土壤细菌的群落结构影响不明显,土壤细菌旱雨季组成相似。由图4-B和图4-C可知,细菌在同一季节不同地点的组内距离明显大于组间距离,即不同地点对土壤细菌组成的影响较大。
2. 5 热带雨林土壤微生物多样性的影响因素分析结果
对热带雨林土壤中的细菌进行RDA分析,研究土壤理化指标与样本、微生物群落间的关系。将测得的海南热带雨林样地土壤理化指标(表2)作为环境因子与样本群落进行关联分析,结果(图5)显示,pH和全钾(TK)对土壤中细菌的贡献度较高。旱、雨季样地土壤细菌RDA解释度见表3。
由图6可知,在细菌门水平上,酸杆菌门与pH、全钾和温度呈极显著负相关,与全磷和降雨量呈极显著正相关;放线菌门与pH呈极显著负相关,与全氮、硝态氮和速效钾呈极显著正相关,与铵态氮呈显著正相关;拟杆菌门与有机质、速效磷、降雨量、土壤水、硝態氮和全氮呈极显著负相关,与pH和全钾呈极显著正相关;绿弯菌门(Chloroflexi)与土壤水、硝态氮、有机质和全氮呈极显著负相关,与pH和全钾呈极显著正相关;厚壁菌门(Firmicutes)与土壤水、有机质和全磷呈极显著负相关,与全钾呈极显著正相关;芽单胞菌门(Gemmatimonadetes)与有机质呈显著负相关,与铵态氮和速效钾呈极显著负相关,与硝态氮呈显著正相关,与速效磷呈极显著正相关;硝化螺旋菌门(Nitrospirae)与土壤水和全氮呈显著负相关,与pH、全钾和温度呈极显著正相关,与降雨量和硝态氮呈极显著负相关;浮霉菌门与有机质和硝态氮呈显著负相关,与速效磷呈极显著负相关;疣微菌门(Verrucomicrobia)与硝态氮呈显著负相关,与速效磷呈极显著负相关,与速效钾呈极显著正相关。
2. 6 热带雨林细菌功能预测结果
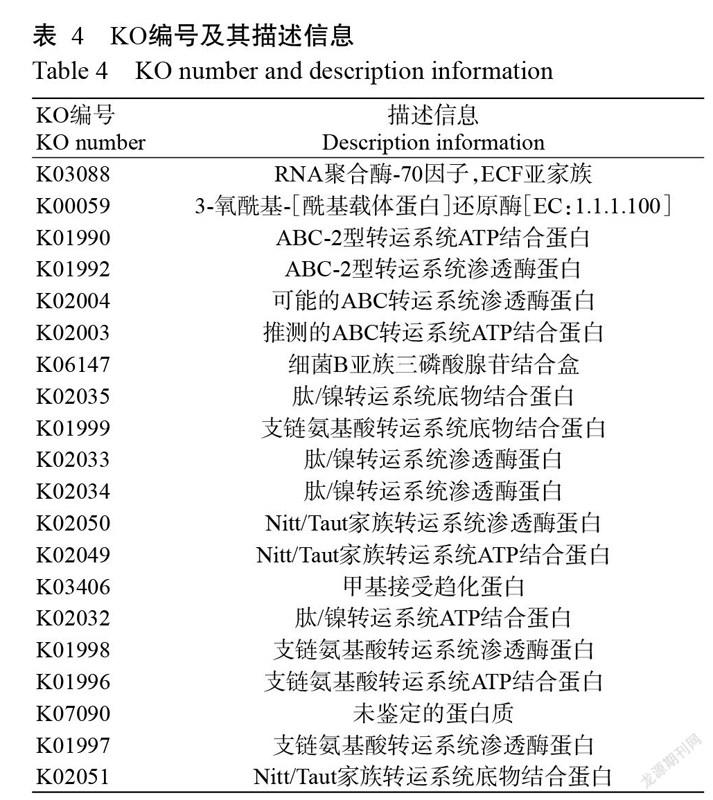
KEGG通路包括各种代谢通路、合成通路、膜转运、信号传递、细胞周期以及疾病相关通路等,还可揭示各种化学分子、酶及酶促反应等相关信息。通过对不同季节、不同样地热带雨林土壤细菌群落KEGG KO进行丰度组成分析,筛选总丰度前20的KO,发现在细菌基因富集的功能中,有大量序列与RNA聚合酶σ-70因子、ECF亚家族(K03088)、3-氧酰基-[酰基载体蛋白]还原酶[EC:1.1.1.100](K00059)、ABC-2型转运系统ATP结合蛋白(K01990)、ABC-2型转运系统通透酶蛋白(K01992)及可能的ABC转运系统通透酶蛋白(K02004)相关(图7和表4),说明海南地区热带雨林土壤细菌主要有促进物质扩散作用、水解ATP释放能量推动分子的膜转运、多不饱和脂肪酸等脂肪酸的生物合成等功能。
与物种组成相比,所有土壤细菌样本的KEGG功能组成较相似。无论是旱季、雨季还是不同地理位置,均未发现较大变化,其中吊罗山样本中的细菌功能丰度较其他4个样点少。
3 讨论
3. 1 季节和地理位置变化对土壤中细菌的影响
热带雨林的土壤细菌在组成上,变形菌门和酸杆菌门是相对丰度最高的细菌门类,与Lan等(2020a,2020b)的研究结果一致。酸杆菌門是土壤中的重要微生物,占土壤类群的比例为5%~46%,其主要的作用是利用多种复杂的碳底物,促进土壤中的物质循环和能量流动(王春香等,2010)。在细菌丰度前5的菌门中,放线菌门和浮霉菌门在旱季和雨季具有显著或极显著差异。本研究结果显示,放线菌门的丰度雨季大于旱季,其与土壤pH呈极显著负相关,海南不同地区的土壤pH旱季普遍高于雨季,是放线菌门丰度旱季小于雨季的原因之一;浮霉菌门则相反,其丰度旱季大于雨季,浮霉菌门与速效磷呈极显著负相关,海南不同地区的土壤速效磷旱季普遍低于雨季,是浮霉菌门丰度旱季大于雨季的原因之一。
本研究结果显示,水分在旱、雨季环境RDA分析中的解释率为1.13%,说明水分对于旱季和雨季的细菌多样性差异影响不明显,推测原因,一是在雨季时较多的水分使土壤中的含氧量下降,供氧不足降低了土壤细菌分解有机物的速度(Stres et al.,2008),二是旱季时土壤中较少的水分减少了土壤中可溶性基质的扩散,降低了微生物的移动性和活性(Schjønning et al.,2003)。Lan等(2018)研究表明,土壤微生物群落对季节变化非常敏感,橡胶林土壤细菌群落结构和多样性随季节变化很大。本研究结果与前人结果存在差异,推测是因为Lan等(2018)在研究中加入了旱雨交替期的微生物,旱雨交替期的土壤水分较适宜,有利于土壤细菌的生长,导致细菌结构在季节交替时更为敏感,旱雨交替季土壤样品的多样性最高,与旱雨两季有明显的差异。同时,本研究也发现,细菌在不同的地理位置(取样点)微生物的多样性差异明显,可能是因为不同地理位置的土壤理化性质不同所致。有研究表明,在小尺度下,土壤的微生物群落结构受土壤理化性质的影响较大,不同地点的土壤理化性质不同,不同环境因子在土壤微生物的组成与群落结构中起到协作或拮抗作用,而最终土壤微生物的组成受到环境因子的整体影响,从而表现出土壤微生物多样性对不同地理位置的响应(李永恒等,2020)。
3. 2 不同土壤理化性质对土壤中微生物的影响
土壤的理化性质对土壤微生物的组成与多样性存在显著影响。对土壤细菌群落最明显的环境影响因素之一是土壤基质本身的化学和物理性质(Fierer and Jackson,2006;黄萍等,2020)。土壤因素已被证实对区域和大陆尺度的微生物群落组成有较大影响(Lauber et al.,2008)。本研究发现,pH和全钾对土壤中细菌的贡献度较高,分别为5.03%和4.28%。pH和全钾与土壤细菌丰度前10的较多菌门呈正相关,土壤pH与绿弯菌门、硝化螺旋菌门和拟杆菌门均呈极显著正相关,土壤全钾与酸杆菌门、厚壁菌门、硝化螺旋菌门和拟杆菌门呈极显著正相关。Lan等(2020a)研究表明,土壤pH是影响区域范围内土壤微生物多样性的最重要因素之一,本研究结果与前人研究结论一致。原因是土壤的pH可改变土壤中的微环境,对土壤微生物的组成具有刺激作用(姚斌等,2011;彭玉娇等,2021),同时,pH可改变细胞的膜结构稳定性、膜通透性及吸收营养的能力,使细胞膜和细胞中大分子的电荷发生改变(陈燕飞,2009)。有研究表明,土壤中微生物分泌的有机酸可活化土壤中的无效钾,促进土壤中矿物钾的溶解(张亮,2013),而钾是植物必须营养元素,增加土壤中的营养成分,健康生长的植物的根际对土壤细菌有促进作用,可改变植物根际的微生态环境和土壤结构,影响植物生长状况,也对其根际细菌的群落结构产生重要影响,同时也为一些根际微生物提供营养(刘殿锋,2011)。
4 结论
海南热带雨林的土壤细菌中变形菌门和酸杆菌门是相对丰度最高的细菌类群,在丰度前5的细菌门类中,季节变换对放线菌门和浮霉菌门具有显著或极显著影响。在海南热带雨林不同的地理位置(取样点),土壤微生物的多样性差异明显。土壤pH和全钾对海南热带雨林土壤中细菌的贡献度较高。通过海南地区热带保护区科学的森林管理可对土壤中微生物的组成与多样性产生较大影响,促进雨林的养分与物质转化,为雨林植物的生长提供更好的条件。
参考文献:
陈燕飞. 2009. pH对微生物的影响[J]. 太原师范学院学报(自然科学版),8(3):121-124. [Chen Y F. 2009. pH to uygur biology influence[J]. Journal of Taiyuan Normal University (Natural Science Edition),8(3):121-124.] doi:10.3969/j.issn.1672-2027.2009.03.032.
程文文,罗珠珠,牛伊宁,蔡霞. 2020. 黄土高原雨养区苜蓿地土壤微生物功能多样性研究[J]. 河南农业科学,49(11):61-70. [Cheng W W,Luo Z Z,Niu Y N,Cai X. 2020. Microbes functional diversity of alfalfa soil in the rainfed loess plateau[J]. Journal of Henan Agricultural Sciences,49(11):61-70.] doi:10.15933/j.cnki.1004-3268. 2020.11.008.
褚海燕,冯毛毛,柳旭,时玉,杨腾,高贵锋. 2020. 土壤微生物生物地理学:国内进展与国际前沿[J]. 土壤学报,57(3):515-529. [Chu H Y,Feng M M,Liu X,Shi Y,Yang T,Gao G F. 2020. Soil microbial biogeography:Recent advances in China and research frontiers in the world[J]. Acta Pedologica Sinica,57(3):515-529.] doi:10.11766/trxb202001090010.
黃萍,王楠,周紫羽,王婷,袁志良,常介田,叶永忠. 2020. 白云山落叶阔叶林土壤细菌群落结构及环境因子的相关性分析[J]. 河南农业大学学报,54(3):415-421. [Huang P,Wang N,Zhou Z Y,Wang T,Yuan Z L,Chang J T,Ye Y Z. 2020. Soil bacterial community structure and correlation analysis of environmental factors in deciduous broad-leaved forest of Baiyun Mountain[J]. Journal of Henan Agricultural University,54(3):415-421.] doi:10. 16445/j.cnki.1000-2340.2020.03.005.
李君,兰国玉,李玉武. 2016. 海南儋州橡胶林与热带次生林土壤微生物区系研究[J]. 热带作物学报,37(3):433-438. [Li J,Lan G Y,Li Y W. 2016. Comparison on soil micro flora in rubber forest and tropical secondary forest in Danzhou,Hainan Island[J]. Chinese Journal of Tropical Crops,37(3):433-438.] doi:10.3969/j.issn.1000-2561.2016.03.001.
李永恒,李乾玺,吴君君,程晓莉. 2020. 秦岭落叶阔叶林不同空间尺度下土壤微生物特征[J]. 植物科学学报,38(3):335-346. [Li Y H,Li Q X,Wu J J,Cheng X L. 2020. Soil microbial attributes at different spatial scales in deciduous broad-leaved forest in Qinling Mountains[J]. Plant Science Journal,38(3):335-346.] doi:10.11913/PSJ.2095-0837.2020.335.
刘殿锋. 2011. 含钾岩石生物转化中的微生物多样性与作用机制研究[D]. 南京:南京师范大学. [Liu D F. 2011. Microbial diversities during bioconversion of potassium-bearing rocks and its mechanisms[D]. Nanjing:Nanjing Normal University.]
刘明航,李盼畔,陈萍,文彬. 2018. 西双版纳热带雨林的土壤种子库与雨林保护[J]. 中国野生植物资源,37(5):56-60. [Liu M H,Li P P,Chen P,Wen B. 2018. Xishuangbanna tropical rainforest soil seed bank and rainforest conservation[J]. Chinese Wild Plant Resources,37(5):56-60.] doi:10.3969/j.issn.1006-9690.2018.05.012.
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社. [Lu R K. 2000. Analytical methods of soil agrochemistry[M]. Beijing:China Agricultural Science and Technology Press.]
马萍,张玲琪,魏蓉城,王正显,江东福. 1997. 西双版纳橡胶、胡椒和咖啡根际土壤放线菌区系研究[J]. 云南大学学报(自然科学版),19(4):393-396. [Ma P ,Zhang L Q,Wei R C,Wang Z X,Jiang D F. 1997. Studies on the rhizosphere actinomycete microflora of rubber tree,pepper,coffee in Xishuang Banna[J]. Journal of Yunnan University(Natural Sciences Edition),19 (4):393-396.]
彭玉娇,崔学宇,邵元元,杨艳丽,杜潇,贾书刚,刘书田,区燕丽. 2021. 不同树龄沙田柚果园土壤肥力、叶片养分和土壤细菌群落的特征[J]. 江苏农业学报,37(2):348-354. [Peng Y J,Cui X Y,Shao Y Y,Yang Y L,Du X,Jia S G,Liu S T,Ou Y L. 2021. Characteristic of soil fertility,leaf mineral nutrients and bacterial community in Shatian pomelo orchards of different tree ages[J]. Jiangsu Journal of Agricultural Sciences,37(2):348-354.] doi:10.3969/j.issn.1000-4440.2021.02.010.
全飛,兰国玉,李玉武,李君. 2020. 橡胶树林长期喷施硫磺对土壤细菌多样性的影响[J]. 西北林学院学报,35(2):131-136. [Quan F,Lan G Y,Li Y W,Li J. 2020. Effects of long-term sulfur spraying on soil bacterial diversity in rubber plantations[J]. Journal of Northwest Forestry University,35(2):131-136.] doi:10.3969/j.issn.1001-7461. 2020.02.19.
谭雪莲,阚蕾,张璐,郑嘉仪. 2019. 城市森林土壤微生物群落结构的季节变化[J]. 生态学杂志,38(11):3306-3312. [Tan X L,Kan L,Zhang L,Zheng J Y. 2019. Seasonal dynamics of soil microbial community structure in urban forest[J]. Chinese Journal of Ecology,38(11):3306-3312.] doi:10.13292/j.1000-4890.201911.017.
王春香,田宝玉,吕睿瑞,林伟铃,徐燕,黄钦耿,黄建忠. 2010. 西双版纳地区热带雨林土壤酸杆菌(Acidobacteria)群体结构和多样性分析[J]. 微生物学通报,37(1):24-29. [Wang C X,Tian B Y,Lü R R,Lin W L,Xu Y,Huang Q G,Huang J Z. 2010. Distribution and diversity of Acidobacteria in tropical rain forest soil of Xishuangbanna[J]. Microbiology China,37(1):24-29.] doi:10. 13344/j.microbiol.china.2010.01.024.
王晓雯,洪振瀚,刘安瑞,罗立新. 2016. 基于荧光定量PCR和高通量测序技术的葡萄园土壤细菌群落结构多样性分析[J]. 酿酒科技,(11):28-33. [Wang X W,Hong Z H,Liu A R,Luo L X. 2016. Analysis of bacterial community structure in vineyard soil by RT-PCR and high throughput sequencing[J]. Liquor-Making Science & Technology ,(11):28-33.] doi:10.13746/j.njkj.2016279.
吴溪玭. 2015. 南亚热带五种人工林林下植物与土壤微生物群落变化及其环境解释[D]. 南宁:广西大学. [Wu X P. 2015. Variation analysis and environmental interpretation of the understory and soil microbial communities of five different plantations in Southern Subtropical Area of China[D]. Nanning:Guangxi University.]
杨帆. 2016. 热带雨林转变为橡胶林对土壤微生物的影响研究[D]. 昆明:云南师范大学. [Yang F. 2016. Research on microorganism changes under the transformation from tropical rain forests to rubber plantations[D]. Kunming:Yunnan Normal University.]
杨泽良,李萍芳,薛涛,向书琴,向国红. 2020. 玉米根际土壤微生物群落结构及多样性季节变化特征[J]. 西南农业学报,33(5):1001-1010. [Yang Z L,Li P F,Xue T,Xiang S Q,Xiang G H. 2020. Seasonal variation characteristics of soil microbial community structure and diversity of corn in rhizosphere soil[J]. Southwest China Journal of Agricultural Sciences,33(5):1001-1010.] doi:10. 16213/j.cnki. Scjas.2020.5.016.
姚斌,韋秀文,刘惠文,周玲莉,尚鹤. 2011. 树木修复过程中微生物对酸化剂的响应[J]. 环境科学与技术,34(12):105-109. [Yao B,Wei X W,Liu H W,Zhou L L,Shang H. 2011. Effects of soil pH regulators on soil microbial biomass in atrazine-contaminated soil by dendroremediation of poplar[J]. Environmental Science & Technologry,34(12):105-109.] doi:10.3969/j.issn.1003-6504.2011. 12.022.
姚琦,尤青,李媛宏,张起畅,殷浩能,吴红萍,王锐萍. 2017. 海南东寨港红树林土壤微生物功能多样性[J]. 应用与环境生物学报,23(5):857-861. [Yao Q,You Q,Li Y H,Zhang Q C,Yin H N,Wu H P,Wang R P. 2017. Functional diversity of soil microorganisms in the soil in Dongzhaigang mangrove wetlands in Hainan[J]. Chinese Journal of Applied & Environmental Biology,23(5):857-861.] doi:10.3724/SP.J.1145.2016.11001.
张亮. 2013. 微生物对土壤磷钾的活化作用[D]. 重庆:西南大学. [Zhang L. 2013. Mobilization of phosphorus and potassium from soils by microorganisms[D]. Chongqing:Southwest University.]
朱华,周虹霞. 2002. 西双版纳热带雨林与海南热带雨林的比较研究[J]. 云南植物研究,24(1):1-13. [Zhu H,Zhou H X. 2002. A comparative study on the tropical rain forests in Xishuangbanna and Hainan[J]. Acta Botanica Yunnanica,24(1):1-13.] doi:10.3969/j.issn.2095-0845.2002.01. 001.
Fierer N,Jackson R B. 2006. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of Ame-rica,103(3):626-621. doi:10.1073/pnas.0507535103.
Lan G Y,Li Y W,Lesueur D,Wu Z X,Xie G S. 2018. Seasonal changes impact soil bacterial communities in a rubber plantation on Hainan Island,China[J]. Science of the Total Environment,626(1):862-834. doi:10.1016/j.scitotenv.2018.01.147.
Lan G Y,Li Y W,Wu Z X,Xie G S. 2017. Impact of tropical forest conversion on soil bacterial diversity in tropical region of China[J]. European Journal of Soil Biology,83:91-97. doi:10.1016/j.ejsobi.2017.10.007.
Lan G Y,Wu Z X,Li Y W,Chen B Q. 2020a. The drivers of soil bacterial communities in rubber plantation at local and geographic scales[J]. Archives of Agronomy and Soil Science,66(3):358-369. doi:10.1080/03650340.2019.16 16286.
Lan G Y,Wu Z X,Yang C,Sun R,Chen B Q,Zhang X. 2020b. Tropical rainforest conversion into rubber plantations results in changes in soil fungal composition,but underling mechanisms of community assembly remain unchanged[J]. Geoderma,375:114505. doi:10.1016/j.geoderma.2020.114505.
Lauber C L,Strickland M S,Bradford M A,Fierer N. 2008. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biolgy Biochemistry,40(9):2407-2415. doi:10.1016/j.soilbio.2008.05.021.
Liu L M,Yang J,Yu X Q,Chen G J,Yu Z. 2013. Patterns in the composition of microbial communities from a subtropical river:Effects of environmental,spatial and temporal factors[J]. PLoS One,8(11):e81232. doi:10.1371/journal.pone.0081232.
Schjønning P,Thomsen I K,Moldrup P,Christensen B T. 2003. Linking soil microbial activity to water-and air-phase contents and diffusivities[J]. Soil Science Society of America Journal,67:156-165. doi:10.2136/sssaj2003.1560.
Stres B,Danevcic T,Pal L,Fuka M M,Resman L,Leskovec S,Hacin J,Stopar D,Mahne I,Mulec M I. 2008. Influence of temperature and soil water content on bacterial,archaeal and denitrifying microbial communities in drained fen grass-land soil microcosms[J]. FEMS Microbiology Ecology,66(1):110-122. doi:10.1111/j.1574-6941.2008.00555.x.
Xue P P,Carrillo Y,Pino V,Minasny B,McBratney A B. 2018. Soil properties drive microbial community structure in a large scale transect in South Eastern Australia[J]. Scientific Reports,8(1):11725. doi:10.1038/s41598-018-30005-8.
(責任编辑 麻小燕)

