长日照条件下2个热带玉米自交系的转录组差异分析
高媛 王小利 涂亮 刘鹏飞 郭向阳 王安贵 祝云芳 吴迅 陈泽辉

摘要:【目的】深度挖掘不同光敏類型自交系间的差异表达基因,为揭示热带玉米种质光周期敏感性变异机理提供理论依据,同时为采用分子辅助方法改良热带玉米种质提供新途径。【方法】以热带光钝感自交系QR273和光敏感自交系T32为试验材料,通过人工控制长日照条件(16 h光/8 h暗)对试验材料进行处理,于四叶期采集幼嫩叶片提取总RNA,利用RNA-Seq技术对不同光敏类型自交系材料进行转录组测序,同时结合生物信息学分析,筛选出不同光敏类型自交系间的差异表达基因。【结果】在长日照条件下,从玉米自交系T32和QR273间共鉴定出6977个差异表达基因,其中T32较QR273的上调表达基因有3291个、下调表达基因有3686个。GO功能注释分析结果显示,有24个应答光刺激和应答辐射的基因在T32和QR273中表现出显著差异;此外,有17个同时与应答光刺激、应答辐射、胚后期发育、光周期、生殖结构发育、生殖系统发育、生殖发育过程、光周期/开花和分生组织营养生长向生殖生长转变相关的差异表达基因。KEGG信号通路富集分析发现有15个昼夜节律通路相关基因在T32和QR273中表现出显著差异,其中,Zm00001e030377和Zm00001e023792基因在T32中的表达量高于QR273,而Zm00001e016746和Zm00001e011193基因在T32中的表达量低于QR273。【结论】长日照条件下光敏型与光钝型热带玉米自交系间的转录组差异分析共鉴定出6977个显著差异表达基因,包括24个参与应答光刺激和应答辐射的差异表达基因有,17个同时与应答光刺激、应答辐射、胚后期发育、光周期及分生组织营养生长向生殖生长转变相关的差异表达基因,以及15个与昼夜节律通路相关的差异表达基因。这些基因通过差异性参与昼夜节律通路中的成花诱导,导致成花启动途径不完全相同,可能是热带种质光周期敏感性变异的关键遗传基因。
关键词: 热带玉米自交系;光周期;差异表达基因;长日照条件;转录组测序
中图分类号: S513.01 文献标志码: A 文章编号:2095-1191(2022)03-0654-11
Analysis of transcriptome differences between two tropical maize inbred lines planted under long sunshine
GAO Yuan WANG Xiao-li TU Liang LIU Peng-fei GUO Xiang-yang WANG An-gui ZHU Yun-fang WU Xun CHEN Ze-hui
(1Agricultural College, Guizhou University, Guiyang, Guizhou 550025, China; 2Institute of Upland Crops, Guizhou Academy of Agricultural Sciences, Guiyang, Guizhou 550006, China; 3Pratacultural Institute, Guizhou Academy of
Agricultural Sciences, Guiyang, Guizhou 550006, China)
Abstract:【Objective】The differentially expressed genes (DEGs) among different photosensitive inbred lines were explored, so as to provide a theoretical basis for revealing the variation mechanism of photoperiod sensitivity of tropical maize germplasm and a new way of improving tropical maize germplasm by molecular assisted method. 【Method】Tropical germplasm light-insensitive inbred lines of QR273 and light-sensitive inbred line of T32 were used as test materials, which were planted under artificial control conditions of long-days (LD) treatment (16 h light/8 h dark). In the four leaf stage, young leaves were gathered, and their total RNA was extracted. The transcriptome sequencing of different photosensitive inbred lines was carried out by RNA-Seq technology. At the same time, combined with bioinformatics analysis, the DEGs among different photosensitive inbred lines were screened. 【Result】Under LD conditions, a total of 6977 genes showed differentially expression between lines of T32 and QR273, of which 3291 genes showed up-regulated expression in T32 and 3686 genes showed down-regulated expression in T32. GO functional annotation analysis showed that 24 genes responding to light stimulation and radiation showed significant differences in T32 and QR273 and that there were 17 DEGs related to response to light stimulation and radiation, post embryonic development, photoperiod, reproductive structure development, reproductive system development, reproductive development process, photoperiod or flowering and meristem vegetative to reproductive growth. Enrichment analysis of KEGG signaling pathway showed genes related to circadian rhythm pathway had significant differences in expression between T32 and QR273. The expression of Zm00001e030377 and Zm00001e023792 genes in T32 was higher than that in QR273, while the expression of Zm00001e016746 and Zm00001e011193 genes in T32 was lower than that in QR273. 【Conclusion】A total of 6977 DEGs are identified by transcriptome difference analysis between photo-sensitive and light-insensitive tropical maize inbred lines under long sunshine conditions, of which 24 DEGs involved in response to light stimulation and radiation, and 17 DEGs related to response to light stimulation, radiation, post embryonic development, photoperiod and the transformation from vegetative growth to reproductive growth of meristem, and 15 DEGs related to circadian rhythm pathway. These genes may be the genetic factors leading to the significant differences in photoperiod sensitivity variation among tropical maize germplasms.CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
Key words: tropical maize inbred lines; photoperiod; differentially expressed genes; long sunshine conditions; transcriptome sequencing
Foundation items: National Natural Science Foundation of China (32171981); Guizhou Province Science and Technology Department (QKHJC〔2020〕1Z09); Guizhou Province High-level Innovative Talent Cultivation Object Project (〔2018〕5629); Science and Technology Innovation Project of Guizhou Academy of Agricultural Sciences (〔2022〕03)
0 引言
【研究意义】玉米作为重要的粮食作物之一,在保障国家粮食安全方面具有重要意义(燕照玲等,2017;曹丹等,2021)。我国的玉米种植分为东华北、西北、黄淮海及南方玉米生态区等,但不同生态区域因光温差异,所需要的玉米种质也各不相同(刘世梦倪和宋敏,2021)。在我国黄淮海以北地区,主要以塘四平头、旅大紅骨、兰卡斯特、改良瑞德等温带玉米种质为主(黎裕和王天宇,2010);在南方玉米生态区,由于病虫害较严重,因此对具有较高抗性的Suwan、墨白、CIMMMYT、ETO、巴西等热带玉米种质的需求较大。热带玉米种质具有籽粒品质优、抗性强、遗传多样性丰富等优势(刘颖等,2020;周海宇等,2020),在现代玉米育种中的应用越来越多。Suwan作为典型的热带玉米种质,以其选育自交系如S37和T32等所组配的杂交种在西南地区已得到大面积推广应用(郭向阳等,2016);但热带玉米种质存在光周期敏感性强的缺陷,严重影响其在长日照条件下正常开花结实,从而限制在不同生态区的推广应用(贾小平等,2020;史勇等,2021)。因此,探究长日照条件下热带玉米种质光周期变异的遗传差异,鉴定出具有热带背景且光反应钝感和敏感基因,对于深度揭示热带玉米种质光周期敏感性变异的遗传机制具有重要意义。【前人研究进展】雄花分化作为植物正常开花的重要因素,是影响光周期敏感的主要因子,其分化时期可分为成花诱导、成花启动和花器官发育等3个阶段(刘莉和祝朋芳,2004),其中成花诱导是植物开花的必要步骤,备受植物学研究者的关注。任永哲等(2006)通过比较不同日照条件下玉米的生长差异,发现在长日照条件下玉米四叶期的总叶片数显著多于短日照条件;吴连成(2008)以热带玉米自交系CML288和温带玉米自交系黄早四为材料,评价不同日照条件下玉米的光周期敏感时期,结果发现短日照条件下热带玉米自交系CML288的光周期敏感时期在第4~7叶期,而长日照条件下CML288的光周期敏感时期在第4~14叶期;周海宇等(2020)研究表明,理想日照时长是促进植物正常花芽分化的重要环境因子。此外,有学者利用温热玉米种质的光周期反应差异来研究成花启动的分子调控机制。研究表明,长日照条件下,编码生物钟组分的核心振荡器基因ZmELF4与ZmTOC1共同正向调节开花促进基因ZmCCA1/ZmLHY,且ZmELF4和ZmTOC1基因在夜间呈现表达高峰后(Alabadí et al.,2001;张少方,2011;Gendron et al.,2012)即促进下游生物钟输出基因如ZmGI的表达,致使ZmGI基因在午间出现表达高峰(唐维等,2014;Lee and An,2015),同时转录激活ZmCOL/ZmHd1基因,使其在黄昏时达到峰值(Miller et al.,2008;杨爽,2010),从而促进植物开花。吴连成(2008)研究发现,8个光周期敏感基因均表现昼夜表达节律,其中ZmTFL1基因为开花抑制基因,能抑制玉米的成花诱导;Meng等(2011)利用温热玉米自交系对ZCN8基因的研究表明,ZCN8基因是唯一具有成花活性的基因,而开花抑制基因ZmCCT、ZmCCT9和ZmCCT10能负反馈调节ZCN8基因表达,进而抑制植物开花;Jin等(2018)以温带玉米自交系B73为材料对ZmCOL3基因的研究表明,ZmCOL3是玉米开花抑制因子,在不同光照条件下过量表达ZmCOL3基因可延迟开花约4 h,该基因的表达能反式激活ZmCCT基因的转录或干扰昼夜节律,从而抑制植物开花。可见,不同光敏感基因均表现出昼夜表达及互相调控的规律,其研究结果为深度揭示玉米光周期敏感性变异提供了科学依据。【本研究切入点】目前,Suwan玉米种质在现代玉米育种中的重要性日趋凸显,但对其光周期敏感性变异的遗传研究较少。【拟解决的关键问题】以热带玉米Suwan种质选育的骨干玉米自交系T32(光敏感)和QR273(光钝感)为材料,基于RNA-Seq技术对长光照条件下的玉米材料进行转录组测序,深度挖掘不同光敏类型自交系间的差异表达基因,为揭示热带玉米种质光周期敏感性变异机理提供理论依据,同时为采用分子辅助方法改良热带玉米种质提供新途径。
1 材料与方法
1. 1 试验材料
供试材料T32和QR273均选自热带玉米种质Suwan 1号群体,由贵州省农业科学院旱粮研究所提供。T32表现出强光敏感特性(光敏指数:株高46.35%,穗位高50.67%),QR273表现出光钝感特性(光敏指数:株高3.82%,穗位高22.22%)。AxyPrep总RNA小量制备试剂盒(AXYGEN)购自贵州春满谷生物科技有限公司,GoScriptTM Reverse Transcription System (Promega)和GoTaq? qPCR Master Mix (Promega)试剂盒购自贵州明涵生物科技有限公司。主要仪器设备:移液器(德国Eppendorf公司),高速冷冻离心机(美国Beckman公司),NanoDrop One型超微量紫外分光光度计(美国Thermo公司),反转录仪(美国BIO-RAD公司),CFX96 Real-time PCR Detection System(美国BIO-RAD公司),DW-HL540型超低温冷冻储存箱(中科美菱科技股份有限公司),JN-GH-01型人工智能气候室(江南宁波仪器厂)。CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
1. 2 试验方法
2020年7月将T32和QR273种植于贵州省农业科学院草业研究所人工气候室(温度25 ℃,湿度40%~50%,光照强度4800~6000 lx),长光照条件为16 h光照/8 h黑暗处理。玉米四叶期时,取3片幼嫩叶片等量混合,3个重复,液氮速冻。将叶片样品分成2份,分别用于转录组分析(委托武汉爱基百客公司完成)和实时荧光定量PCR验证。总RNA提取参照AxyPrep总RNA小量制备试剂盒(AXYGEN)说明进行操作,然后根据GoScriptTM Reverse Transcription System (Promega)试剂盒说明反转录合成cDNA。
1. 3 实时荧光定量PCR验证
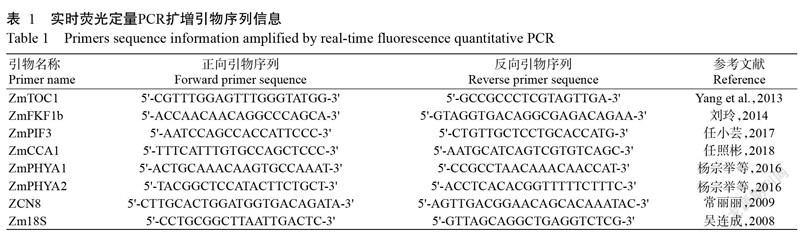
基于转录组测序分析结果,挑选7个候选基因进行实时荧光定量PCR验证。反转录合成的cDNA经5倍稀释后作为模板,以玉米管家基因Zm18S为内参基因,设3次重复。按照GoTaq? qPCR Master Mix试剂盒说明进行实时荧光定量PCR扩增,反应体系20.0 μL:正、反向引物(表1)各0.3 μL,cDNA模板2.0 μL,ddH2O 7.4 μL,SYBR Mix 10.0 μL。扩增程序:96 ℃预变性6 min;96 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行45个循环;72 ℃读取荧光值。采用2-ΔCt法换算目的基因相对表达量(王亚丽等,2021),并以Excel 2016进行统计分析及制图。
2 结果与分析
2. 1 转录组测序质量分析結果
6份玉米叶片样品转录组测序获得的Clean reads介于47024638~56965124条,Clean bases均在6.90 Gb以上,Q30均高于93.00%,GC含量介于57.94%~60.61%(表2)。各样品中比对到玉米参考基因组的Clean reads占总Clean reads的87.06%~88.47%,在玉米参考基因组中呈唯一比对的Clean reads占总Clean reads的83.38%~84.33%,而在玉米参考基因组中获得完美匹配的Clean reads占总Clean reads的77.87%~78.68%,表明转录组测序数据质量较高,可用于后续研究。
2. 2 差异表达基因筛选结果
长日照条件下,在T32和QR273间共筛选获得6977个差异表达基因(图1),其中,T32较QR273的上调表达基因有3291个,下调表达基因有3686个。
2. 3 差异表达基因GO功能注释分析结果
GO功能注释分析结果(图2)显示,在T32与QR273间的6977个差异表达基因分别注释到生物学过程(Biological process)、细胞组分(Cellular component)及分子功能(Molecular function)三大功能分类,其中,生物学过程主要涉及细胞过程(Cellular process)、代谢过程(Metabolic process)及应答刺激(Response to stimulus)等,细胞组分主要涉及细胞(Cell)、细胞部分(Cell part)及细胞器(Organelle)等,分子功能主要涉及催化活性(Catalytic activity)、粘合物(Binding)、运输活性(Transporter activity)及转录调节活性(Transcription regulator activity)等。以光周期相关差异表达基因所参与且排名前20的生物学过程进行富集分析,结果(图3)显示,在T32与QR273间,参与应答光刺激和应答辐射的差异表达基因最多,为24个;参与胚胎后发育的差异表达基因有22个;参与生殖结构发育、生殖系统发育及生殖发育过程的差异基因有20个;参与营养生长向生殖生长转变的差异基因有15个。经Peak关联基因分析,结果(图4)显示,有17个同时与应答光刺激、应答辐射、胚后期发育、光周期、生殖结构发育、生殖系统发育、生殖发育过程、光周期/开花和分生组织营养生长向生殖生长转变相关的差异表达基因;有6个与昼夜节律相关的差异表达基因;有2个同时与应答光刺激、应答辐射、胚后期发育、光周期、生殖结构发育、生殖系统发育、生殖发育过程、光周期/开花、分生组织营养生长向生殖生长转变和昼夜节律相关的差异表达基因;有2个同时与应答光刺激、应答辐射和昼夜节律相关的差异表达基因;有2个同时与应答光刺激、应答辐射和胚后期发育相关的差异表达基因;有1个同时与应答光刺激、应答辐射、胚后期发育、光周期、生殖结构发育、生殖系统发育和生殖发育过程相关的差异表达基因。
2. 4 差异表达基因KEGG信号通路富集分析结果
KEGG信号通路富集分析结果(图5)显示,在T32与QR273间的6977个差异表达基因分别富集到层次结构(Brite hierarchies)、细胞过程(Cellular processes)、环境信息处理(Environmental information processing)、遗传信息处理(Genetic information processing)和新陈代谢(Metabolism)五大通路途径,其中,层次结构通路主要涉及家族:信号和细胞过程(Families:Signaling and cellular processes)、蛋白家族:代谢(Protein families:Metabolism)和蛋白家族:遗传信息处理(Protein families:Genetic information processing),细胞过程主要涉及运输和分解代谢(Transport and catabolism)、细胞群落原核生物(Cellular community-prokaryotes)及细胞生长死亡(Cell growth and death)等,环境信息处理主要涉及信号转导(Signal transduction)和膜运输(Membrane transport)2个通路途径,遗传信息处理主要涉及翻译(Translation)、转录(Transcription)及复制和修复(Replication and repair)等通路途径,新陈代谢主要涉及能量代谢(Energy metabolism)、碳水化合物代谢(Carbohydrate metabolism)及氨基酸代谢(Amino acid metabolism)等通路途径。同时,以光周期相关的差异表达基因所参与的通路途径进行富集分析,结果(图6)显示,光周期相关差异表达基因主要富集在8个通路途径中,其中有15个昼夜节律差异表达基因、3个泛素介导的蛋白水解基因及3个内质网蛋白加工差异表达基因达极显著差异水平;此外,有5个分别参与α-亚麻酸代谢、氨基酸和核苷酸糖代谢、苯丙素生物合成、淀粉和蔗糖代谢、植物激素信号转导的基因在T32和QR273中无显著差异。CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
经Peak关联基因分析结果(图7)显示,在T32与QR273间的6977个差异表达基因中有11个与昼夜节律相关的差异表达基因;有3个与昼夜节律和编码泛素介导的蛋白质水解通路途径相关的差异表达基因参;有3个参与植物激素信号转导的差异表达基因;有1个编码α-亚麻酸代谢的差异表达基因;有1个同时参与在氨基糖和核苷酸代谢及淀粉和蔗糖代谢的差异表达基因;有1个同时参与泛素介导的蛋白质水解和植物激素信号转导的差异表达基因;有1个参与苯丙烷生物合成的差异表达基因。
2. 5 光周期相关基因表达差异分析结果
基因表达差异分析(logFC:2个样品间的表达量比值)结果显示,15个光周期相关差异表达基因在玉米自交系T32与QR273间的表达同样存在显著差异(图8)。其中,下调表达基因为Zm00001e015122 (TOC1;logFC:1.77354)、Zm00001e008226(TOC1;logFC:1.26039)、Zm00001e022997(TOC1;logFC:1.69316)、Zm00001e012030(PHYC2;logFC:1.03377)、Zm00001e002655(COP1;logFC:3.24929)、Zm0000- 1e016746(HY5;logFC:1.48346)、Zm00001e011193(FKF1;logFC:1.21325)和Zm00001e025454(PIF3;logFC:2.45599);上调表达基因为Zm00001e005499(PHYA;logFC:1.57792)、Zm00001e041007(HY5;logFC:1.44814)、Zm00001e030377(COP1;logFC:5.91744)、Zm00001e027418(FT;logFC:3.96988)、Zm00001e023792(COP1;logFC:1.11024)、Zm0000- 1e021724(CCA1、LHY;logFC:1.61528)和Zm0000- 1e035953(PRR3、PRR5、PRR7;logFC:1.42903)。
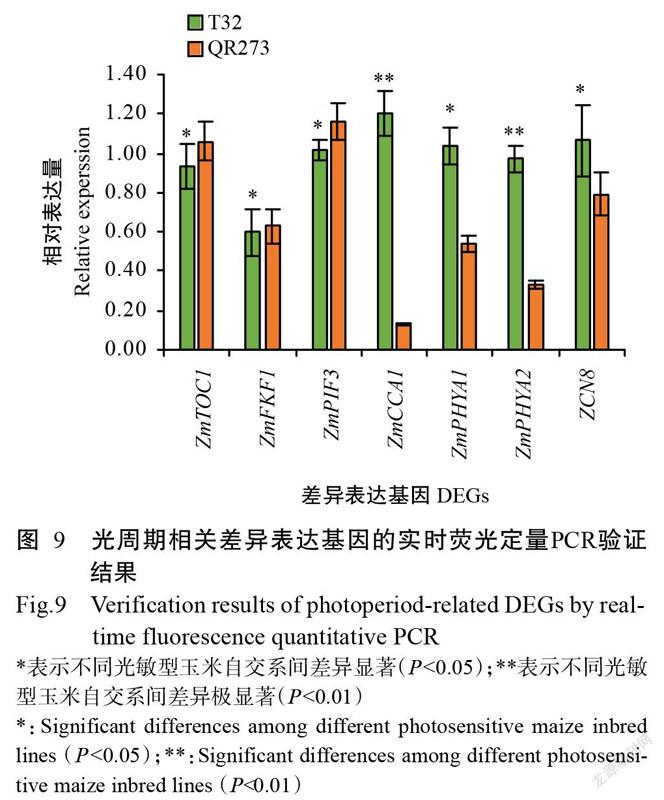
2. 6 实时荧光定量PCR验证结果
实时荧光定量PCR验证结果(图9)显示,在长日照条件下,ZmTOC1、ZmFKF1和ZmPIF3基因在T32中的相对表达量显著低于QR273(P<0.05,下同),而ZmPHYA1和ZCN8基因在T32中的相对表达量显著高于QR273,ZmCCA1和ZmPHYA2基因在T32中的相对表达量极显著高于QR273(P<0.01),与转录组测序结果一致,说明转录组测序数据可靠性较高。
3 讨论
玉米四叶期是营养生长期,也是成花诱导的开始时期,与成花启动的分子调控机制不完全相同。本研究结果表明,在长日照条件下,从光敏感自交系T32和光钝感自交系QR273间共检测到6977个差异表达基因,主要参与生物学过程、细胞组分和分子功能,其中参与生物学功能的差异表达基因最多。KEGG信号通路富集分析结果显示,这些差异表达基因主要参与层次结构、细胞过程、环境信息处理、遗传信息处理及新陈代谢等五大信号通路途径,其中参与代谢活动的差异表达基因最多。GO功能注释分析发现,有24个参与应答光刺激和应答辐射的基因在T32与QR273中表现出显著差异,且有17个同时与胚后期发育、光周期、分生组织营养生长向生殖生长转变的差异表达基因,与周金龙(2016)、任芹勇(2019)的研究结果相似。此外,本研究结果与T32和QR273的田间表现较一致,即T32表现为在长日照条件下光敏感,不能正常开花结实;QR273则表现为光钝感,在长日照条件下仍然能正常开花结实(刘颖等,2020),故推测T32与QR273间的差异表达基因是导致其光周期差异的重要因子。
ZmCCA1基因是玉米生物钟核心振荡器的关键基因,是拟南芥CCA1基因的同源基因,在清晨的表达水平达峰值,能与LHY基因相互作用形成负反馈环,共同抑制TOC1基因表达;TOC1基因又是CCA1和LHY基因的促进因子,夜晚时分CCA1和LHY基因的表達量降低,对TOC1基因的抑制作用减弱,因此,TOC1表达量的增加从而在凌晨促进CCA1和LHY基因表达,形成负反馈调节环(邢国芳等,2011)。ZmGI基因是玉米生物钟重要的输出基因,长日照条件下能与FKF1基因形成复合体在光照结束时达峰值,泛素化降解CDFs后转录激活下游转录调控基因,从而促进植物开花(刘玲,2014)。PRR亚族属于CCT结构域基因家族,影响植物的开花,CCA1和LHY基因同时转录激活PRR9、PRR7和PRR5基因,而在PRR5基因突变体中PRR9和PRR7基因的表达量显著降低,同时负调控CDF1基因,并抑制CCA1和LHY基因表达,致使生物钟缩短,PRR9基因或PRR7基因突变则导致生物钟延长(李剑峰等,2019)。本研究结果表明,多数光周期相关基因在光钝感自交系和光敏感自交系间的表达存在显著差异,且表达方向不同。其中Zm00001e015122、Zm00001e008226、Zm00001e022997、Zm00001e012 030、Zm00001e002655、Zm00001e016746、Zm0000-1e011193和Zm00001e025454基因在T32中呈下调表达,Zm00001e00-5499、Zm00001e041007、Zm0000-1e030377、Zm00001e027418、Zm00001e023792、Zm00001e021724和Zm00001e035953基因在T32中呈上调表达,可能与每个基因在应答光刺激过程中所扮演的角色不同存在关联。如COP1作为一种E3泛素化连接酶,能介导拟南芥光信号转导中HY5等正向调控因子的泛素化降解,从而影响植株幼苗的光形态建成、花青素合成及开花等生物学功能。Zm00001e030377和Zm00001e023792基因均属于COP1家族基因,编码COP1,在光敏感自交系T32中的相对表达量显著高于QR273,从而延迟开花。酵母双杂试验结果证明,COP1负调控HY5,而HY5是碱性亮氨酸拉链(bZIP)转录因子家族成员之一,可促进植物光形态建成;Zm00001e016746基因编码HY5转录因子,且在T32中的相对表达量显著高于QR273,从而延迟开花,与骆倩(2014)、崔连花等(2021)的研究完全一致。F-box蛋白FKF1属于ZTLs蓝光受体家族,能与GI相互作用形成复合体,抑制CDF1结合在CO蛋白上,从而促进开花。Zm0000-1e011193基因编码FKF1蛋白,在T32中的相对表达量低于QR273,故延迟开花,与杨敏等(2021)的研究结果一致。这与T32在长日照条件下不能正常结实,而QR273在长日照条件下可正常结实的表型完全一致,为进一步揭示热带玉米自交系光周期成花诱导分子调控机制及后续的热带玉米种质光周期遗传改良提供了参考依据。CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
4 结论
长日照条件下光敏型与光钝型热带玉米自交系间的转录组差异分析共鉴定出6977个显著差异表达基因(上调表达基因3291个,下调表达基因3686个),包括24个参与应答光刺激和应答辐射的差异表达基因有,17个同时与应答光刺激、应答辐射、胚后期发育、光周期及分生组织营养生长向生殖生长转变相关的差异表达基因,以及15个与昼夜节律通路相关的差异表达基因。这些基因通过差异性参与昼夜节律通路中的成花诱导,导致成花启动途径不完全相同,可能是热带种质光周期敏感性变异的关键遗传基因。
参考文献:
曹丹,张红梅,杨海鹏,赵欢,刘小红. 2021. 高温胁迫下不同玉米材料间的基因差异表达分析[J]. 甘肃农业大学学报,56(1):42-49. [Cao D,Zhang H M,Yang H P,Zhao H,Liu X H. 2021. A differential expression of genes between different maize materials under high temperature stress[J]. Journal of Gansu Agricultural University,56(1):42-49.] doi:10.13432/j.cnki.jgsau.2021.01.007.
常丽丽. 2009. 玉米光周期敏感相关基因ZmTFL1的克隆及功能验证[D]. 郑州:河南农业大学. [Chang L L. 2009. Cloning and characterization of ZmTFL1 gene related to photoperiod sensitivity in maize[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.y1574484.
崔连花,詹为民,杨陆浩,王少瓷,马文奇,姜良良,张艳培,杨建平,杨青华. 2022. 2个玉米ZmCOP1基因的克隆及其转录丰度对不同光质处理的响应[J]. 作物学报,48(6):1312-1324. [Cui L H,Zhan W M,Yang L H,Wang S C,Ma W Q,Jiang L L,Zhang Y P,Yang J P,Yang Q H. 2022. Molecular cloning of two maize (Zea mays) ZmCOP1 genes and their transcription abundances in response to different light treatments[J]. Acta Agronomica Sinica,48(6):1312-1324.] doi:10.3724/SP.J.1006.2022. 13040.
郭向阳,陈泽辉,胡兴,祝云芳,王安贵,陈建军. 2016. 热带玉米Suwan群体的遗传特性及育种潜势[J]. 玉米科学,24(4):41-45. [Guo X Y,Chen Z H,Hu X,Zhu Y F,Wang A G,Chen J J. 2016. Genetic characteristics and bree-ding potential of the good tropical maize Suwan groups[J]. Journal of Maize Sciences,24(4):41-45.] doi:10. 13597/j.cnki.maize.science.20160408.
贾小平,袁玺垒,李剑峰,王永芳,张小梅,张博,全建章,董志平. 2020. 不同光温条件谷子光溫互作模式研究及SiCCT基因表达分析[J]. 作物学报,46(7):1052-1062. [Jia X P,Yuan X L,Li J F,Wang Y F,Zhang X M,Zhang B,Quan J Z,Dong Z P. 2020. Photo-thermal interaction model under different photoperiod-temperature conditions and expression analysis of SiCCT gene in foxtail millet(Setaria italica L.)[J]. Acta Agronomica Sinica,46(7):1052-1062.] doi:10.3724/SP.J.1006.2020.94144.
黎裕,王天宇. 2010. 我国玉米育种种质基础与骨干亲本的形成[J]. 玉米科学,18(5):1-8. [Li Y,Wang T Y. 2010. Germplasm base of maize breeding in China and formation of foundation parents[J]. Journal of Maize Sciences,18(5):1-8.] doi:10.13597/j.cnki.maize.science.2010.05. 005.
李剑峰,李婷,贾小平. 2019. PRRs家族功能基因的研究进展[J]. 植物遗传资源学报,20(6):1399-1407. [Li J F,Li T,Jia X P. 2019. Advances on unlocking the functional basis of PRRs family genes[J]. Journal of Plant Genetic Resources,20(6):1399-1407.] doi:10.13430/j.cnki.jpgr. 20190403001.
刘莉,祝朋芳. 2004. 光周期与植物成花诱导[J]. 辽宁农业科学,(3):26-27. [Liu L,Zhu P F. 2004. Relationship between photoperiod and plant floral induction[J]. Liaoning Agricultural Sciences,(3):26-27.] doi:10.3969/j.issn.1002- 1728.2004.03.010.CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
刘玲. 2014. 玉米光周期途径中蓝光响应节律基因ZmFKF1的分子进化与关联分析[D]. 成都:四川农业大学. [Liu L. 2014. Molcular evolution and association analysis of ZmFKF1,a clock-controled gene in maize[D]. Chengdu:Sichuan Agricultural University.]
刘世梦倪,宋敏. 2021. 品种改良对玉米单产的贡献率分析[J]. 河南农业大学学报,55(2):364-371. [Liu S M N,Song M. 2021. Analysis on the contribution rate of varie-ty improvement to corn yield[J]. Journal of Henan Agricultural University,55(2):364-371.] doi:10.16445/j.cnki.1000-2340.20210317.002.
刘颖,吴迅,郭向阳,何兵,王安贵,刘鹏飞,高媛,涂亮,祝云芳,陈泽辉. 2020. 温热玉米T 32/齐319 F2:3家系光周期敏感性分析[J]. 种子,39(12):7-12. [Liu Y,Wu X,Guo X Y,He B,Wang A G,Liu P F,Gao Y,Tu L,Zhu Y F,Chen Z H. 2020. Photoperiodic sensitivity analysis of F2:3 family crossed by T32 and Qi319 from tropical regions[J]. Seed,39(12):7-12.] doi:10.16590/j.cnki.1001-4705. 2020.12.007.
骆倩. 2014. 拟南芥PIF3-LIKE1与phyB和COP1互作调控光形态建成的分子机制研究[D]. 上海:上海交通大学. [Luo Q. 2014. COP1 and phyB physically interact with PIL1 to regulate its stability and photomorphogenic development in Arabidopsis[D]. Shanghai:Shanghai Jiao Tong University.]
任芹勇. 2019. 谷子Ci846植物学特性学及转录组分析[D]. 呼和浩特:内蒙古农业大学. [Ren Q Y. 2019. Botany characteristics and transcription group analysis in foxtail millet Ci846[D]. Hohhot:Inner Mongolia Agricultural University.] doi:10.27229/d.cnki.gnmnu.2019.000579.
任小蕓. 2017. ZmPIFs基因的克隆、表达及AtPIFs基因的抗旱功能研究[D]. 扬州:扬州大学. [Ren X Y. 2017. Cloning and expression of ZmPIFs and study on the drought resistant function of AtPIFs[D]. Yangzhou:Yangzhou University.]
任永哲,陈彦惠,库丽霞,常胜合,高伟,陈晓. 2006. 玉米光周期反应及一个相关基因的克隆[J]. 中国农业科学,39(7):1487-1494. [Ren Y Z,Chen Y H,Ku L X,Chang S H,Gao W,Chen X. 2006. Response to photoperiodical variation and the clone of a photoperiod-related gene in maize[J]. Scientia Agricultura Sinica,39(7):1487-1494.] doi:10.3321/j.issn:0578-1752. 2006.07.026.
任照彬. 2018. 玉米光周期敏感性调节因子ZmCCA1互作蛋白的筛选及调控路径的初步鉴定[D]. 郑州:河南农业大学. [Ren Z B. 2018. Preliminary identification of pathway and interaction proteins of photoperiod sensitive factor ZmCCA1 in maize[D]. Zhengzhou:Henan Agricultu-ral University.] doi:10.27117/d.cnki.ghenu.2018.000039.
史勇,金维环,任真真,郭莎,董世凤,温岩朋,陈彦惠. 2021. 玉米光周期敏感调节机制的研究进展[J]. 玉米科学,29(1):92-96. [Shi Y,Jin W H,Ren Z Z,Guo S,Dong S F,Wen Y P,Chen Y H. 2021. Research advances in regulation mechanism of photoperiod sensitivity in maize[J]. Journal of Maize Sciences,29(1):92-96.] doi:10.13597/j.cnki.maize.science.20210114.
唐维,刘亚菊,张允刚,王欣,后猛,闫会,马代夫,李强. 2014. 植物GI基因生理功能研究进展[J]. 分子植物育种,12(5):1044-1049. [Tang W,Liu Y J,Zhang Y G,Wang X,Hou M,Yan H,Ma D F,Li Q. 2014. Advances on physio-logical functions of GI gene in plant[J]. Molecular Plant Breeding,12(5):1044-1049.] doi:10.13271/j.mpb.012.001 044.CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
王亚丽,陈煜东,王益军. 2021. 高世代回交玉米矮秆种质的转录组分析[J]. 江苏农业学报,37(2):280-288. [Wang Y L,Chen Y D,Wang Y J. 2021. Transcriptome analysis on the advanced backcross population of maize dwarf germplasm[J]. Jiangsu Journal of Agricultural Sciences,37(2):280-288.] doi:10.3969/j.issn.1000-4440.2021.02. 002.
吴连成. 2008. 光周期影响玉米开花转换的机理研究[D]. 郑州:河南农业大学. [Wu L C. 2008. Study on the mechanism of floral transition under different photoperiods in maize[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.y1574711.
邢国芳,杜伟建,张雁明,韩浩坤,韩渊怀. 2011. 玉米昼夜节律钟基因CCA1的克隆及表达分析[J]. 山西农业大学学报(自然科学版),31(4):332-337. [Xing G F,Du W J,Zhang Y M,Han H K,Han Y H. 2011. Cloning and expression analysis of circadian clock gene CCA1 in maize[J]. Journal of Shanxi Agricultural University(Natural science edition),31(4):332-337.] doi:10.3969/j.issn. 1671-8151.2011.04.008.
燕照玲,段俊枝,冯丽丽,陈海燕,齐红志,杨翠苹,施艳,任银玲,刘毓侠. 2017. 玉米抗病毒基因工程研究进展[J]. 南方农业学报,48(12):2136-2144. [Yan Z L,Duan J Z,Feng L L,Chen H Y,Qi H Z,Yang C P,Shi Y,Ren Y L,Liu Y X. 2017. Maize antiviral genetic engineering:A review[J]. Journal of Southern Agriculture,48(12):2136-2144.] doi:10.3969/j.issn.2095-1191.2017.12.04.
楊敏,胥华伟,王翠玲,杨护,魏岳荣. 2021. 利用CRISPR/Cas9技术研究玉米ZmFKF1在开花过程中的作用[J]. 中国农业科学,54(4):696-707. [Yang M,Xu H W,Wang C L,Yang H,Wei Y R. 2021. Using CRISPR/Cas9-media-ted targeted mutagenesis of ZmFKF1 delayed flowering time in maize[J]. Scientia Agricultura Sinica,54(4):696-707.] doi:10.3864/j.issn.0578-1752.2021.04.003.
杨爽. 2010. 玉米光周期敏感相关基因ZmCOL的克隆及功能验证[D]. 郑州:河南农业大学. [Yang S. 2010. Cloning and characterization of ZmCOL gene related to photope-riod sensitivity in maize[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.y1728556.
杨宗举,闫蕾,宋梅芳,苏亮,孟凡华,李红丹,白建荣,郭林,杨建平. 2016. 玉米光敏色素A1与A2在各种光处理下的转录表达特性[J]. 作物学报,42(10):1462-1470. [Yang Z J,Yan L,Song M F,Su L,Meng F H,Li H D,Bai J R,Guo L,Yang J P. 2016. Transcription characteristics of ZmPHYA1 and ZmPHYA2 under different light treatments in maize[J]. Acta Agronomica Sinica,42(10):1462-1470.] doi:10.3724/SP.J.1006.2016.01462.
张少方. 2011. 玉米光周期敏感基因ZmELF4的克隆及功能验证[D]. 郑州:河南农业大学. [Zhang S F. 2011. Cloning and characterization of photoperiod sensitive gene Zm-TFL1 in maize[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.y1999417.
周海宇,程伟东,谢小东,周锦国,覃兰秋,谢和霞,谭贤杰,江禹奉. 2020. 14份玉米自交系的光周期敏感性分析[J]. 西南农业学报,33(9):1877-1883. [Zhou H Y,Cheng W D,Xie X D,Zhou J G,Qin L Q,Xie H X,Tan X J,Jiang Y F. 2020. Photoperiod sensitivity analysis of 14 maize inbred lines[J]. Southwest China Journal of Agricultural Sciences,33(9):1877-1883.] doi:10.16213/j.cnki.scjas. 2020.9.001.CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F
周金龙. 2016. 玉米光周期敏感近等基因系的转录组分析[D]. 郑州:河南农业大学. [Zhou J L. 2016. Transcriptome analysis of maize photoperiod-insensitive near-isogenic[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.D01117137.
Alabadí D,Oyama T,Yanovsky M J,Harmon F G,Más P,Kay S A. 2001. Reciprocal regulation between TOC1 and LHY/CCA1 within the Arabidopsis circadian clock[J]. Science,293(5531):880-883. doi:10.1126/science. 1061320.
Gendron J M,Pruneda-Paz J L,Doherty C J,Gross A M,Kang S E,Kay S A. 2012. Arabidopsis circadian clock protein,TOC1,is a DNA-binding transcription factor[J]. Proceedings of the National Academy of Sciences of the United States of America,109(8):3167-3172. doi:10. 1073/pnas.1200355109.
Jin M L,Liu X G,Jia W,Liu H J,Li W Q,Peng Y,Du Y F,Wang Y B,Yin Y J,Zhang X H,Liu Q,Deng X,Li N,Cui X Y,Hao D Y,Yan J B. 2018. ZmCOL3 a CCT gene represses flowering in maize by interfering with the circadian clock and activating expression of ZmCCT[J]. Journal of Integrative Plant Biology,60(6):465-480. doi:10.1111/jipb.12632.
Lee Y S,An G. 2015. OsGI controls flowering time by modulating rhythmic flowering time regulators preferentially under short day in rice[J]. Journal of Plant Biology,58(2):137-145. doi:10.1007/s12374-015-0007-y.
Meng X,Muszynski M G,Danilevskaya O N. 2011. The FT-like ZCN8 gene functions as a floral activator and is involved in photoperiod sensitivity in maize[J]. The Plant Cell,23(3):942-960. doi:10.1105/tpc.110.081406.
Miller T A,Muslin E H,Dorweiler J E. 2008. A maize CONSTANS-like gene,conz1,exhibits distinct diurnal expression patterns in varied photoperiods[J]. Planta,227(6):1377-1388. doi:10.1007/s00425-008-0709-1.
Yang Q,Li Z,Li W Q,Ku L X,Wang C,Ye J R,Li K,Yang N,Li Y P,Zhong T,Li J S,Chen Y H,Yan J B,Yang X H,Xu M L.2013. CACTA-like transposable element in ZmCCT attenuated photoperiod sensitivity and accelerated the post domestication spread of maize[J]. Proceedings of the National Academy of Sciences of the United States of America,110(42):16969-16974. doi:10.1073/pnas. 1310949110.
(責任编辑 兰宗宝)CB6E18A6-CA0D-42C0-9C0F-28C54F624F8F

