低压静电场对采后马铃薯块茎愈伤效果的影响
张婷婷,王凤玲*,彭梦云,张欠欠,何兴兴,林琼,关文强*
(1.天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134;2.中国农业科学院农产品加工研究所,北京 100193)
马铃薯(Solanum tuberosum L.)又名土豆、洋芋、荷兰薯等,由于其营养丰富,深受大众的喜爱,是仅次于小麦、稻谷和玉米的全球第四大重要的粮食作物[1]。我国是马铃薯生产、出口和消费的大国,种植面积和产量均稳居世界首位[2]。但马铃薯块茎在田间采收、交通运输、市场流通等过程中薯皮易受到如切伤、擦伤和碰伤等机械损伤,进而导致采后病害的发生,间接造成重大的经济损失[3]。虽然马铃薯块茎可在损伤部位形成愈伤组织来有效抑制块茎的水分蒸腾和增强抵抗外力破坏的能力,但自然愈伤所需时间较长,并且实际生产中通常在损伤伤口未完全愈合的条件下就将马铃薯入贮或上市流通,从而导致贮藏期腐烂[3-4]。目前已有一些化学处理,如水杨酸[5]、脱落酸[6]、苯并噻重氮[7]等被报道可以促进采后马铃薯块茎的愈伤,但化学处理易残留,因此开发绿色、快速地马铃薯愈伤技术对于促进采后马铃薯愈伤效果、提高其贮藏品质具有重要意义。
低压静电场(low voltage electrostatic field,LVEF)是一种可应用于果蔬贮藏保鲜领域的新兴技术,一般电压≤2 500 V,电流≤0.2 mA,通过空间放电的形式在贮藏库内形成负离子环境,在电场离子的作用下使水产生共振现象,从而达到防止营养成分流失,减少重量损耗,维持食品原有品质的效果[8-9]。低压静电场具有设备轻巧、电压小、节能、安全等特点,非常适合用于大型空间库贮藏、运输车辆内安装和冷鲜柜等冷藏小型设备,具有十分广阔的发展前景[10-12]。成纪予等[13]研究发现适宜的电场处理能够减少机械损伤对甘薯愈伤组织的伤害,增强甘薯贮藏期间的抗病性,促进甘薯愈伤。张敏欢等[14]研究发现,在4℃贮藏条件下,低压静电场能明显抑制马铃薯的表皮变绿,延长休眠期,维持营养成分,有利于马铃薯的长期贮藏。目前关于低压静电场是否能够促进采后马铃薯块茎愈伤的研究尚未见报道。
本研究以“冀张薯12号”马铃薯为试验材料,人工模拟机械损伤后,置于黑暗常温[(20±2)℃]、相对湿度85%~90%、低压静电场环境下贮藏,通过测定损伤块茎愈伤期间失重率、损伤伤口处硬度、褐变度、苯丙烷代谢相关酶活性及关键产物、H2O2含量等,评价其愈伤效果,以期为采后马铃薯块茎的快速愈伤提供新方法。
1 材料与方法
1.1 材料与试剂
“冀张薯12号”马铃薯:市售,挑选大小[(150±30)g]均匀、无机械损伤、无病虫害的新马铃薯块茎。
木质素染色液(间苯三酚法):天津歆毅翎科技有限公司;过氧化氢含量测定试剂盒(比色法):南京建成科技有限公司;乙酰溴(分析纯):上海麦克林生化科技有限公司;聚乙二醇6000(分析纯):天津科密欧化学试剂有限公司;愈创木酚(分析纯):国药集团化学试剂有限公司;无水醋酸钠、无水甲醇、盐酸、硼酸、氢氧化钠、邻苯二酚(均为分析纯):天津市赢达稀贵化学试剂厂。
1.2 仪器与设备
GYJ-012型低压静电场装置:艾克卡贝(天津)生物科技有限公司;OLYMPUS CKX53型生物荧光倒置显微镜:日本奥林巴斯有限公司;LGJ-20F型冷冻干燥机:北京松原华兴科技发展有限公司;Evolution201型紫外分光光度计:美国Thermo Scientific公司;Tube Mill 100 control试管研磨机:德国IKA公司;CR-400型色彩色差计:日本柯尼卡美能达公司;TA-XTplus质构分析仪:英国Stable Micro System公司。
1.3 方法
1.3.1 样品处理
块茎人工损伤参考姜红等[15]的方法。流动自来水冲洗掉马铃薯块茎表面泥土,置于1%次氯酸钠溶液中浸泡2 min,无菌水再次冲洗后自然晾干,在块茎赤道中部切出3处分布均匀的伤口(长×宽×深=20 mm×20 mm×2 mm)。
将人工损伤后的块茎装入打孔的聚乙烯保鲜袋(长×宽=35 cm×25 cm,厚 0.007 mm)中,如图1所示,放入置有低压静电场的常温[(20±2)℃]、相对湿度85%~90%、黑暗条件下进行愈伤,以无低压静电场的同等环境为对照,于愈伤第 0、3、5、7、14、21 天时取样观察其愈伤效果。

图1 低压静电场试验装置图Fig.1 Low voltage electrostatic field experimental device diagram
1.3.2 失重率的测定
采用称重法[16]测定马铃薯块茎失重率。
1.3.3 木质素的沉积观察
木质素的染色观察参考姜红等[15]的方法并稍作修改。用刀片垂直于损伤块茎愈伤表面的组织切出厚度为0.2 mm~0.3 mm的薄片,立即用蒸馏水多次冲洗切片以除去淀粉颗粒。将切片置于载玻片上,滴加50 μL~100 μL的木质素酸化液,放置浸透1 min后加入等量的间苯三酚染色液,立即置于倒置荧光显微镜下,10倍放大进行观察并拍照。木质化细胞层厚度使用WT-1000GM图像软件进行测量。
1.3.4 硬度的测定
参照Jiang等[17]的方法并稍作修改,利用质构仪对块茎伤口部位硬度进行测定,使用P/2探头(直径为2 mm),测试前速度为2 mm/s,测试速度为1 mm/s,测试后速度为10 mm/s,测试深度为10 mm,单位为N。
1.3.5 愈伤表面褐变度值的测定
使用色差计测定马铃薯块茎伤口处组织表面的L*、a*和b*值,每个处理用马铃薯10个,重复3次,按公式(1)计算褐变度[18]。

式中:X=(a*+1.75L*)/(5.645L*+a*-3.012b*)。
1.3.6 生化指标测定
愈伤第 0、3、5、7、14、21 天时,用刀片切取马铃薯块茎损伤创面长2 cm,宽2 cm,深2 mm~3 mm的愈伤组织,液氮冷冻后使用冷冻干燥机冻干研磨成干粉,于-80°C的超低温冰箱内密封保存待测[19]。
1.3.6.1 酶活性的测定
苯丙氨酸解氨酶(phenylalnine ammonia lyase,PAL)活性测定参考张静荣等[20]的方法,以U/(h·g FW)表示,FW表示样品鲜重。
过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)活性的测定参考曹建康等[21]的方法,分别以ΔOD470/(min·g)和以ΔOD420/(min·g)表示。
1.3.6.2 总酚、类黄酮和木质素含量的测定
总酚、类黄酮含量的测定参考李雪等[22]的方法,总酚含量用OD280/g FW表示,类黄酮含量用OD325/g FW表示。
木质素含量的测定参考Yang等[3]的方法,表示为OD280/g FW。
1.3.6.3 H2O2含量测定
准确称取0.5 g的冻干粉,加入4.5 mL提前预冷的生理盐水,于4℃、10 000×g条件下离心20 min,取上清液按过氧化氢试剂盒说明书要求进行测定,H2O2含量以mmol/g prot表示,其中蛋白含量参照考马斯亮蓝染色法进行测定[21]。
1.4 数据处理
以上试验均重复3次,结果以平均值±标准差表示,使用SPSS 26.0软件进行Duncan’s差异显著性分析,采用Origin 9.0软件绘图。
2 结果与分析
2.1 低压静电场处理对采后马铃薯块茎愈伤期间失重率的影响
失重率是评价块茎愈伤效果的重要指标,愈伤程度越高,水分散失速率越慢,失重率就越低[23]。低压静电场处理对采后马铃薯块茎愈伤期间失重率的影响见图2。

图2 低压静电场处理对采后马铃薯块茎愈伤期间失重率的影响Fig.2 Effect of low voltage electrostatic field treatment on the weight loss rate of postharvest potato tubers during healing
由图2可知,在愈伤过程中,低压静电场组和CK组损伤马铃薯块茎的失重率均呈逐渐上升的趋势,且愈伤初期(0~7 d)失重率的增加速率显著快于愈伤后期(14 d~21 d)(P<0.05),这是因为块茎在受到损伤后,损伤表面快速形成愈伤周皮来防止水分的进一步散失。低压静电场组损伤块茎的失重率在愈伤期间始终低于CK组,在愈伤第14天时低于CK组12.91%(P<0.05),第 21天时较 CK 组低 14.77%(P<0.05),这说明低压静电场处理能够促进马铃薯块茎损伤表面周皮的形成,在一定程度上减少了马铃薯块茎愈伤期间的重量损伤,从而促进块茎愈伤。
2.2 低压静电场处理对采后马铃薯块茎愈伤期间木质素积累的影响
低压静电场处理对采后马铃薯愈伤期间木质素积累及细胞层厚度的影响见图3~图4。

图3 低压静电场处理对采后马铃薯块茎愈伤期间木质素积累的影响Fig.3 Effects of low voltage electrostatic field treatment on lignin accumulation in postharvest potato tubers during healing

图4 低压静电场处理对采后马铃薯块茎愈伤期间伤口处木质素细胞层厚度的影响Fig.4 Effect of low voltage electrostatic field treatment on the thickness of lignin cell layer in wound of postharvest potato tuber during healing
块茎伤口处木质素的积累速率和细胞层厚度反映了块茎愈伤组织形成的程度[23]。由图3、图4可知,在愈伤前期(0~7 d),损伤块茎伤口处的木质素积累量和积累速度迅速增加,且在整个愈伤期间低压静电场组块茎的积累量和积累速度均显著高于CK组(P<0.05),积累量具体以木质素细胞层厚度来表示,由图4可知,在愈伤3 d时低压静电场组木质素细胞层厚度比CK组高出了52.60%,5 d时高出32.81%,14 d时高出16.41%,21 d时高出14.01%。这些数据表明低压静电场处理能有效促进采后马铃薯块茎伤口处木质素的积累,且前期促进效果大于后期。
2.3 低压静电场处理对采后马铃薯块茎愈伤组织硬度的影响
马铃薯块茎在受到机械损伤后,伤口表面快速形成愈伤组织,愈伤组织表面致密的表层导致硬度增加[24]。低压静电场处理对采后马铃薯块茎愈伤期间伤口处硬度的影响见图5。
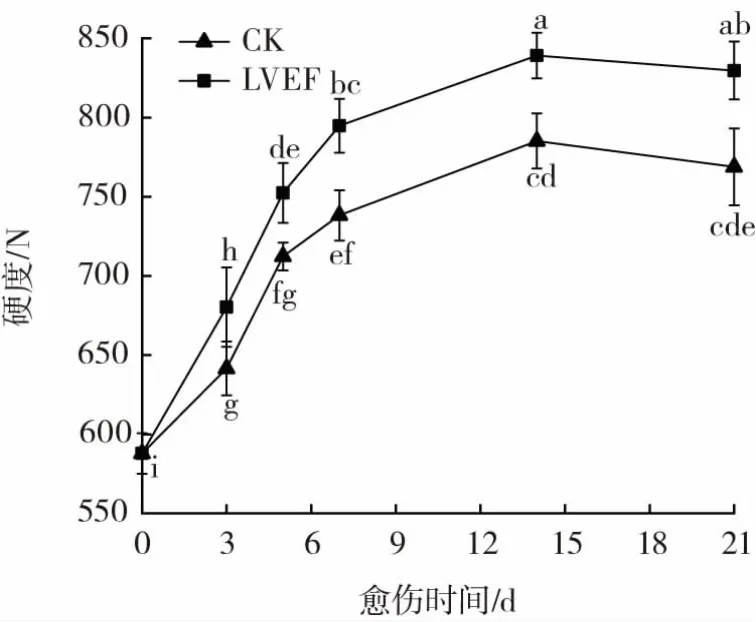
图5 低压静电场处理对采后马铃薯块茎愈伤期间伤口处硬度的影响Fig.5 Effect of low voltage electrostatic field treatment on wound firmness of postharvest potato tubers during healing
如图5可知,采后马铃薯块茎伤口处硬度在愈伤初期(0~7 d)呈快速上升趋势,愈伤7 d后硬度值缓慢增加,愈伤第14天时硬度值达到最高,后又呈下降趋势,且低压静电场组块茎伤口处硬度始终高于CK组,在愈伤第21天时较CK高出7.91%(P<0.05)。结果表明,低压静电组能够促进块茎愈伤组织表面致密表层的形成,与Jiang等[17]在苯丙噻重氮促进马铃薯块茎创伤愈合的研究结果一致。
2.4 低压静电场处理对采后马铃薯块茎愈伤表面褐变度的影响
伤口处表面的褐变度能够反映酚类物质的氧化程度[25]。这是因为在马铃薯愈伤期间,PPO能够通过氧化损伤表面的酚类物质生成醌类物质,醌类物质经过一系列反应最终形成类黑素附着在损伤表面,从而导致块茎损伤表面的褐变[26]。低压静电场处理对采后马铃薯块茎愈伤期间伤口处褐变度的影响见图6。

图6 低压静电场处理对采后马铃薯块茎愈伤期间伤口处褐变度的影响Fig.6 Effect of low voltage electrostatic field treatment on browning degree of postharvest potato tubers during healing
由图6可知,在愈伤期间,低压静电场组和CK组马铃薯块茎伤口处褐变度均呈现先升后降的趋势,这可能是因为马铃薯块茎在受到伤害后,损伤表面迅速氧化,进而导致褐变度的快速升高,在愈伤中后期,损伤表面色度逐渐接近周围表皮,从而导致褐变度的下降。且低压静电场组的褐变度值始终高于CK组,在愈伤第5天时高出CK组18.32%(P<0.05),第21天时高出CK组10.61%(P<0.05),结果表明低压静电场处理能够促进采后马铃薯块茎伤口表面的褐变。
2.5 低压静电场处理对采后马铃薯块茎愈伤组织中PAL活性、总酚、类黄酮和木质素含量的影响
苯丙烷代谢与采后马铃薯块茎的愈伤过程密切相关[4]。PAL是苯丙烷代谢的关键酶,参与苯丙烷代谢的第一步反应,对总酚、类黄酮和木质素等次生代谢产物的生成具有重要的催化作用[27-28]。总酚和木质素含量的增加可加快受损伤部位的修复,类黄酮的积累是衡量植物抗病性强弱的指标[29]。低压静电场处理对采后马铃薯块茎愈伤期间伤口处总酚、类黄酮和木质素含量及PAL活性的影响如图7所示。


图7 低压静电场处理对采后马铃薯块茎愈伤期间伤口处PAL活性、总酚、类黄酮和木质素含量的影响Fig.7 Effect of low pressure electrostatic field on PAL activity,the content of total phenolic,flavonoids and lignin of potato tuber during healing
由图7可知,低压静电场组和CK组伤口处的PAL活性呈现先升后降的趋势,在愈伤第7天时活性最高,且低压静电场组的PAL活性在整个愈伤期间均高于对照组,在愈伤第14天时,高出CK组46.94%(P<0.05)。低压静电场组和对照组的总酚、类黄酮和木质素含量在愈伤期间均呈现上升趋势,愈伤前期(0~7 d)积累速率快于愈伤中后期(7 d~21 d),且低压静电场组始终显著高于CK组,在愈伤第14天时分别比CK组高出13.91%、5.06%和 17.47%(P<0.05),在愈伤第21 d时分别比CK组高出11.94%、8.35%和23.35%(P<0.05)。
当马铃薯块茎受到损伤后,机体内的苯丙烷代谢立即被激活,在PAL的催化作用下,块茎产生总酚、类黄酮和木质素等代谢产物,当代谢产物积累到一定程度时,又会负反馈来抑制PAL活性,导致愈伤中后期PAL活性的降低,而相关代谢产物含量则在愈伤中后期趋于稳定[30]。研究发现,与对照组相比,低压静电场处理能够提高块茎损伤处的PAL活性,促进代谢产物的合成,该结果与Yang等[3]在热水浸泡刺激马铃薯块茎伤口愈伤的研究结果一致。
2.6 低压静电场处理对采后马铃薯块茎愈伤组织中PPO、POD活性和H2O2含量的影响
PPO、POD活性和H2O2在马铃薯块茎愈伤过程中起着至关重要的作用,其中H2O2是激活愈伤早期防卫反应的信号分子和激活苯丙烷代谢的第二信使;POD是促进木质素合成的关键酶,在H2O2的参与下能够促进木质素单体的氧化交联[19,31];PPO则是参与酚类物质氧化成醌类物质的关键氧化酶,和块茎损伤表面的褐变密切相关[32]。低压静电场处理对采后马铃薯块茎愈伤期间伤口处PPO、POD活性和H2O2含量的影响如图8所示。

图8 低压静电场处理对采后马铃薯块茎愈伤期间伤口处PPO、POD活性和H2O2含量的影响Fig.8 Effect of low pressure electrostatic field on PPO activity,POD activity and H2O2content of potato tuber during healing
如图8所示,在愈伤期间,低压静电场组和CK组伤口处组织的PPO活性呈现先升高后降低的趋势,低压静电场组的PPO活性在愈伤期间始终高于对照组,在愈伤第7天时,较CK组高出18.89%(P<0.05),在愈伤第21天时,较CK组高出32.30%(P<0.05)。结果表明,低压静电场处理提高了块茎愈伤过程中伤口处的PPO活性,促进了块茎伤口表面酚类物质的褐变。两个组伤口处的POD活性和H2O2含量在愈伤期间均逐渐增加,在愈伤第3天时,低压静电场组和CK组均无显著性差异,在愈伤第7天时,低压静电场组的POD活性和H2O2含量分别高出CK组57.42%和15.90%(P<0.05),愈伤第21天时,分别高出CK组17.41%和12.53%(P<0.05)。结果表明,低压静电场处理能够提高POD活性和H2O2含量,促进愈伤表面木质素的积累,促进块茎愈伤。
3 结论
低压静电场处理能够促进马铃薯块茎损伤组织中苯丙烷代谢关键酶——苯丙氨酸解氨酶的活性,提高过氧化物酶、多酚氧化酶活性及H2O2的含量,加速伤口表面的褐变,提高伤口处组织表面的硬度,促进总酚、类黄酮、木质素含量的积累,减少采后马铃薯块茎愈伤期间的质量损失,对马铃薯块茎的采后愈伤具有积极作用。鉴于低压静电场的绿色安全性,该方法可作为促进采后马铃薯块茎愈伤的一种措施,但其中涉及的具体途径还需进一步探究。

