螺旋藻多糖对秀丽隐杆线虫氧化应激及寿命的影响
王 猛,马浩天,关思宇,狄建兵,王 愈,李润植,崔红利,*
(1 山西农业大学农学院分子农业与生物能源研究所 山西太谷 030801 2 山西农业大学食品科学与工程学院 山西太谷 030801)
氧自由基反应及脂质过氧化是维持机体新陈代谢、免疫应答的重要因素。当机体受到内源或外源刺激而引起氧化应激时,氧自由基反应失衡,体内积累大量的活性氧自由基 (Reactive oxygen species,ROS),进而导致自身抗氧化能力下降。现有研究表明,癌症、衰老、心血管疾病、糖尿病或其它慢性疾病大多与氧化应激反应有关[1-3]。例如:ROS 刺激中枢神经氧化会导致多种神经退行性疾病,如阿尔茨海默综合症 (Alzheimer's disease,AD)和亨廷顿氏病(Huntington's disease,HD)等[4-5]。生物体细胞ROS 富集会引起生物体机能退化,而药物合理干预动物机体会提高抗氧化性,缓解ROS 迸发所致衰老及疾病。目前,人工合成的抗氧化剂毒副作用较大,抗氧化效率较低,在应用范围上有很大的局限性。寻找天然抗氧化药物至关重要。来源于海藻的天然产物,如海藻多糖因毒副作用小而备受关注。有研究表明,海藻多糖因具有较强的抗氧化作用,故能够显著延缓线虫衰老[6]。
螺旋藻多糖(Spirulina polysaccharides,PSPs)是一种生理活性多糖,广泛存在于蓝藻门螺旋藻属,具有抗氧化、抗炎、抗菌、抗肿瘤、抗病毒、抗便秘以及提高机体免疫等多重功效[7-15]。Zheng等[16]研究表明,PSPs 对阿尔茨海默病小鼠脑线粒体氧化有保护作用。陈帅行等[17]发现,PSPs 可缓解急性酒精中毒引起的小鼠内脏氧化损伤。近年来,随着PSPs 生物活性作用研究的不断深入,市场上PSPs 功能食品应运而生,然而其作为外源活性物质对缓解生物氧化应激及延缓寿命的分子机制尚不明确,本文将针对PSPs 的抗氧化分子机制做进一步研究。
秀丽隐杆线虫 (Caenorhabditis elegans,C.elegans)具有成本低、繁殖力强、遗传背景清晰、与人类因同源性高等特点,被广泛用作抗氧化和抗衰老研究的模型生物[18-19]。胰岛素/类胰岛素生长因子(Insulin/IGF-1,IIS)是一条经典的进化高度保守的衰老调控通路,广泛存在于在模式动物体内。前人研究发现通过对IIS 信号通路的适度抑制,可延缓哺乳动物衰老,延长寿命[20-21]。此外,研究表明多糖可通过作用于某些信号通路信号分子来调节下游基因的表达[22]。据此推测PSPs 可以通过调控相关信号通路增强线虫抵抗氧化应激的能力。本研究以饲喂OP50 的秀丽隐杆线虫为模式动物,研究PSPs 对线虫抗氧化性及其作用机制,为其作为天然食品开发利用提高理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料 PSPs,购自福清市新大泽螺旋藻有限公司,由山西农业大学分子农业与生物能源研究所保管。菌株(N2 株系),购自美国线虫遗传中心(Caenorhabditis genetics center,CGC)。将线虫接种于添加尿嘧啶缺陷型大肠杆菌(OP50)的线虫生长培养基(NGM)培养基,培养于在20℃恒温培养箱,光暗时间为12 h/12 h,光强3 000 Lx。
无水乙醇、甲醇、H2O2,天津恒兴化学试剂制造有限公司(分析纯级)、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH,分析纯级)、ROS 荧光探针二氢乙锭(Dihydroethidium,DHE)试剂盒、荧光素二乙酸(FDA)、过氧化氢酶(CAT)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、BCA 法蛋白质浓度测定等相关试剂盒,南京建成生物科技研究所。
1.1.2 仪器与设备 WFJ2100 紫外光分光光度计,上海尤尼柯仪器有限公司;LX73 正置荧光显微镜,日本Olympus 公司;Boxun BJ-CD 超净工作台,上海博讯实业有限公司;体式显微镜,重庆奥特光学仪器公司;H1850 台式冷冻离心机,湘潭湘仪仪器有限公司;LRH-250F 生化培养箱,无锡玛瑞特科技有限公司;MyCycler PCR 仪、MyiQ2 qPCR 仪,美国Bio-Rad 公司。
1.2 方法
1.2.1 DPPH 自由基清除能力的测定 DPPH 自由基清除能力测定根据参考文献[23]所述方法。首先将PSPs 分别配制成质量浓度为1,2,3,4,5 mg/mL 的样品溶液,每个质量浓度重复3 次,避光室温反应30 min,然后用紫外分光光度计在波长517 nm 处测定每组吸光度值,根据公式计算自由基清除率。

式中,A0——2 mL 无水乙醇+2 mL DPPH 吸光值;A1——2 mL 样液+2 mL DPPH 吸光值;A2——2 mL 无水乙醇+2 mL 样液吸光值。
1.2.2 总还原力的测定 总还原力测定方法根据参考文献[30]的方法。取1.2.1 节的PSPs 样品溶液1 mL,分别加入2.5 mL PBS(pH=6.6)和1%K3Fe(CN)6,充分混匀后50 ℃水浴20 min。冷却后加入2.5 mL 10% CH3COOCl3、蒸馏水和0.5 mL 0.1% FeCl3充分反应,静置10 min 后用紫外分光光度计测定波长700 nm 处的吸光值。
1.2.3 线虫寿命、运动能力和活力的测定 将同期化至L4 期线虫随机分为4 组,分别接种至不含或含有不同质量浓度(50,100,200 μg/mL)PSPs 的NGM 培养基饲养(饲喂OP50,为防止排卵影响,添加150 μmol/L 五氟尿嘧啶)。每组3 次重复,每板30 条,于恒温、恒湿培养箱中培养,此时记为线虫寿命的第0 天。每天更换新鲜培养基,同时挑出死亡线虫,记录存活个数,计算生存率,直至所有线虫死亡(判别标准:线虫无移动及吞咽动作,用铂金探针轻触虫体无任何反应的即为死亡)。钻入培养基的线虫及因其它因素死亡的线虫从统计数据中排除,每个独立试验至少3 次平行。以生存率百分比为纵坐标,绘制生存曲线,并用Origin 软件进行单因素方差分析(One-way analysis of variance,One-way ANOVA),数据采用平均值±标准差(±s)表示。
线虫运动能力检测参考文献[24]的方法。将同期化至L4 期线虫转入含有或不含PSPs 的NGM培养基上,恒温培养,在第5,10 天时挑在1 mL M9 缓冲液的平板上,适应5 min 后观察并记录30 s 内头部摆动次数,每条线虫统计3 次重复,取平均值为最终结果。每个独立试验至少设置3 次平行。线虫活力采用二乙酸荧光素法(FDA)测定:取一线虫培养平板,切除2.0 cm×2.0 cm 的琼脂,加入M9 缓冲液,低速离心后收集虫体。将5 mL FDA 溶于1 mL 丙酮中,避光4 ℃保存。荧光检测前,将0.4 mL FDA 加入0.65 mol/L 甘露醇溶液中,每个虫体样品避光染色40 min,用磷酸盐-生理盐水缓冲液冲洗3 次,用荧光显微镜在激发波长485 nm、发射波长530 nm 的蓝光下镜检。
1.2.4 体内脂褐素、ROS 及抗氧化酶的测定 采取自发荧光法检测脂褐素。收集不同处理的虫体,置于荧光显微镜紫外激发光下观察。ROS 测定:取灭菌平板,加入M9 缓冲液,收集虫体后用DHE 荧光探针避光孵育30 min,于激发波长485 nm、发射波长530 nm 蓝光观察。为了确定PSPs 是否介导体内抗氧化酶活性表达,收集PSPs 给药2 d 后的虫体,检测其SOD 和CAT 酶活性。测定方法:选取离心后的虫体样本1 mL,置于EP 管中,离心后收集沉淀,加入液氮研磨,其CAT、SOD 活性分别用相应的试剂盒测定,结果以对照组的100%表示。同时将收集的部分虫卵离心、研磨,取上清液用BCA 试剂盒测定蛋白浓度。
1.2.5 秀丽隐杆线虫氧化应激模型的建立 将接种于含有或不含PSPs 的培养基(培养基含有150 μL 五氟尿嘧啶)上培养2 d 的线虫,急性暴露于1‰ H2O2的NGM 培养基上,饲喂OP50,每隔1 h计数线虫的存活个数,绘制生存曲线,直至全部死亡。
1.2.6 mRNA 提取及荧光定量PCR 检测 将同期化L4 期线虫用多糖处理后,培养2 d。收集虫体于离心管中,PBS 缓冲液清洗3 次。Trizol 法提取线虫总RNA,Primer 5.0 设计相关基因引物。用SYBR Green 为DNA 荧光染料,实时荧光定量PCR 测定,以β-Actin 为内参测定daf-16 及其下游靶基因的表达量,基因表达以PCR 的2-ΔΔCt值表示。

表1 秀丽隐杆线虫抗氧化基因实时定量PCR 引物Table 1 Real time quantitative PCR primers for antioxidant genes of C.elegans
1.3 统计学分析
数据处理采用Graphpad Prism 5.0,P<0.05表示差异显著,图中用* 标记;P<0.01 表示极显著差异,图中用** 标记。数据采用平均值±标准差(x±s)表示,用One-way ANOVA 处理,FDA 染色、脂褐素以及ROS 荧光用显微镜观察并拍照,作图用Origin 9.1。
2 结果
2.1 PSPs 清除DPPH 自由基和提升总还原力能力
DPPH·清除率是典型的体外抗氧化活性定量评价指标。本文用VC 作对照,评价PSPs 对DPPH自由基的清除能力,如图1a所示。当PSPs 质量浓度0~5 mg/mL 时,随着给药质量浓度的增加,DPPH 自由基清除率显著增加,效果呈质量浓度依赖性;当PSPs 质量浓度为5 mg/mL 时,其对DPPH·清除率最大,为42.37%。众所周知,抗氧化剂对Fe3+的还原能力与抗氧化活性成正相关,PSPs 的还原力越强抗氧化效果越强。图1b 显示,在质量浓度为0~5 mg/mL 范围,PSPs 对铁氰化钾的还原力呈质量浓度依赖性增加。
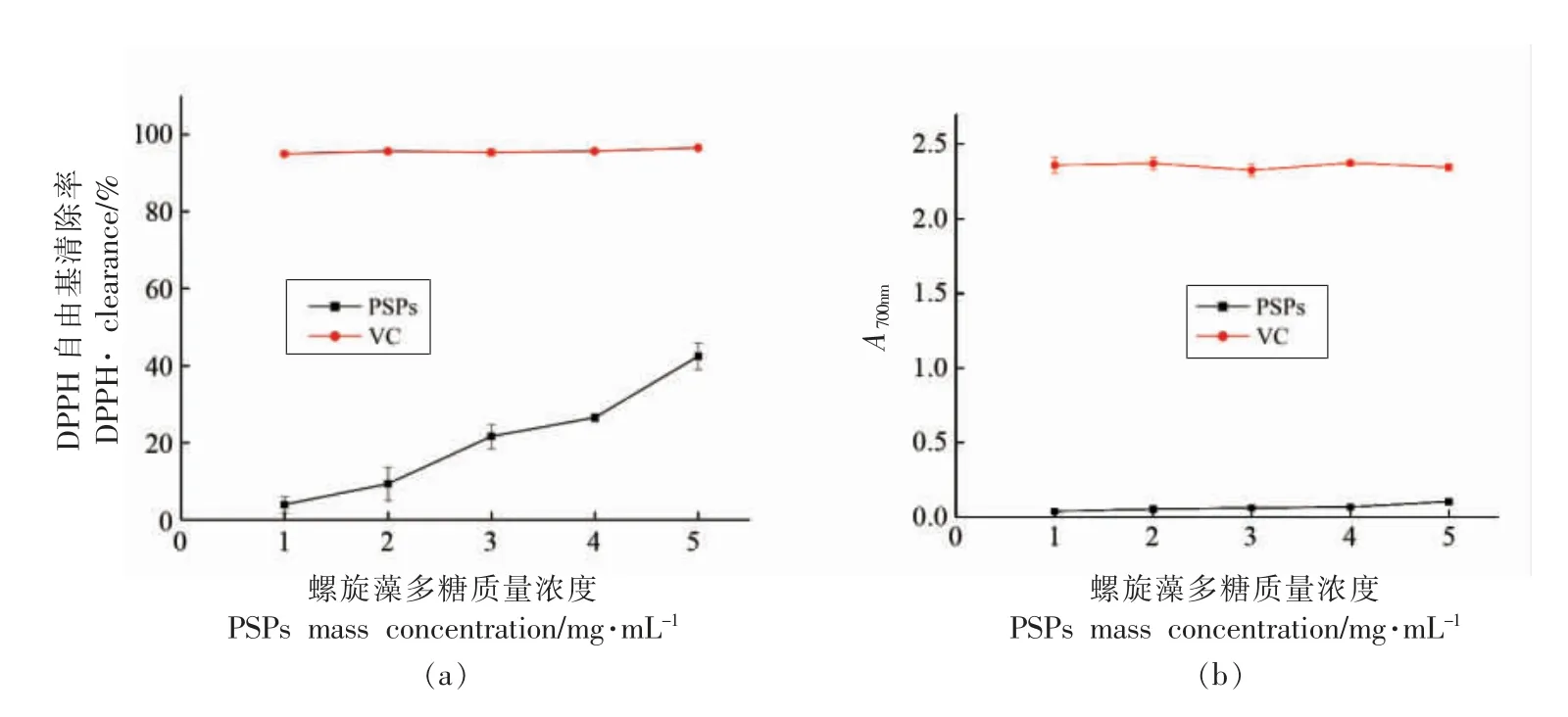
图1 螺旋藻多糖自由基清除率(a)和总还原力(b)测定Fig.1 Determination of free radical clearance (a) and total reducing power (b) of PSPs
2.2 PSPs 对秀丽隐杆线虫寿命的影响
用不同质量浓度的PSPs(50,100,200 μg/mL)培养N2 野生型秀丽隐杆线虫,研究PSPs 对线虫寿命的影响。存活率曲线以及各剂量PSPs 处理对线虫平均寿命的影响结果见图2a 和表2。结果表明,不同质量浓度的样品溶液处理的线虫均显示寿命延长的趋势,特别是200 μg/mL PSPs 治疗组。由图2a 可见,对照组线虫的最长寿命为20 d,而50,100,200 μg/mL PSPs 处理组的最长寿命为24,24,28 d,分别延长了4,4,8 d。在适当生活条件下,对照组平均寿命为(10.58±1.21)d。与对照组相比,高质量浓度PSPs 显著延长线虫平均寿命至(16.82±0.62)d,存活率提高58.98%。100 μg/mL PSPs 组平均寿命为(14.38±1.93)d,与对照组相比存活率增加35.92%。50 μg/mL PSPs 组存活率增加相对较低,为20.13%,平均寿命为(12.71±0.90)d。综上所述,与对照组相比,PSPs 对线虫寿命的影响存在显著性差异且呈剂量依赖性。
表2 不同质量浓度PSPs 对线虫平均寿命的影响(±s,n=3)Table 2 Effects of different mass concentrations of PSPs on the average lifespan of C.elegans (±s,n=3)

表2 不同质量浓度PSPs 对线虫平均寿命的影响(±s,n=3)Table 2 Effects of different mass concentrations of PSPs on the average lifespan of C.elegans (±s,n=3)
注:与对照组相比,*.P<0.05;**.P<0.01。
寿命延长率/%对照组 空白 10.58±1.21-50 12.71±0.90 20.13 PSPs 组 100 14.38±1.93* 35.92 200 16.82±0.62** 58.98组别 剂量/μg·mL-1平均寿命/d
2.3 PSPs 对秀丽隐杆线虫活力及运动能力的影响
机体衰老会伴随着各项生理机能的衰退,线虫运动能力也会衰退。本试验以线虫是否做连续头臂摆动运动为衡量标准,在线虫生活的第5,10天评估PSPs 对线虫的运动能力的影响。如图2b所示,PSPs 干预后的第5 天,与对照组相比低剂量PSPs 试验组线虫的运动能力未见明显差异,饲喂200 μg/mL PSPs 的线虫则表现出较强的运动能力。值得注意的是直至第10 天,虽然随着生命周期的进展线虫的代谢能力有所降低,但与对照组相比,治疗组线虫运动能力仍然较强。
如图2c所示,PSPs 处理后,利用FDA 染液在荧光显微镜下观察虫体。因FDA 本身特性,进入虫体后细胞具有活性而发出绿色荧光,与对照组相比,饲喂PSPs 对线虫活力影响不显著,间接提示PSPs 对虫体无任何毒害作用。
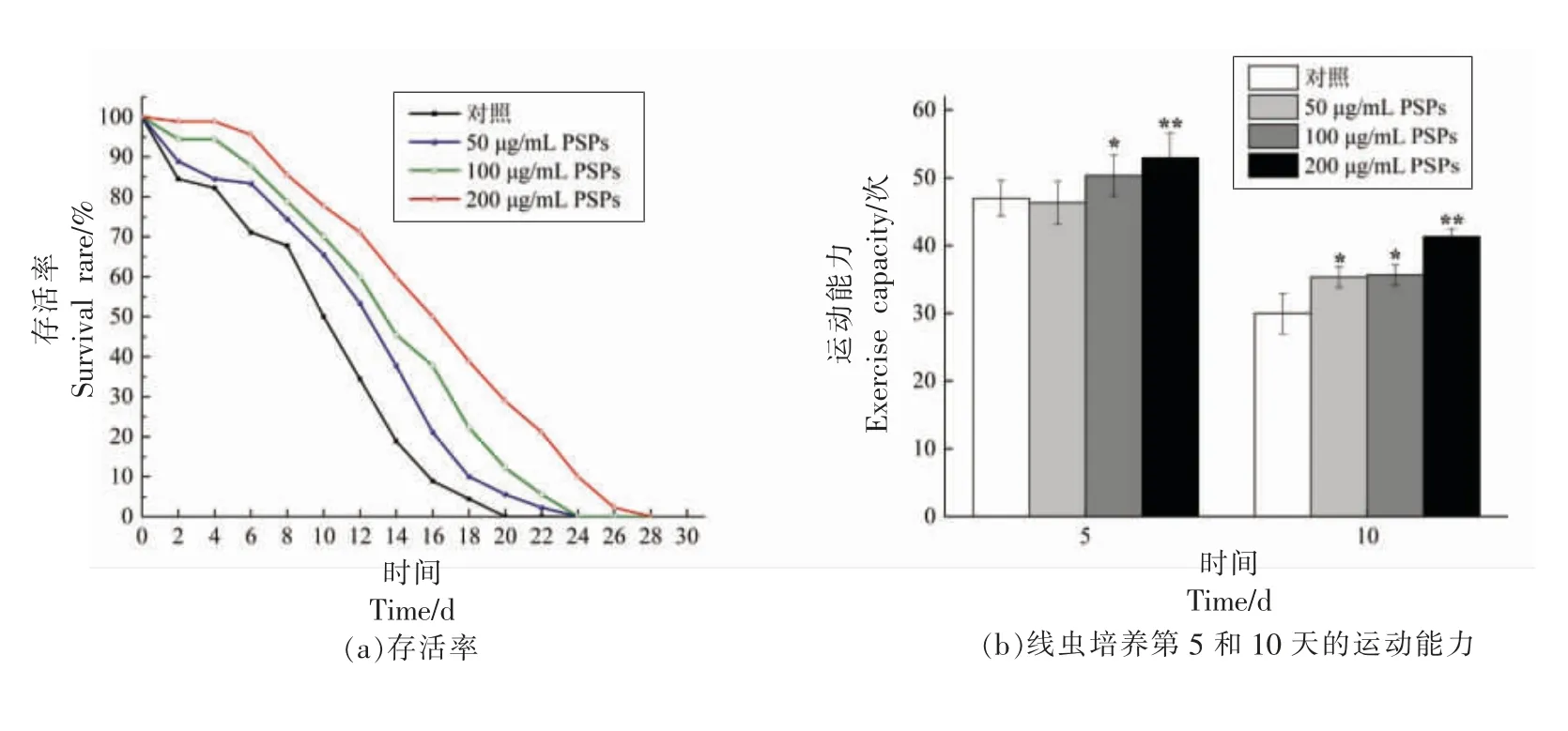

图2 PSPs 对线虫寿命、运动能力以及活力的影响Fig.2 The effect of PSPs on life span,exercise capacity and vitality of C.elegans
2.4 PSPs 对延长线虫氧化应激抵抗力的影响
H2O2通过诱导细胞产生自由基诱发细胞氧化损伤,进而破坏机体代谢功能。图3表明,在H2O2急性应激试验中,与对照组相比,经不同质量浓度PSPs 处理的线虫暴露于H2O2环境中的生存能力显著提高(P<0.05),并呈剂量依赖性。50,100 μg/mL 和200 μg/mL PSPs 干预后,线虫的平均寿命分别为(4.20±0.24),(4.56±0.17),(4.67±0.29)h,寿命相对延长率为14.44%,24.25%和27.25%(表3),表明在急性氧化应激下,PSPs 对线虫有显著保护作用(P<0.05),可有效提高线虫氧化应激耐受性,且200 μg/mL 时效果最佳。
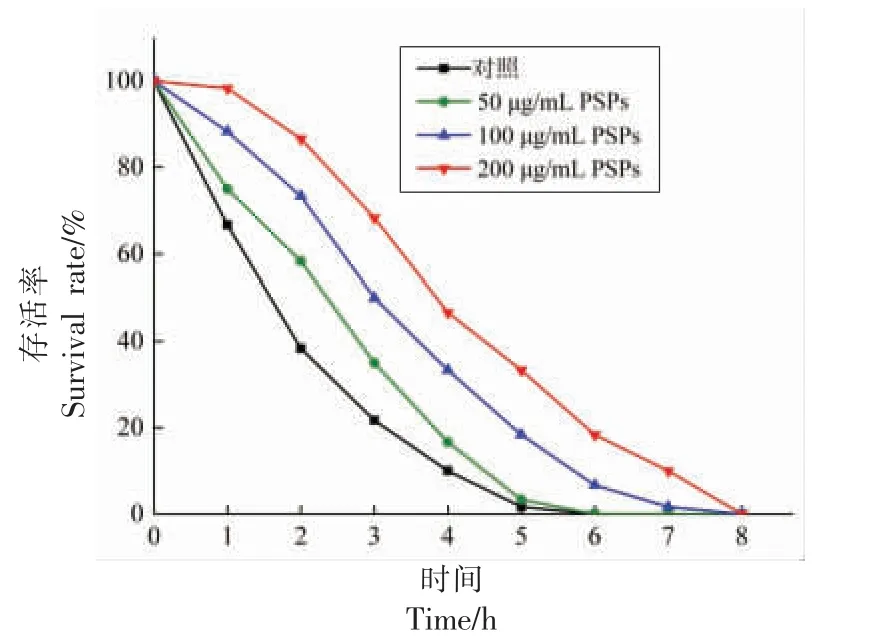
图3 急性氧化应激下PSPs 对线虫寿命的影响Fig.3 Effect of PSPs on life span of C.elegans under acute oxidative stress
表3 急性氧化应激下不同质量浓度PSPs 对线虫的影响(±s,n=3)Table 3 Effect of different mass concentrations of PSPs on C.elegans under acute oxidative stress (±s,n=3)
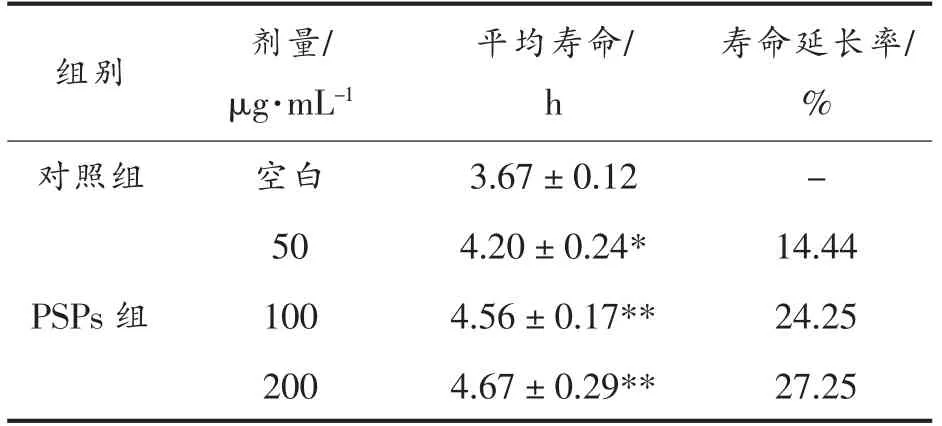
表3 急性氧化应激下不同质量浓度PSPs 对线虫的影响(±s,n=3)Table 3 Effect of different mass concentrations of PSPs on C.elegans under acute oxidative stress (±s,n=3)
注:与对照组相比,* 代表P<0.05;** 代表P<0.01。
寿命延长率/%对照组 空白 3.67±0.12-50 4.20±0.24* 14.44 PSPs 组 100 4.56±0.17** 24.25 200 4.67±0.29** 27.25组别 剂量/μg·mL-1平均寿命/h
2.5 PSPs 降低体内ROS 含量
随着机体的衰老,线虫各项代谢功能下降,脂褐素大量积累在细胞内造成细胞损伤。由图4a 可见,与对照组相比,用PSPs 处理后线虫脂褐素水平显著降低,表明PSPs 可改善年龄色素沉积,缓解细胞的衰老。活性氧ROS 在正常生理代谢过程中维持稳态,在氧化剂的诱导下,机体自由基反应失衡,大量的自由基会聚集在细胞内,因此限制线虫寿命的主要因素是ROS 积累所引起的氧化应激反应[25-26]。如图4b所示,与对照组相比,PSPs 可改善体内ROS 水平,随着PSPs 质量浓度的增加,作用效果显著。

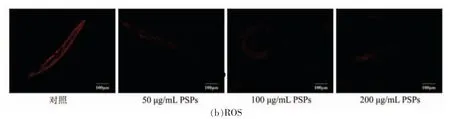
图4 PSPs 对线虫脂褐素和ROS 影响Fig.4 Effect of PSPs on lipofuscin and ROS levels in C.elegans
2.6 PSPs 提高线虫体内SOD、CAT 的活性
细胞发生氧化应激进而发展到细胞损伤等一系列级联反应,往往是由抗氧化酶类物质难以清除过量的自由基所致,在这一过程中,SOD 和CAT发挥了重要作用。如图5a 和b所示,与对照组相比,PSPs 显著增强CAT 和SOD 的活力,其中100 μg/mL PSPs 和200 μg/mL PSPs 组CAT 活性分别增加1.55 倍和1.61 倍。同时SOD 活性也分别增加了1.50 和1.78 倍。结果表明PSPs 通过促进线虫体内抗氧化酶表达清除自由基。
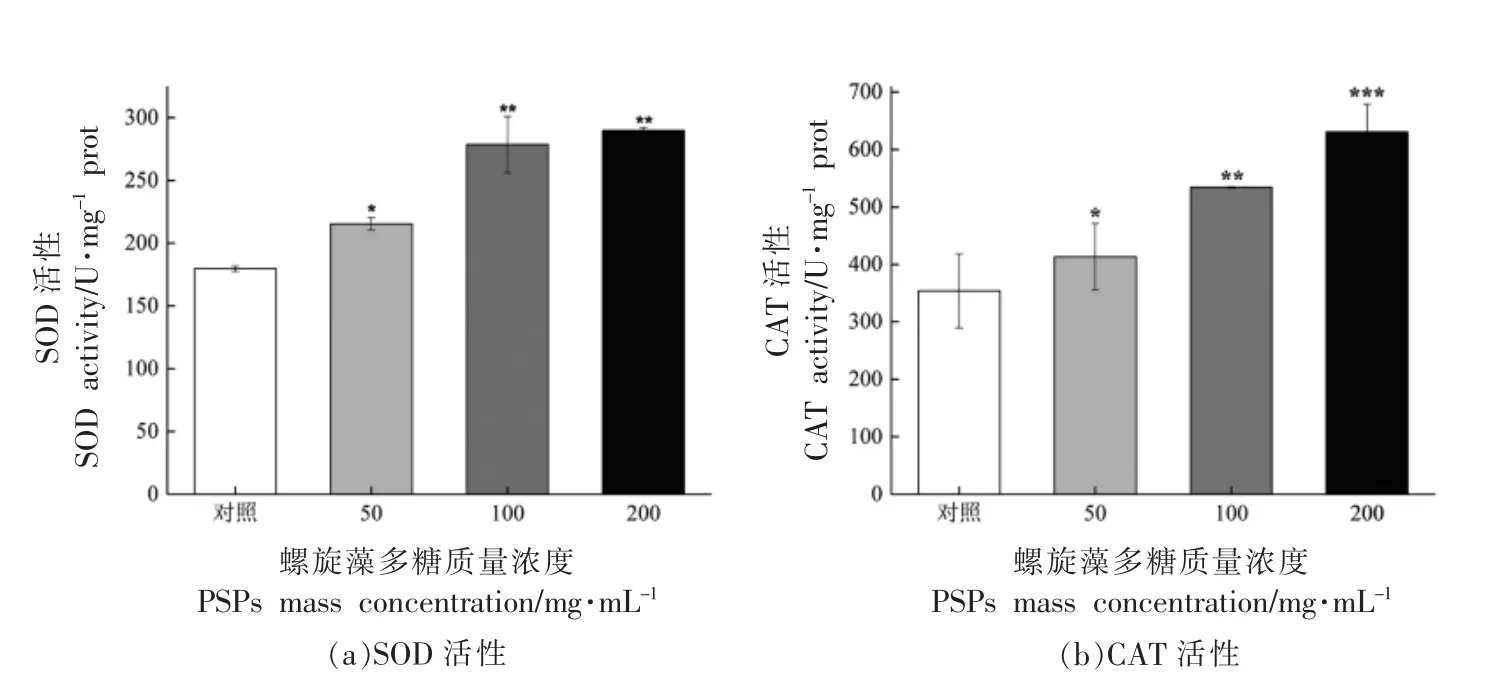
图5 PSPs 抗氧化酶对秀丽隐杆线虫的影响Fig.5 Effect of PSPs antioxidant enzymes on C.elegans
2.7 PSPs 对线虫IIS 信号通路基因表达量的影响
以上试验表明,PSPs 介导了线虫抗氧化及寿命的延长。为进一步检测PSPs 对线虫体内抗氧化分子机制,利用qRT-PCR 分析PSPs 对IIS 信号通路上转录因子Daf-16 和Skn-1 以及下游基因的影响。结果如图6所示,相比于对照组,试验组线虫体内转录因子Daf-16 的转录水平显著增强,其下游靶基因sod-3 和clt-2 转录水平极显著增强。Skn-1 和长寿基因sir2.1 是线虫体内寿命调节的重要调控因子,这两个基因转录水平均显著提高(P<0.05),且呈剂量依赖性,在200 μg/mL PSPs处理下,Skn-1 和sir2.1 的表达分别增加1.88 倍和1.95 倍。这几个胰岛素信号通路上关键因子表达的提高,表明PSPs 是通过上调抗氧化相关基因的表达及寿命调控因子水平,提高线虫抵抗氧化应激及延缓衰老的能力。

图6 PSPs 对胰岛素信号通路基因转录水平的影响Fig.6 The effect of PSPs on the transcription level of insulin signaling pathway genes
3 讨论
随着年龄的增长,细胞受到氧化损伤而引起其抗氧化功能紊乱。氧化应激在衰老相关疾病发作中的作用已有文献记载,抗氧化剂被认为能够减弱或预防衰老所带来的影响[27]。PSPs 是一种具有多种生物学活性的天然产物,具有强大的抗氧化能力。线虫能够调节细胞抗逆性和新陈代谢,符合衰老的自由基理论,被广泛用作研究氧化应激和衰老的模式生物[28]。Li 等[29]研究表明,连翘花色素通过提升线虫体内SOD 和CAT 酶活性以及上调寿命相关基因的表达来抵抗氧化应激。H2O2介导下细胞会产生大量的ROS,从而加快虫体组织损伤,缩短寿命;细胞受到氧化剂的诱导,会发生过氧化反应,造成组织损伤甚至细胞凋亡,为维持机体正常代谢活动,生物体在长期的进化过程中形成了能够特异性抑制机体氧化损伤的抗氧化体系,主要包括抗氧化酶和非酶类抗氧化剂。研究发现,天然多糖通过作用于部分信号通路分子调控机体抗氧化[30]。作者通过胰岛素信号通路来验证PSP 对机体氧化应激的影响。
IIS 信号通路是在分子水平上研究衰老模型的保守信号通路[31],如图7所示。Daf-16 是线虫体内参与提高应激抵抗以及代谢基因表达的重要转录因子,可在一定程度上延长寿命。通常在哺乳动物体内,胰岛素信号通路的激活引起一系列磷酸化级联反应,最终导致FOXOS/daf-16 核转录因子排出细胞核失活[32]。本研究表明,PSPs 处理后,线虫体内daf-16 的表达量显著升高(P<0.05),且其下游靶基因sod-3 和clt-1 的mRNA 相对表达量极显著升高 (P<0.01)(图6),表明PSPs 可促进daf-16 激活并上调下游基因的表达,进而提升线虫对氧化应激的抵抗力。Zhang 等[33]研究表明,紫山药多糖通过作用胰岛素信号通路使daf-16 进入细胞核,调控细胞核内抗氧化酶基因的表达,从而增强细胞的抗氧化能力并延长线虫的寿命。
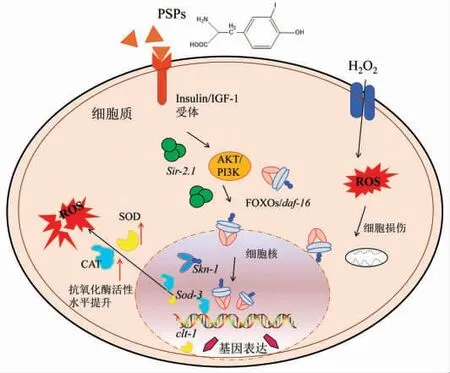
图7 PSPs 通过Insulin/IGF-1 通路在秀丽隐杆线虫中抗氧化功能的假想机理图Fig.7 Hypothetical mechanism diagram of PSPs antioxidant function in C.elegans via the Insulin/IGF-1 pathway
Sir-2.1(沉默信息调节蛋白)是一类进化相对保守的蛋白因子,sir-2.1 可通过抑制AKT/PI3K的磷酸化及基因表达,促使FOXOS/daf-16 转录因子的表达,发生核转位并与下游调控抗氧化酶基因相结合,上调其表达,从而清除ROS,增强机体抵抗氧化应激的能力[34]。本研究结果显示,PSPs 处理后,与空白组相比sir-2.1 转录水平显著升高(P<0.01)。在线虫体内,skn-1 是调控机体氧化应激的重要转录因子,同样受IIS 信号通路的调控。本研究结果表明,PSPs 能够显著提高skn-1 mRNA 的表达水平(P<0.01)。推测PSPs 对线虫氧化应激抵抗力的提高以及寿命的延长,是通过调控sir-2.1,daf-16 和skn-1 的表达作用的结果。
4 结论
总之,线虫经不同质量浓度的PSPs 干预后,其寿命、运动能力和内源性抗氧化水平提高。此外,通过对衰老相关信号通路转录因子表达水平的测定,揭示了PSPs 提高线虫氧化应激的抵抗力和延长寿命的潜在分子机制,为PSPs 抗氧化的研究提供了理论依据,并为未来PSPs 作为抗氧化剂的开发应用提供数据支撑。线虫氧化应激及寿命的调控机制较为复杂,且PSPs 为水溶性大分子活性物质,本试验中并没有将提取的PSPs 进行分离,具体何种组分对线虫氧化应激发挥作用还不得而知。后续试验过程中应重点探究PSPs 不同组分对线虫的影响,整合多组学技术挖掘PSPs 的抗氧化、抗衰老功能的新型作用靶点。

