枸杞叶黄酮对胰脂肪酶活性的抑制作用
廖家乐,方 甜,范艳丽
(宁夏大学食品与葡萄酒学院 银川 750021)
肥胖症的形成,很大程度上是由不健康的饮食习惯和生活方式引起的,特别是长期过量摄入高脂膳食。肥胖不仅会影响形体外观审美,而且容易引起异常的生理代谢,从而引发一系列的生理、心理和社会问题[1]。肥胖是导致许多慢性疾病发生的关键诱因,如高血压、高血脂、糖尿病、心脑血管疾病以及癌症等[2-4]。肠道脂肪酶在人体脂肪消化中发挥着重要作用,其中胰脂肪酶是水解脂肪的关键酶,负责肠腔内50%~70%总膳食脂肪的水解和吸收[5-6]。胰脂肪酶能将膳食中的油脂分解为小分子的甘油和脂肪酸,人体可以吸收并参与新陈代谢。抑制肥胖的有效方法是通过抑制小肠中的胰脂肪酶活性,使胰脂肪酶丧失部分分解能力,从源头上控制脂肪进入血液,从而降低脂肪的消化和吸收,起到减肥降脂的作用。目前,市面上许多减肥药虽疗效显著但副作用明显,如奥利司它会导致人体出现胃肠排气增多、脂肪泻等不良反应[7]。从植物界寻找高效、低毒、低副作用的胰脂肪酶抑制剂,具有着重要意义。
枸杞叶,是茄科(Solanaceae)枸杞属(Lycium)植物枸杞的嫩叶。枸杞叶富含生物活性成分和微量元素,广泛应用于食品工业。在中国以及东南亚和北美洲地区,枸杞叶被用作功能性茶、药用蔬菜和草药。过去枸杞叶并未受到重视,多用于土壤肥料和饲料配料,未能充分利用其价值,这严重阻碍了枸杞叶的应用与发展[8]。研究表明,枸杞叶中富含黄酮类化合物,其含量要远高于果实[9]。目前国内外学者在类黄酮化合物抑制胰脂肪酶活性方面做了大量研究[10-13],证实了从植物中提取出的类黄酮,具有胰脂肪酶活性抑制的作用。然而,枸杞叶黄酮对胰脂肪酶的作用却未见报道。
本文以宁夏地区枸杞叶黄酮提取物为研究对象,采用酶动力学法研究枸杞叶黄酮(Lycium barbarum leaves flavonoids,LBLF) 对胰脂肪酶的抑制作用,借助紫外、荧光和红外光谱探讨枸杞叶黄酮与胰脂肪酶相互作用的机理。本试验结果为枸杞叶黄酮作为功能性食品原料和潜在替代药物的开发提供了理论依据。
1 材料与方法
1.1 材料与试剂
枸杞叶茶购于银川育新枸杞有限公司;枸杞叶黄酮:实验室自制,总黄酮含量83.0%(以芦丁为标准品计算)。
芦丁标准品(纯度≥98%),上海源叶生物公司;D101 大孔树脂,安徽三星树脂科技公司;猪胰脂肪酶(Type Ⅱ)、三羟甲基氨基甲烷(Tris),美国SIGMA 公司;棕榈酸对硝基苯酯 (p-Nitrophenyl palmitate,p-NPP),麦克林生物公司;对硝基苯酚、异丙醇、盐酸、氯化钙、氯化钠、二甲基亚砜(DMSO)、曲拉通X-100、阿拉伯树胶粉等其它试剂均为国产分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
ME203E/02、AL104 电子天平,梅特勒-托利多公司;RE-52 旋转蒸发仪,上海亚荣仪器公司;DF-2 数显磁力搅拌器,常州诺基仪器公司;BSOWX2200 卧式智能精密型摇床,上海博迅医疗设备厂;F-7000 荧光分光光度计,日本日立公司;UV-1800 紫外分光光度计,日本岛津公司;Spectrum Two 傅里叶变换红外光谱仪、UATR Two 衰减全放射附件,美国PerkinElmer 公司;JDG-0.2真空冻干实验机,兰州科近真空冻干技术公司;ST70-2 微孔板恒温振荡器,杭州米欧仪器公司;Multiskan Mk3 全波长酶标仪,赛默飞世儿仪器公司;TDL-5-A 离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 枸杞叶类黄酮化合物的制备
1.3.1.1 提取 枸杞叶粉碎过筛,按照料液比1∶70,于70 ℃下用70%乙醇磁力搅拌提取2 h,重复提取1 次,合并提取液,5 000 r/min 下离心取上清液,55 ℃旋转蒸发,浓缩至一定体积后加入石油醚进行脱除叶绿素和脱脂处理。分液弃除石油醚层,保留上层。旋转蒸发,冷冻干燥,得枸杞叶黄酮粗提物。
1.3.1.2 纯化 准确称取预处理过的D101 大孔树脂2.0 g 和样品0.375 g (超纯水作溶剂),加入250 mL 具塞三角瓶中,室温置于摇床上振荡吸附24 h。将充分吸附后的树脂过滤,置于250 mL 三角瓶中,加入100 mL 70%的乙醇,相同条件下解吸24 h,经旋转蒸发浓缩,冷冻干燥得到纯化产物。
1.3.2 总黄酮含量的测定
1.3.2.1 芦丁标准曲线的绘制 采用亚硝酸钠-硝酸铝比色法测定总黄酮含量[14],于波长510 nm处测定吸光值,以芦丁质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线。回归方程:Y=7.0747X+0.0899,R2=0.9992。
1.3.2.2 样品测定 准确称取一定质量样品,配成一定浓度的样液于比色管中测定样液吸光值。根据标准曲线计算出黄酮的质量浓度,按公式(1)计算总黄酮含量。

式中,C——为通过标准曲线得到的样品溶液中总黄酮的质量浓度,mg/mL;V——样品溶液体积,mL;M——称取的样品质量,g。
1.3.3 枸杞叶黄酮对胰脂肪酶活性的影响
1.3.3.1 枸杞叶黄酮抑制胰脂肪酶活性的测定
1)溶液的配制 准确称取3.0 g Tris,0.731 g NaCl,0.555 g CaCl2,溶于超纯水,并定容至500 mL,盐酸调pH 值为8.0,得50 mmol/L Tris-HCI缓冲液;称取0.5 g 胰脂肪酶,溶于50 mL Tris-HCI 缓冲液,5 000 r/min 离心10 min,分离上清液,得10 mg/mL 胰脂肪酶储备液;准确称取3.02 mg p-NPP,用缓冲溶液定容至10 mL,得0.8 mmol/L 的p-NPP 溶液 (含质量分数0.5%曲拉通X-100,质量分数0.1%阿拉伯树胶粉和体积分数10%异丙醇)。
2)胰脂肪酶活性的测定 参照Franco 等[15]的方法并作略微改进。取40 μL 50 mmol·L-1Tris-HCI 缓冲液、20 μL 一定浓度的枸杞叶黄酮溶液和60 L 10 mg/mL 的胰脂肪酶溶液加入96孔板中混匀,37 ℃温育10 min 后,加入80 μL p-NPP 底物启动反应,37 ℃温育30 min,酶标仪405 nm 波长处测定吸光值。对照组用缓冲液替代酶液,每组试验重复3 次。反应体系见表1。胰脂肪酶活性抑制率计算见公式(2)。

表1 胰脂酶活性测定反应体系Table 1 Reaction system for determination of pancreatic lipase activity

式中,A——对照试验组吸光值;B——样品试验组吸光值;a——对照空白组吸光值;b——样品空白组吸光值。
1.3.3.2 枸杞叶黄酮对胰脂肪酶半抑制浓度(IC50)和抑制作用类型的确定 以不同质量浓度的枸杞叶黄酮为横坐标,胰脂酶活性抑制率为纵坐标,绘制抑制曲线图并进行线性回归拟合后求得半抑制浓度(IC50)。
固定底物浓度不变(0.8 mmol/L),分别测定添加0.5 mg/mL 和不添加酶抑制剂时,不同酶浓度下的反应初速度。以初速度对酶质量浓度作图。由图判断抑制类型(可逆或不可逆),添加抑制剂会得到一条通过原点且斜率降低的直线,可确定为可逆抑制作用类型[16]。
固定酶液质量浓度为10 mg/mL,枸杞叶黄酮溶液质量浓度为0,0.5,1 mg/mL,分别测定p-NPP浓度为8,4,2,1 mmol/L 时的酶促反应初速度,反应体系同1.3.3.1 节。以反应速率的倒数(1/v)对底物浓度的倒数(1/[S])作图,得到Lineweaver-Burk双倒数曲线,确定反应最大速率(Vmax)、米氏常数(Km)以及抑制常数(Ki)。曲线与X 轴的截距=-1/Km,与Y 轴截距=1/Vmax;抑制常数(Ki)由式(3)求得。根据Vmax和Km的变化可判断抑制类型,非竞争性抑制为Km不变,Vmax变小;竞争性抑制为Km增大,Vmax不变[17]。每组试验重复3 次,对照组用缓冲液替代。酶促反应速率(v)为反应体系吸光值(A)与反应时间的比值。
枸杞叶黄酮与胰脂肪酶相互作用的非竞争性抑制动力学方程见式(3):

式中,V*max——添加酶抑制剂的最大反应速率,min-1;Vmax——不添加酶抑制剂的最大反应速率min-1;[I]——抑制剂的质量浓度,mg/mL;Ki——抑制常数,mg/mL。
1.3.4 枸杞叶黄酮对胰脂肪酶紫外光谱测定 根据张永军[18]的方法,准确移取3 mL 酶液(1 mg/mL)和200 μL 不同质量浓度的样品溶液,常温下混匀静置5 min,得到质量浓度为0,6.25×10-3,1.56×10-2,3.13×10-2,4.69×10-2,6.25×10-2mg/mL 的样液,分别移取2 mL 于石英比色皿中,放入紫外分光光度计中测定(扫描250~400 nm 的波长)。
1.3.5 枸杞叶黄酮与胰脂肪酶相互作用的荧光光谱分析
1.3.5.1 荧光光谱的测定 根据范金波等[19]的方法,准确移取3 mL 酶液(1 mg/mL)和50 μL 不同质量浓度的样品溶液,使溶液总体积达到4 mL,得到浓度为0,1.25×10-3,3.125×10-3,6.25×10-3,1.25×10-2,2.50×10-2,5.00×10-2mg/mL 的样液,分别在20 ℃和37 ℃条件下混匀静置10 min,分别移取2 mL 于荧光比色皿中,放入荧光光度计中测定(激发波长为290 nm,发射波长扫描范围300~500 nm,狭缝宽均为5 nm)。
1.3.5.2 枸杞叶黄酮对胰脂肪酶的荧光猝灭机理研究 假设LBLF 对胰脂酶的猝灭类型为动态猝灭,则符合Stern-Volmer 方程:

式中,F0——不加酶抑制剂时酶液的荧光强度;F——加酶抑制剂时酶液的荧光强度;Ksv——动态猝灭常数,L/mol;[Q]——LBLF 摩尔浓度,mol/L;Kq——双分 子碰撞 过 程猝灭 常数,L/(mol·s);τ0——无抑制剂时荧光分子的平均寿命(生物大分子平均寿命为10-8s),s。
1.3.5.3 枸杞叶黄酮与胰脂肪酶相互作用的作用力类型和热力学参数的确定 根据式 (6),作lg(F0-F)/F)关于lg[Q]的双对数曲线,分别求得293 K 和310 K 下LBLF 与胰脂肪酶结合位点数(n)以及结合常数(Ka)。

293 K(T1)和310 K(T2)下的热力学参数,焓变(△H)、熵变(△S)和吉布斯自由能变(△G)由式(7)、(8)、(9)计算得到,并由此可知二者相互作用力类型。

式中,R——气体常数 (8.314),J/(mol·K);Ka1——293 K 的结合常数,L/mol;Ka2——310 K下的结合常数,L/mol。
1.3.6 傅里叶衰减全放射红外光谱 (ATR-FTIR)测定 准确移取50 mL 的酶液(10 mg/mL)和称取不同质量的枸杞叶黄酮粉末(0,25,50,100,200,300 mg),混匀,得到质量浓度为0,0.5,1,2,4,6 mg/L 的样液,反应液置于摇床(37 ℃,160 r/min)上恒温振荡反应30 min,取出进行冷冻干燥。移取适量样品置于ATR 附件的晶体上,拧紧螺旋压实;光谱扫描范围:4 000~400 cm-1;扫描次数:32次;分辨率:4 cm-1;每个样本采集3 次,测定之前扣除空气基底。
2.2.1 气切吸痰 吸痰是清理呼吸道、保持呼吸道通畅的最常用而重要的护理操作[2],也是无菌操作技术,操作时戴一次性无菌手套,并使用一次性无菌吸痰管,或者密闭式吸痰管。操作前后注意医护人员的手卫生,吸痰前听诊患者肺部是否有痰鸣音,观察患者表现:有无烦躁、呼吸困难或血氧饱和度降低等情况或呼吸机报警为气道压力过高时,需及时吸痰。吸痰操作时动作轻柔,吸痰中注意:插入吸痰管时阻断负压,防止损伤的气管黏膜,使其充血、水肿、上皮组织脱落、纤毛的丢失,以及气道内肉芽肿的形成,否则会增加了患者气道黏膜的出血和感染的机会[3];吸痰前后给予纯氧吸入,防止供氧不足或吸痰后肺不张引起患者低氧血症。
1.3.7 数据处理及统计分析 每组试验3 次重复,结果用平均值±标准差表示,采用Excel 2019作图。样品的红外图谱通过PeakFit 4.12 在谱带范围内(酰胺Ⅰ带)校正基线、区分重叠子峰,二阶高斯拟合,根据峰面积计算酶蛋白的二级结构。酰胺一带二阶导数图,由Origin 8.0 作归一化并二阶求导得到。
2 结果与讨论
2.1 枸杞叶黄酮对胰脂肪酶的抑制作用
课题组前期试验结果显示[20],纯化后的枸杞叶黄酮的总含量为809.89 mg/g,进一步借助HPLC 测得纯化产物主要为芦丁、槲皮素、绿原酸、山奈酚等化合物,其中芦丁占检出物比例的70%以上。经检测,本试验中所使用的实验室自制枸杞叶黄酮的总含量为83.0%。
由图1可知,随着LBLF 质量浓度的增大,LBLF 对胰脂肪酶的抑制率也逐渐增大。通过多元线性回归拟合曲线,求得LBLF 对胰脂酶的半抑制质量浓度(IC50)为(0.910±0.008) mg/mL。高畅等[21]发现,黄酮类化合物因提取溶剂和方法不同对胰脂肪酶的抑制作用是不同的,其中桑叶黄酮纯化产物对胰脂肪酶的半抑制浓度(IC50)为1.19 mg/mL,抑制作用类型为非竞争性抑制;张忠[22]发现,市售的茶多酚能显著抑制胰脂肪酶活性,半数抑制浓度(IC50)为1.16 mg/mL,抑制类型为非竞争性抑制;杨鹏等[23]发现,荞麦黄酮醇提物是一种胰脂肪酶的竞争性抑制剂,半数抑制浓度(IC50)为2.53 mg/mL,而阳性对照奥利司他的半抑制浓度为0.47 mg/mL;范金波等[24]发现,咖啡酸能非竞争性抑制胰脂肪酶活性,半数抑制浓度(IC50)为0.88 mg/mL。相比于茶多酚和桑叶黄酮,枸杞叶黄酮对胰脂酶的抑制效果虽更好,但效果不如咖啡酸,这可能由于咖啡酸是纯度更高的单体化合物。目前,枸杞叶黄酮抑制胰脂酶的效果虽比不上化学合成药物奥利司他,但枸杞叶黄酮作为天然活性产物,不仅有着广泛的生物学功能,而且对人体有较低的毒副作用。

图1 枸杞叶黄酮对胰脂肪酶的抑制效果Fig.1 The inhibitory effect of Lycium barbarum leaves flavonoids on pancreatic lipase
2.2 枸杞叶黄酮对胰脂肪酶的抑制作用类型
由图2可知,抑制剂组和无抑制剂组拟合得到的曲线都通过原点,且添加抑制剂后,曲线斜率降低,说明枸杞叶黄酮对胰脂肪酶的抑制作用类型为可逆抑制。枸杞叶黄酮能与酶以非共价键可逆结合而引起酶活力的丧失或降低,影响酶催化效率。
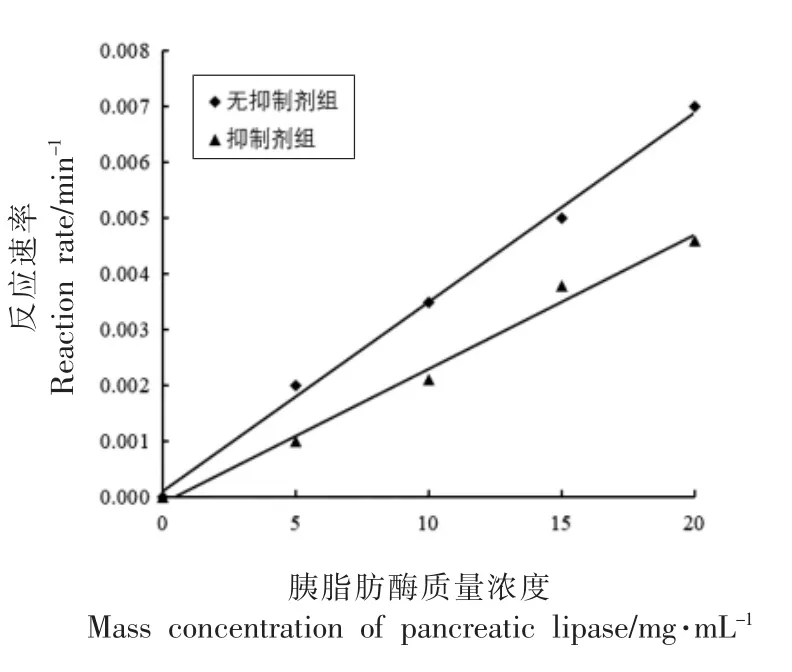
图2 枸杞叶黄酮对胰脂肪酶的抑制作用类型Fig.2 Types of inhibitory effects of Lycium barbarum leaves flavonoids on pancreatic lipase
可逆抑制类型分为非竞争性、反竞争性以及竞争性抑制3 种。非竞争性抑制典型特征为Km不变,Vmax变小。由图3可知,在底物浓度为1~8 mmol/L 范围内,通过绘制不同质量浓度抑制剂组和空白对照组的Lineweaver-Burk 曲线发现,抑制剂和无抑制剂组曲线相交于横轴,且直线在横轴的截距保持不变,斜率变大,即Km不变,Vmax变小,表明枸杞叶黄酮对胰脂肪酶的抑制作用类型为非竞争性抑制。表2为通过计算得到的酶动力学参数和半抑制质量浓度。
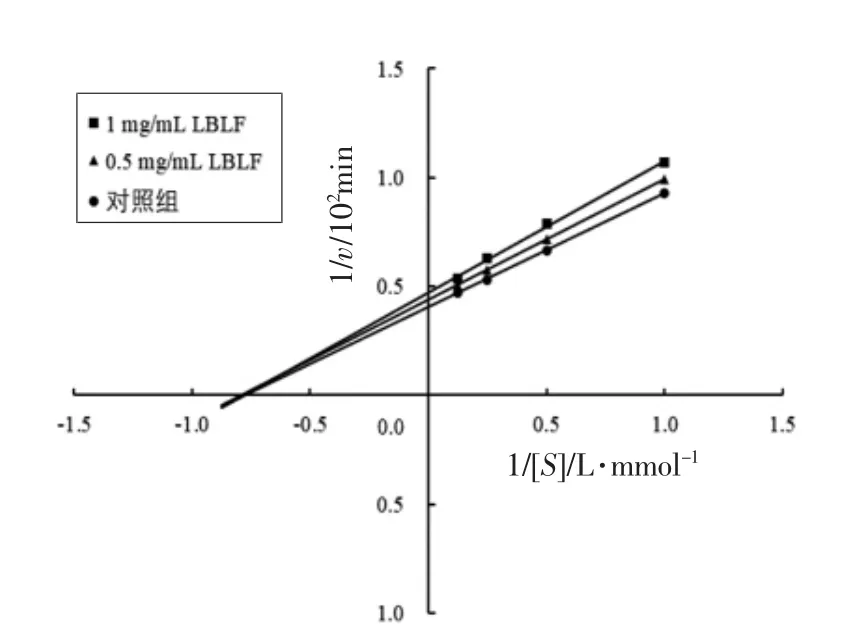
图3 枸杞叶黄酮对胰脂肪酶的可逆抑制Lineweaver-Burk 曲线Fig.3 Lineweaver-Burk curve of reversible inhibition of Lycium barbarum leaves flavonoids on pancreatic lipase

表2 枸杞叶黄酮抑制胰脂肪酶的半抑制浓度和动力学参数Table 2 The half inhibitory concentration and kinetic parameters of Lycium barbarum leaves flavonoidsin inhibiting pancreatic lipase
2.3 枸杞叶黄酮与胰脂肪酶相互作用的紫外光谱分析
由图4可知,胰脂肪酶在波长260 nm 处有最大吸收峰,这是由于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的存在造成的。通过观察紫外图谱吸收峰强度和波长的变化,可判断LBLF 与胰脂酶相互作用程度以及芳香族氨基酸微环境的状态,而所处微环境的变化会引起酶构象的改变。图4表明,加入不同质量浓度LBLF 后观察到胰脂酶紫外吸收光谱发生变化,随着LBLF 质量浓度增大,吸收峰增强并发生红移(260 nm→273 nm),然而5个样品间没有显著差异。上述结果说明,添加LBLF 后两者相互作用程度加强,胰脂酶芳香族氨基酸残基的微环境和酶构象发生改变,导致酶活性降低,这可能是LBLF 的存在导致胰脂酶结构发生变化,更多芳香族氨基酸暴露所致[25]。

图4 枸杞叶黄酮与胰脂肪酶相互作用的紫外光谱Fig.4 Ultraviolet spectra of the interaction between Lycium barbarum leaves flavonoids and pancreatic lipase
2.4 枸杞叶黄酮与胰脂肪酶相互作用的荧光光谱结果分析
2.4.1 枸杞叶黄酮和胰脂肪酶相互作用的荧光发射光谱 胰脂肪酶中由于色氨酸 (Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的存在而具有内源荧光,其中对荧光贡献最大的是色氨酸,其次是酪氨酸,苯丙氨酸荧光最弱,而酪氨酸和色氨酸主要在波长313 nm 和350 nm 左右出现荧光峰[26]。图5表明,胰脂肪酶的最大发射波长为351 nm,随着LBLF 质量浓度的增大,其荧光强度呈现规律性的降低并发生红移(351 nm→354 nm),说明对胰脂酶荧光贡献最大的是色氨酸,且酶蛋白三级结构发生了一定程度的变化;小分子LBLF 是胰脂肪酶的荧光猝灭剂,并存在一定的剂量依赖效应。荧光峰发生移位主要有两种说法:1)3 种芳香氨基酸疏水性较高并聚集在一起,其所处环境极性的改变会导致红移或蓝移,LBLF 可以将色氨酸的微环境变为更亲水的环境,从而改变酶蛋白的构象和活性[27-30]。2)酶是多畴结构,小分子物质LBLF可以进入酶蛋白的缝隙和空穴,从而改变酶的构象[31]。
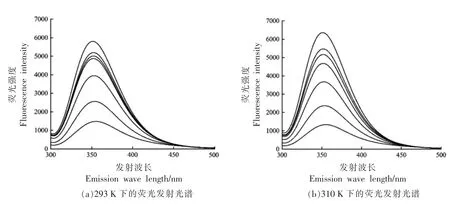
图5 枸杞叶黄酮与胰脂肪酶相互作用的荧光发射光谱Fig.5 Fluorescence emission spectra of the interaction between Lycium barbarum leaves flavonoids and pancrelipase
2.4.2 枸杞叶黄酮对胰脂肪酶的荧光猝灭机理荧光猝灭类型分为静态猝灭、动态猝灭以及混合猝灭,其中动态和静态猝灭的Stern-Volmer 曲线均呈线性,混合猝灭曲线朝纵轴向上弯曲[32]。图6可知,随温度升高,曲线斜率增大,且两条曲线随抑制剂质量浓度增大朝纵轴向上弯曲,初步确定LBLF 对胰脂酶的荧光猝灭类型是以动态猝灭为主的混合型猝灭。由图6和表3可知,抑制剂浓度较低时,两条曲线均呈线性关系,温度升高,曲线斜率增大,Ksv增大,其中293 K 和310 K 时Kq值分别为1.94×1012L/(mol·s) 和3.15×1012L/(mol·s),Kq值均远高于由碰撞引起的最大猝灭常数【2×1010L/(mol·s)】,进一步说明荧光猝灭类型为混合型,抑制剂在低浓度范围(2×10-6~20×10-6mol/L)内动态猝灭尤为明显。

表3 枸杞叶黄酮(线性浓度范围2×10-6~20×10-6 mol/L)猝灭胰脂肪酶荧光的Stern-Volmer 方程和猝灭常数Table 3 Stern-Volmer equation and quenching constant of Lycium barbarum leaves flavonoids(within a linear concentration range of 2×10-6~20×10-6 mol/L) for quenching pancrelipase fluorescence
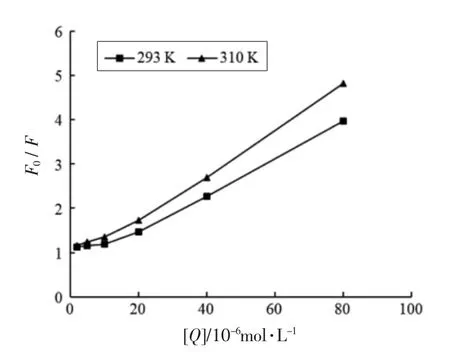
图6 枸杞叶黄酮猝灭胰脂肪酶荧光的Stern-Volmer 曲线Fig.6 Stern-Volmer curve of Lycium barbarum leaves flavonoids quenching pancrelipase fluorescence
2.4.3 枸杞叶黄酮与胰脂肪酶的结合常数(Ka)及热力学参数、作用力类型 表4说明,温度升高,结合常数和位点数都增大,该结合反应是吸热反应;不同温度下结合位点数都趋近于1,说明一个胰脂酶只能结合一个LBLF 分子,升温更有利于结合。

表4 枸杞叶黄酮和胰脂肪酶的结合常数(Ka)和结合位点数(n)Table 4 Binding constant (Ka) and number of binding sites (n) of Lycium barbarum leaves flavonoids and pancrelipase
酚类化合物与酶蛋白的相互作用力类型主要为氢键、范德华力以及疏水相互作用力等非共价键。由表5可知,不同温度下的△G<0,表明该反应能自发进行;△H>0,说明该反应是吸热反应;通过比较△G、△H 和△S 三者的正负关系,可以判断LBLF 与胰脂酶的作用力类型[33]。本研究△H>0、△S>0、△G<0,说明LBLF 与胰脂酶形成的复合物主要靠疏水相互作用力维持。

表5 枸杞叶黄酮和胰脂肪酶的热力学参数Table 5 Thermodynamic parameters of Lycium barbarum leaves flavonoids and pancrelipase
2.5 枸杞叶黄酮与胰脂肪酶相互作用的ATRFTIR 光谱
峰强度和峰位的变化可以作为样品基团或化学键变化的判据,峰强度降低说明样品基团或化学键可能受到损伤,峰位发生偏移说明样品基团或化学键发生改变[34]。
由图7可知,添加不同质量浓度LBLF,胰脂肪酶特征峰位略微改变,且随着LBLF 质量浓度的增大,红外吸收峰强度呈现先升高后降低的趋势,1 mg/mL LBLF 的样品峰强度最高,表明1 mg/mL LBLF 对酶蛋白红外吸收振动化学键的保护作用最佳,同时酶蛋白的二级结构可能发生了一定程度的变化和转化。

图7 枸杞叶黄酮与胰脂肪酶相互作用的红外光谱图及酰胺Ⅰ带拟合二阶导数红外光谱图Fig.7 Infrared spectra of the interaction between LBLF and pancrelipase and the second derivative infrared spectra of amide
二阶导数光谱的峰谷位置对应原光谱的峰尖和肩峰位置。LBLF 处理后胰脂酶谱图的变化不太明显。对原图谱相应谱带进行二阶导处理,将原图谱中细微的差别区分开来,可准确辨别出重叠子峰和强峰的峰尖。
红外光谱是研究蛋白二级结构变化的经典方法,通过分析蛋白质的一组酰胺吸收带,获得酶蛋白基团、二级结构、微环境的变化信息,以确定分子间的作用力变化,其中酰胺Ⅰ带吸收最强,最具有研究价值[35]。酰胺Ⅰ带主要涉及-C=O 和双键的伸缩振动,其中1 600~1 640,1 640~1 650,1 650~1 660,1 660~1 700 cm-1特征峰分别代表β-折叠、无规则卷曲、α-螺旋以及β-转角[36]。由图8可知,β-折叠、无规则卷曲、α-螺旋以及β-转角分别占酶蛋白二级结构的40.0%,29.5%,12.3%和18.4%。随着LBLF 添加量增多,β-转角含量呈现先增高后降低的趋势,含量最高为21.0%;α-螺旋含量由12.3%增加至29.1%;无规则卷曲含量由29.5%减少至17.2%;β-折叠含量由40.0%减少至34.8%。α-螺旋的增加,表明酶蛋白分子内氢键增多,结构凝集;β-折叠的减少,说明酶蛋白分子间氢键减少,蛋白分子由伸展变的聚集,而减少的β-折叠更多地转化为α-螺旋;无规卷曲减少,说明复合物结构倾向于有序化。上述结果表明,添加不同质量浓度的LBLF 一定程度上改变了酶蛋白的二级结构,主要表现为复合物结构变得更为有序,β-折叠向α-螺旋的转化。
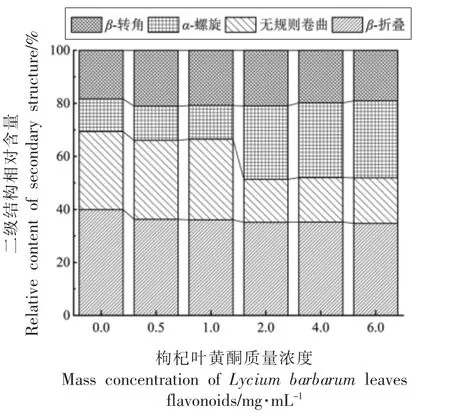
图8 胰脂肪酶蛋白二级结构含量变化Fig.8 Changes in the secondary structure content of pancrelipase protein
3 结论
本文以宁夏地区丰富的枸杞叶资源为试验原料,深入分析了从枸杞叶中提取的类黄酮化合物的酶抑制剂效果。经研究发现,枸杞叶黄酮提取物能显著抑制胰脂肪酶活性,半数抑制浓度为(0.910±0.008)mg/mL,抑制类型为可逆非竞争抑制。枸杞叶黄酮能与胰脂肪酶以疏水相互作用力结合,猝灭酶蛋白内源荧光,改变酶结构和微环境,进而抑制胰脂肪酶活性。本试验的研究结果为阐述枸杞叶黄酮减肥降脂机理提供了一定的理论依据,然而不同溶剂枸杞叶提取物及枸杞叶黄酮单体化合物对胰脂肪酶活性抑制的作用及二者的构效关系还有待进一步的研究。

