MicroRNA-320b抑制PI3K-AKT信号通路调控胃癌细胞系MGC-803和MKN45的增殖作用*
马 彭,章文毅,梅海军,柯 靖
(南通大学附属医院普外科,江苏 226001)
胃癌作为全球第四高发肿瘤,其死亡率高居第二位[1]。胃癌在中国的发生率位居肿瘤第二位,仅次于肺癌[2]。多数胃癌患者在诊断时已晚期,预后较差[3-5]。胃癌发生发展进程复杂,涉及致癌基因和抑癌基因间的相互作用以及多条信号通路的交叉作用,因此寻找与胃癌诊断及发展进程相关的分子,明确其参与胃癌增殖的分子机制,对胃癌的早期诊断和治疗具有重要意义。
MicroRNA(miRNA)是一类小分子非编码RNA,通过转录后调节方式影响靶基因的表达[6]。miRNA可调控多个细胞生物学过程,包括增殖、凋亡、运动和分化[7]。研究表明,miRNA在多种肿瘤中发挥重要作用,许多miRNA可作为胃癌潜在的标记物和治疗靶标[8-10]。miR-320成员包括miR-320a,miR-320b,miR-320c,miR-320d和miR-320e,其中miR-320d和miR-320e仅存在于灵长类和人类[11]。miR-320在多种肿瘤中低表达,包括乳腺癌[12],肝管细胞性肝癌[13],肝细胞癌[14],肺癌[15]和结直肠癌[16]等。在神经胶质瘤和结直肠癌中miR-320b的异常与肿瘤细胞增殖及侵袭力有关[17-18]。
信号通路的激活或抑制在胃癌发生发展中发挥非常重要的作用[19],其中PI3K-AKT信号通路的激活与多种肿瘤的发生发展密切相关[20-21],可促进肿瘤细胞的生长、增殖和转移,抑制凋亡,促血管生成及诱导化疗和放疗抗性[22]。有研究发现miRNA参与调节PI3K-AKT信号通路,如miR-145通过抑制PI3K-AKT的活化而抑制喉鳞状细胞癌的增殖[16],miR-944结合IGF-1R后抑制PI3K-AKT信号通路活化,从而抑制肝癌的发生发展[23],miR-567-PI3KAKT-c-Myc细胞环路参与调节胃癌的发生发展及耐药过程[24]。本研究旨在研究miR-320b在胃癌组织中的表达,探究其是否通过PI3K-AKT信号通路而调节胃癌的发生发展过程。
1 材料与方法
1.1 试剂及细胞株 DMEM培养基(Hyclone公司),胎牛血清(Gibco公司),Trizol提取试剂、cDNA第一链合成试剂盒、实时荧光定量PCR试剂盒、转染试剂Lipofectamine 2000TM(Invitrogen公司),miR-320b mimics、miR-320b inhibitor及阴性对照miRNC(广州锐博生物科技有限公司),CCK-8细胞增殖检测试剂盒(Biosharp公司),Annexin V-FITC/PI细胞凋亡检测试剂盒(BD Bioscience),5’-溴-2’-脱氧尿嘧啶(BrdU)标记物(Sigma公司),小鼠抗人BrdU抗体(货号:ab8152,Abcam公司),驴抗小鼠荧光二抗(Jackson Immuno公司)。兔抗PI3K(phospho Y607)(货号:ab235266,Abcam公司),兔抗AKT(phospho T308)(货号:ab38449,Abcam公司),小鼠抗β-actin(货号:ab8227,Abcam公司)。人胃癌细胞系MGC-803,MKN45和正常胃上皮细胞GES-1细胞株(上海中科院细胞库)。
1.2 组织标本来源 收集2019年1月—2020年12月南通大学附属医院手术切除的66例胃癌及癌旁组织标本,均经组织病理学确诊,其中男性38例,女性28例,年龄44~81岁,中位年龄58岁。本研究经医院伦理委员会审批,患者均签署知情同意书。
1.3 细胞培养及转染 人胃癌细胞MGC-803、MKN45和正常胃上皮细胞GES-1细胞株采用含10%胎牛血清的DMEM高糖培养基,置于37℃、5%CO2培养箱培养。当MGC-803和MKN45细胞生长至对数生长期时,以0.25%胰酶消化后接种于6孔板。待细胞融合度达到50%~60%时,按照试剂说明书操作步骤进行质粒转染:取5μL Lipofectamine 2000TM加入500μL DMEM基础培养基中,分别吸取10μL mi R-320b mimics,miR-320b inhibitor或miR-NC对照储存液加入500μL无血清DMEM高糖基础培养基中。室温孵育20 min,随后将两者混匀,室温孵育30 min。将miR-320b mimics、miR-320b inhibitor、miR-NC和转染试剂的混合液加入细胞,终浓度为80 nmol/L,miR-320b mimics和inhibitor终浓度为150 nmol/L。6 h后更换为新鲜含血清的完全培养基,继续培养用于后续实验。
1.4 荧光定量PCR反应 胃癌、癌旁组织及转染前后细胞株,采用Trizol法提取RNA,分光光度计检测RNA浓度及纯度。参照cDNA第一链合成试剂盒进行cDNA合成,以snU6为内参,构建20μL荧光定量PCR反应体系:逆转录cDNA 2μL,SYB R Green预混液10μL,上游引物1μL,下游引物1μL,DEPC水6μL。反应条件:95℃5 min,95℃10 s和58℃20 s,40个循环。每份标本重复检测3次,取平均值为CT值。利用2-ΔΔCt计算mi R-320b相对表达量。
1.5 CCK-8细胞增殖实验 在96孔板中每孔接种约5 000个MGC-803或MKN45细胞,待细胞完全贴壁后,按照上文实验步骤分别转染mi R-320b mimics、mi R-320b inhibitor和mi R-NC。在转染后0、1、2、3 d加入10μL CCK-8检测试剂,反应4 h后吸取上清液,使用酶标仪检测450 nm波长处的吸光度。每次检测取3个复孔,使用GraphPad Prism软件绘制细胞生长曲线。
1.6 流式细胞术检测细胞凋亡 取对数生长期的MGC-803和MKN45细胞,分别转染mi R-320b mimics、mi R-320b inhibitor、miR-NC,48 h后收集细胞。以预冷的1×PBS缓冲液洗2遍,加入300μL结合缓冲液重悬细胞,最后加入5μL PI染料和5μL Annexin V-FITC染料,充分混合均匀,室温避光反应15 min,流式细胞仪检测细胞凋亡,使用艾森流式分析软件分析数据。
1.7 Western blot法测定p-PI3K和p-AKT蛋白表达 取转染48 h后的MGC-803和MKN45细胞,采用RIPA蛋白裂解液提取细胞总蛋白,BCA法测定蛋白浓度,根据每孔蛋白上样总量30μg计算蛋白上样体积。配制12%SDS-PAGE凝胶,浓缩胶电泳条件为70 V电泳1 h,分离胶为100 V电泳2 h。电泳结束后取SDS-PAGE凝胶将蛋白转印至PVDF膜上,转膜条件设置为100 V,65 min。将PVDF膜置于5%脱脂奶粉中室温封闭1 h,洗膜,加一抗,4℃孵育过夜。第二天用1×TBST洗膜3次,每次5 min,再加入二抗室温孵育2 h。采用ECL化学发光,凝胶成像系统显影。
1.8 统计学处理 应用SPSS 19.0统计学软件对数据进行分析。计数资料以频数和率表示,组间比较采用χ2检验;计量资料以±s示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-320b在胃癌组织和细胞株中的表达 实时荧光定量PCR检测显示,胃癌组织中miR-320b表达显著低于癌旁组织(P<0.001),胃癌细胞株MGC-803和MKN45中miR-320b表达均显著低于胃上皮细胞GES-1(P<0.01),差异均有统计学意义。见图1A、1B。
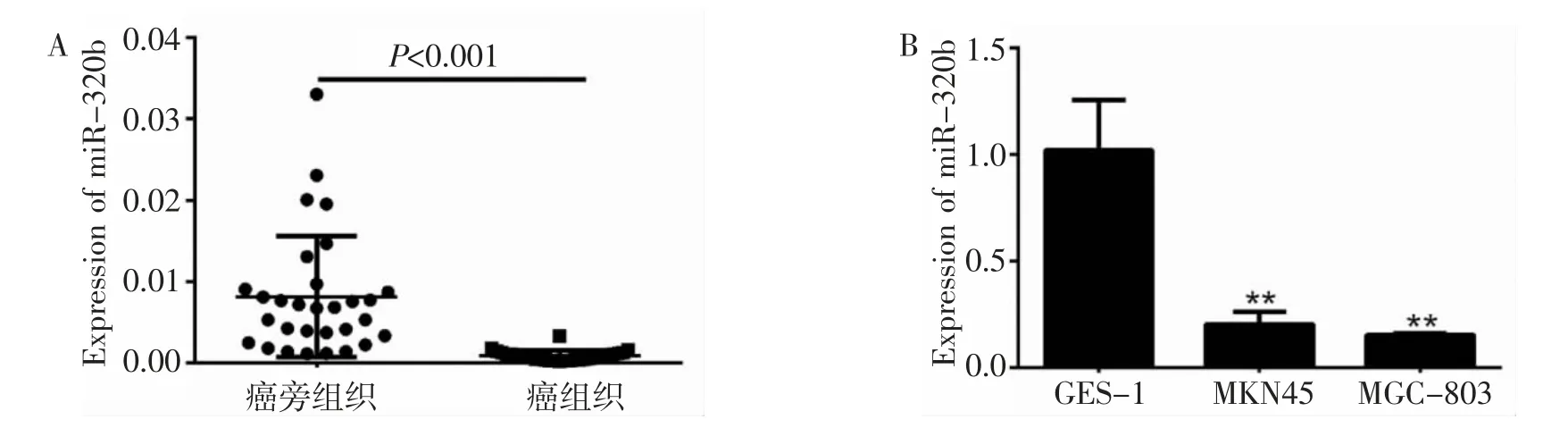
图1 miR-320b在胃癌组织及胃癌细胞株中表达
2.2 miR-320b表达与胃癌患者临床病理特征的关系 临床分期T3、T4患者miR-320b表达低于T1、T2患者,淋巴结转移患者miR-320b表达低于无淋巴结转移患者,差异均有统计学意义(P<0.001),而miR-320b表达与患者性别、年龄及肿瘤细胞分化程度无关。见表1。
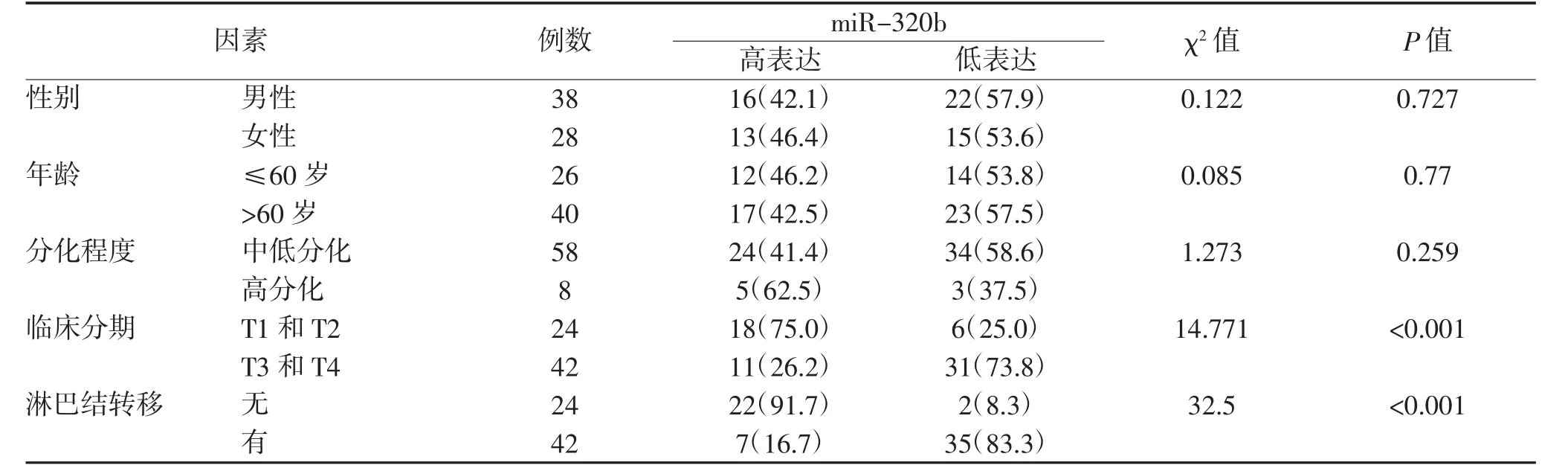
表1 miR-320b表达与胃癌患者临床病理特征的关系 例(%)
2.3 mi R-320b抑制MGC-803和MKN45胃癌细胞增殖能力 CCK-8法检测结果显示,与转染miRNC比较,转染miR-320b inhibitor的MGC-803和MKN45细胞增殖明显增加,转染miR-320b mimics的MGC-803和MKN45细胞增殖明显降低,差异均有统计学意义(P<0.05),提示mi R-320b可以抑制胃癌细胞MGC-803和MKN45的增殖能力。见图2。

图2 CCK-8法检测miR-320b抑制胃癌细胞株增殖
2.4 mi R-320b促进胃癌细胞MGC-803和MKN45细胞凋亡 与转染miR-NC比较,转染miR-320b mimics的MGC-803和MKN45凋亡细胞比例增加,主要为Annexin V+/PI+细胞比例增加(右上象限),而转染miR-320b inhibitor的MGC-803和MKN45凋亡细胞比例降低,提示miR-320b促进胃癌细胞MGC-803和MKN45凋亡。见图3。
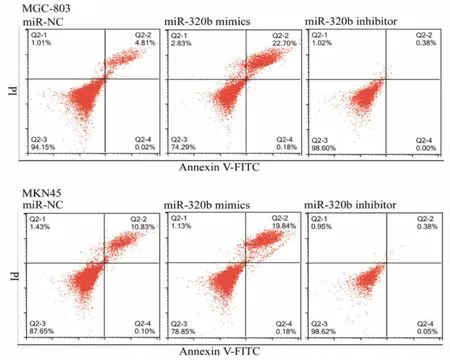
图3 流式细胞仪检测miR-320b促进胃癌细胞凋亡
2.5 miR-320b抑制PI3K/AKT信号通路的激活 为了进一步明确miR-320b参与胃癌发生发展的分子机制,采用Western blot法检测胃癌细胞转染后pAKT,pPI3K和总AKT、PI3K表达。结果显示与转染miR-NC比较,转染miR-320b mimics的MGC-803和MKN45细胞p-PI3K和p-AKT蛋白表达均显著降低,而转染miR-320b inhibitor的MGC-803和MKN45细胞p-PI3K和p-AKT蛋白表达均显著增加,而总PI3K和AKT水平无明显变化。见图4。
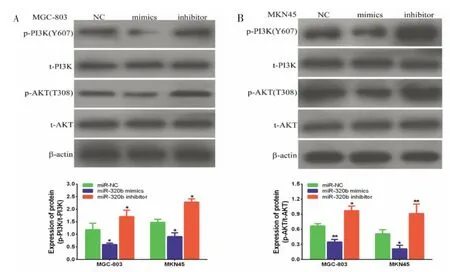
图4 Western blot检测miR-320b抑制胃癌细胞p-PI3K和p-AKT蛋白表达
3 讨 论
越来越多的研究表明miRNA在人类多种疾病中异常表达,包括帕金森病[25]、糖尿病[26]、动脉粥样硬化[27]、免疫疾病[28],特别是恶性肿瘤[29-32]。研究发现,miRNA异常表达可影响胃癌细胞增殖、凋亡和侵袭[33-35],如miR-140-5p结合THY1抑制Notch通路活化,从而抑制胃癌细胞增殖、侵袭、迁移等生物学进程[36],miR-106a调节TFAP2E甲基化介导MGC-803细胞耐药[37]。本研究结果显示,与胃癌癌旁组织比较,胃癌组织中miR-320b表达量显著降低,与结直肠癌、胶质瘤和鼻咽癌中的发现一致[1,38-39]。有研究发现miR-320b可抑制胶质瘤细胞[17]和结直肠癌细胞[38]增殖,促进细胞凋亡。本研究发现,转染mi R-320 inhibitor可以特异性抑制MGC-803和MKN45细胞miR-320b表达,细胞增殖能力增加,凋亡率降低,提示miR-320b在胃癌细胞增殖过程中可能发挥抑制作用。
许多研究表明,在胃癌中PI3K/AKT信号通路发生改变,如常会出现PIK3CA(PI3K一个亚基)点突变[40-43],在胃癌及其它肿瘤中PI3K/AKT信号通路通常被激活[44]。本研究结果显示,与转染miR-NC比较,转染miR-320b mimics的胃癌细胞p-PI3K和p-AKT蛋白表达显著下调,而转染miR-320b inhibitor的胃癌细胞p-PI3K和p-AKT蛋白表达显著增加。miR-320b通过调节PI3K和AKT磷酸化水平影响肿瘤细胞的增殖、凋亡甚至化疗和放疗抗性[22],从而在胃癌的发生发展中发挥作用,但miR-320b对PI3K/AKT信号通路调节的具体机制还有待进一步研究。
综上所述,miR-320b在胃癌组织中表达下调,导致PI3K/AKT信号通路激活,提示miR-320b在胃癌中可能发挥重要的抑癌作用,显著影响胃癌细胞的增殖和凋亡,这种作用可能是通过抑制PI3K/AKT信号通路来实现的。

