暹罗芽孢杆菌X7抗菌肽的分离纯化及抑菌特性分析
徐晓裕,李甜,王欢,王斌,史学伟
(石河子大学食品学院,新疆 石河子 832003)
果蔬生长和采后易发生因病原菌侵害引起的病害。病害控制方法主要有低温贮藏、气体调节和化学农药杀菌等,其中,气体调节和低温贮藏成本高、能耗高、质量不稳定,而化学杀菌剂的广泛使用可增加药物残留,对环境和消费者的健康构成严重威胁[1,2]。用生物防治技术取代传统的化学药物防治是目前果蔬病害防治的研究热点[3]。
芽孢杆菌(Bacillus)是人类较早发现的细菌之一,在生长过程中可以产生脂肽类、抗菌蛋白等多种活性物质,是生物防治中的优势微生物种群[4]。暹罗芽孢杆菌(B.siamensis)是由Sumpavapol等[5]首次分离出来的一种新型芽孢杆菌,其与解淀粉芽孢杆菌(B.amyloliquefaciens)、贝莱斯芽孢杆菌(B.velezensis)、甲基营养型芽孢杆菌(B.methylotrophicus)在基因水平上同源性较高。目前对暹罗芽孢杆菌的研究还处于初步阶段。Fan等[6]从土壤中分离出的暹罗芽孢杆菌Hs02对Fusarium oxysporum、F.solani和Phoma herbarum等植物病原菌有很强的抑制作用。利用抗菌肽防治果蔬害虫是一项新技术。由于抗菌蛋白是暹罗芽孢杆菌的次级代谢产物,产量低,使其在生物防治中的应用受到很大限制[7,8]。因此,研究抗菌蛋白的分离纯化,增加获取微生物资源的途径,对控制采后病害具有重要意义。
本研究选用从葡萄园土壤中分离的对葡萄采后病原菌具有广谱抑菌作用的暹罗芽孢杆菌为研究对象,对抗菌肽进行分离纯化,并探讨其抑菌特性,以期为暹罗芽孢杆菌抗菌肽在葡萄采后生物防治中的应用提供理论依据。
1 材料与方法
1.1 试验材料、试剂
暹罗芽孢杆菌(Bacillus siamensis)X7由本实验室从葡萄园土壤中分离得到。黑曲霉(Aspergillus niger)从采后自然腐败的鲜食葡萄果实中分离,并通过ITS区进行鉴定。
LB培养基:蛋白胨10 g、酵母浸粉5 g、NaCl 10 g、琼脂粉15 g、蒸馏水1 000 mL。
DEAE-Sephadex A-25、Sephadex G-75葡萄糖凝胶、十二烷基硫酸钠、聚丙烯酰胺、标准蛋白Marker,北京索莱宝科技有限公司;过硫酸铵、考马斯亮蓝G250、葡萄糖、蛋白胨、酵母浸粉、琼脂、NaCl,北京奥博星生物技术有限责任公司。PDA培养基,青岛高科技工业园海博生物技术有限公司。胃蛋白酶、木瓜蛋白酶、蛋白酶K、甲醇、石油醚、氯仿,上海麦克林生化科技有限公司。
1.2 仪器与设备
BSA224S万分之一电子天平,济南欧莱博科学仪器有限公司;DYY-6D电泳仪,北京六一生物科技有限公司;LDZF-30L-II立式高压蒸汽灭菌器,上海申安医疗器械厂;MJ-70F-I微生物恒温培养箱,上海一恒科学仪器有限公司;Legend Micro 21台式高速离心机,赛默飞世尔科技(中国)有限公司;GelDoc XR+凝胶成像仪,伯乐生命医学产品(上海)有限公司;GAL-EV3620高电流蛋白电泳仪,GALILEO Bioscience。
1.3 试验方法
1.3.1 抗菌物质的定位 将暹罗芽孢杆菌X7
接种于LB液体培养基中,30℃、180 r/min摇床中培养48 h后,收集菌悬液分为3等份。第1份不做任何处理;第2份在4℃、12 000 r/min条件下离心得到发酵上清液和菌体沉淀;第3份离心后将发酵上清液通过0.22μm水系滤膜,制备发酵上清滤液。分别测定4个不同组分(菌液、发酵上清液、菌体沉淀、发酵上清滤液)的抑菌效果,每个处理3次重复[9]。
1.3.2 抗菌蛋白粗提液的制备 将暹罗芽孢杆菌X7的种子液按接种量3%接种于LB液体培养基中,在30℃、180 r/min摇床中培养48 h后,12 000 r/min离心30 min,去除菌体沉淀,得到发酵上清液。采用硫酸铵沉淀法提取菌体粗蛋白:发酵上清液边搅拌边缓慢添加经过研磨的硫酸铵粉末,使硫酸铵饱和度分别为10%、20%、30%、40%、50%、60%、70%、80%,并放置4℃冰箱中过夜。12 000 r/min离心10 min,离心所得沉淀溶于0.01 mol/L Tris-HCl(pH=7.5,下同)后,透析脱盐得到粗蛋白。分别测定硫酸铵不同饱和度下粗蛋白的抑菌效果,确定最佳硫酸铵饱和度[10,11]。
1.3.3 抗菌蛋白的分离与纯化 步骤主要为:
(1)蛋白含量的测定:以牛血清白蛋白作为标准,蛋白含量的测定采用Bradford染色法[12]。
(2)Sephadex G-75凝胶层析:称取适量Sephadex G-75干粉置于超纯水中浸泡过夜,使其充分溶胀,适当搅拌排除凝胶内部气泡,倾斜将悬浮于表面的细颗粒除去。用布氏漏斗将溶胀后的凝胶抽干后置于烧杯中,加入适量的0.05 mol/L Tris-HCl缓冲液静置1 h,平衡两次并做排气处理。装柱平衡后,将5mL样品沿内壁缓慢加入层析柱后打开开关,使液面与凝胶齐平关闭开关,用少量0.05 mol/L Tris-HCl缓冲液洗柱内壁两次,加0.05 mol/L Tris-HCl缓冲液至凝胶面以上3 cm左右,开始洗脱,控制流速1 mL/min,人工收集洗脱液。每管收集5 mL,连续收集30管,并测定OD280值,将峰值处的层析液分别进行抑菌活性测定。将具有抑菌活性的吸收峰流出液再次层析[13]。
(3)DEAE-Sephadex A-25层析:称适量DEAE-Sephadex A-25粉末,用超纯水充分溶胀。预处理完后装柱,用0.05 mol/L Tris-HCl缓冲液充分平衡,上样量为2 mL,流速为0.5 mL/min,每管收集2 mL。采用0.05 mol/L Tris-HCl缓冲液与0~1mol/LNaCl洗脱液进行线性梯度洗脱,收集280 nm波长洗脱峰处的层析液,并进行抑菌活性测定[14]。
(4)抗菌蛋白SDS-PAGE电泳分析:将纯化的抗菌蛋白经过超滤管过滤浓缩后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测(12%的分离胶和4%的浓缩胶)。将样品放在转速为30 r/min的振荡器上,染色1 h后,用脱色液脱色至条带清晰。利用凝胶成像系统拍照后,凝胶样品保存于ddH2O中[15]。
1.3.4 抗菌肽理化性质测定 测定项目如下:
(1)温度稳定性测定:将抗菌肽溶解液配制成1 mg/mL,并将其分别在35、45、55、65、75、85、95、105、115℃加热30 min,以置于室温的样品作为对照,采用平板对峙法进行抑菌试验,测量抑菌圈直径,每个处理3次重复[16]。
(2)酸碱稳定性测定:将抗菌肽溶解液配制成1 mg/mL,用2 mol/L HCl溶 液 和2 mol/L NaOH溶液调节溶解液pH值分别为3、4、5、6、7、8、9、10、11,室温放置2 h后,放于4℃冰箱过夜,以自然pH值样品为对照,采用平板对峙法进行抑菌圈试验,测量抑菌圈直径,每个处理3次重复[17]。
(3)光照稳定性测定:将抗菌肽溶解液配制成1 mg/mL,将其放置在日光灯下(距离光源40 cm处),分别照射4、8、12、16、20、24、28、32 h。以未经日光灯照射的样品为对照,采用平板对峙法进行抑菌试验,测量抑菌圈直径,每个处理3次重复[18]。
(4)紫外线稳定性测定:将抗菌肽溶解液配制成1 mg/mL,于超净工作台中用40 W 紫外灯(距离30 cm处)分别照射1、3、5、7、9、11 h。以未被紫外灯照射的样品为对照,采用平板对峙法进行抑菌试验,测量抑菌圈直径,每个处理3次重复[11]。
(5)蛋白酶敏感性测定:向抗菌肽溶解液中分别加入胃蛋白酶、木瓜蛋白酶、蛋白酶K,使蛋白酶最终浓度为1 mg/mL,28℃水浴2 h,70℃水浴3 min使酶失活。以未经处理的粗蛋白作对照,采用平板对峙法进行抑菌试验,测量抑菌圈直径,每个处理3次重复[19]。
(6)有机试剂敏感性测定:向抗菌肽溶解液中分别加入50 mg/mL的甲醇、石油醚、氯仿,4℃条件下静置过夜。以未经处理的蛋白溶液作对照,采用平板对峙法进行抑菌试验,测量抑菌圈直径,每个处理3次重复[20]。
1.4 数据处理与分析
所有数据均取3次重复试验的平均值,采用SPSS软件进行数据分析和差异显著性检验,利用Origin 2021软件作图。
2 结果与分析
2.1 抗菌肽的分离与纯化
2.1.1 抑菌物质的定位 由图1可知,不同发酵液成分均具有一定的抑菌效果。发酵上清滤液、发酵上清液、菌液的抑菌效果差异不显著(P>0.05),抑菌物质可以通过细菌过滤器,且不会随着离心沉淀。表明暹罗芽孢杆菌X7具有较高的抑菌特性,且抑菌物质是分泌于胞外的某种物质。
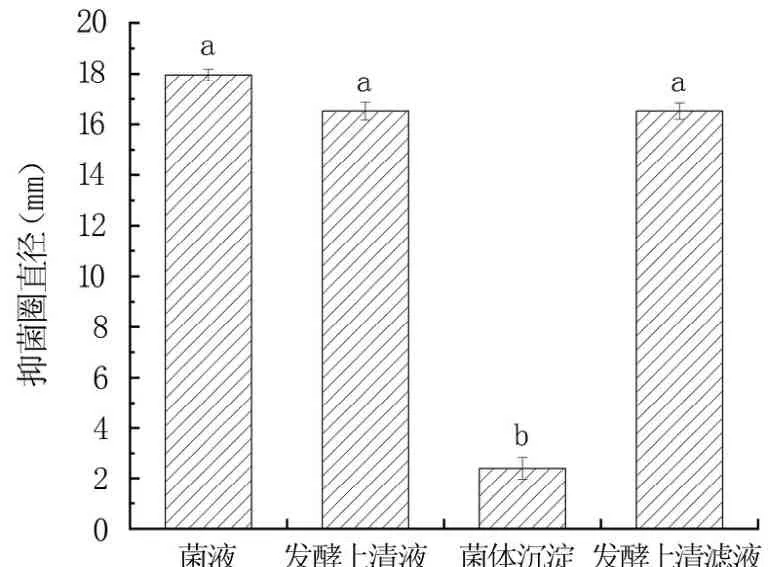
图1 不同发酵液成分的抑菌效果
2.1.2 硫酸铵最佳饱和度 从图2可以看出,当硫酸铵饱和度为10%~30%时,抗菌蛋白粗提液无抑菌效果;当硫酸铵饱和度在40% ~60%时,随饱和度的增加,抑菌圈直径逐渐增大,且差异显著(P<0.05);当饱和度为60%时,抑菌圈直径为22.36 mm,随着饱和度的继续增加,抑菌圈直径减小。故选择60%的硫酸铵饱和度分离抗菌蛋白。
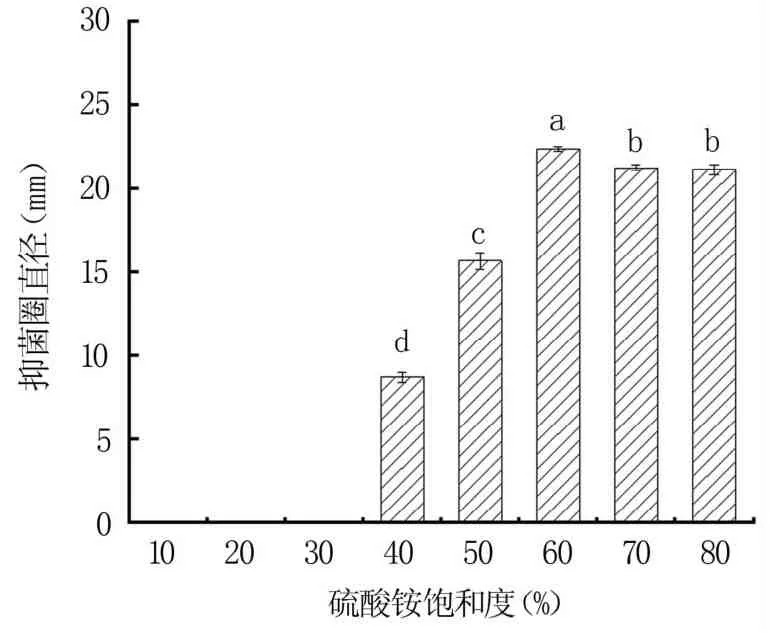
图2 硫酸铵不同饱和度下抗菌蛋白粗提液的抑菌效果
2.1.3 Sephadex G-75凝胶层析 将透析后的粗酶液样品上样于葡聚糖凝胶G-75中,层析分离结果如图3所示。收集的30管流出液,出现了G1、G2和G3共3个洗脱峰。将这3个洗脱峰做抑菌试验,发现G1具有抑菌效果,G2和G3均无抑菌效果。将G1通过离子交换层析进一步分离纯化。
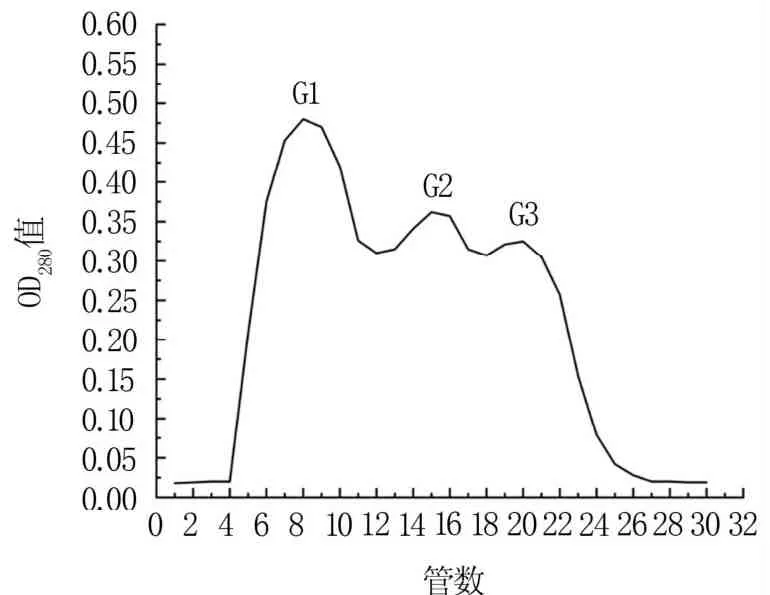
图3 Sephadex G-75凝胶层析
2.1.4 DEAE-Sephadex A-25层析 将具有抑菌效果的G1上样于DEAE-Sephadex A-25进行离子交换层析后,得到D1和D2两个洗脱峰(图4)。抑菌活性检测发现只有D1具有抑菌活性。将具有抑菌活性的洗脱峰收集并做SDSPAGE检测。
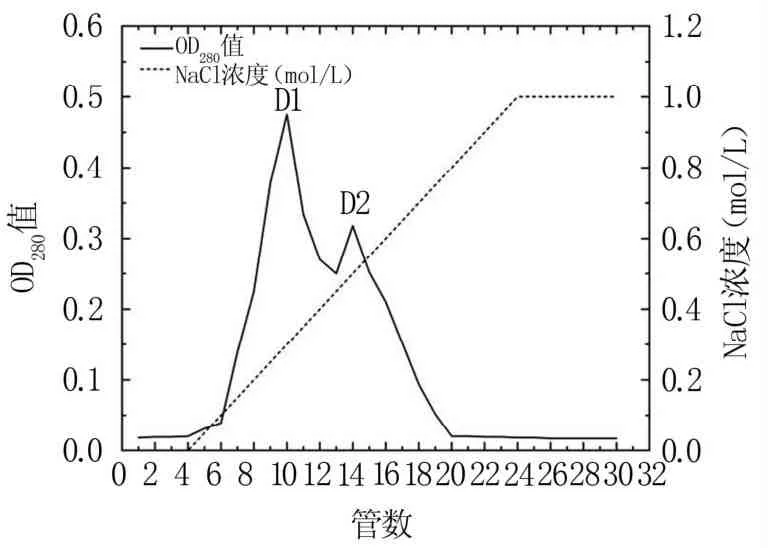
图4 DEAE-Sephadex A-25层析
2.1.5 抗菌肽的分离纯化 从表1可以看出,经硫酸铵沉淀得到5.90 mg粗蛋白溶液,最终得到1.69 mg目的蛋白,得率为28.64%。
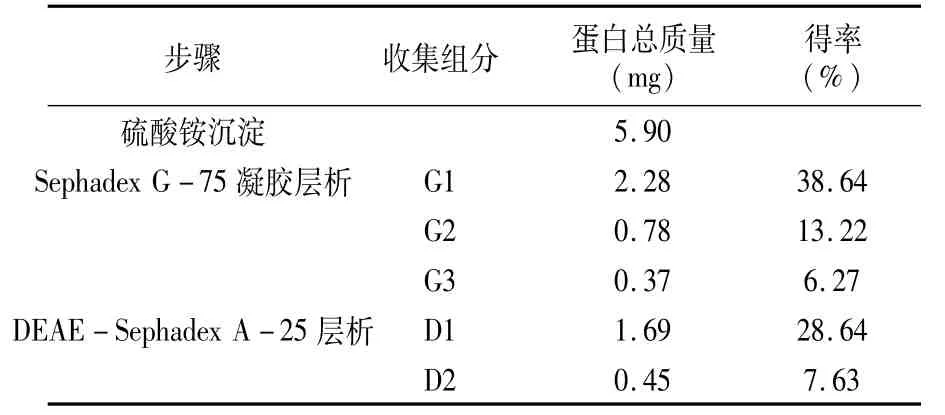
表1 抗菌肽的分离纯化
2.1.6 抗菌肽的SDS-PAGE电泳分析 对分离纯化的蛋白进行SDS-PAGE检测,表明经过两次层析之后的抗菌蛋白得到有效分离,大部分杂蛋白被去除,出现单一条带,分子量为20.1 kDa(图5)。
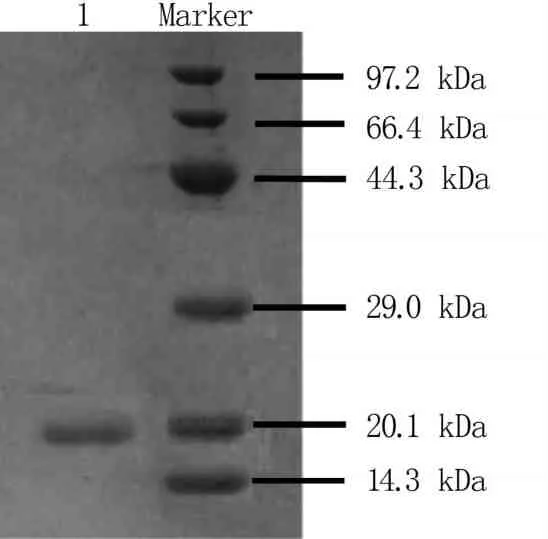
1:抗菌蛋白;Marker:蛋白标准品。
2.2 抗菌肽的性质
2.2.1 抗菌肽酸碱稳定性 由图6可知,抗菌肽物质在pH值为3~11之间均有一定的抑菌效果。抗菌肽的抑菌活性随着pH值的升高先升高后降低,pH值在5~7之间具有最高的抑菌活性,且抑菌活性无显著差异(P>0.05)。表明,抗菌肽在pH值为5~7之间有较好的稳定性。
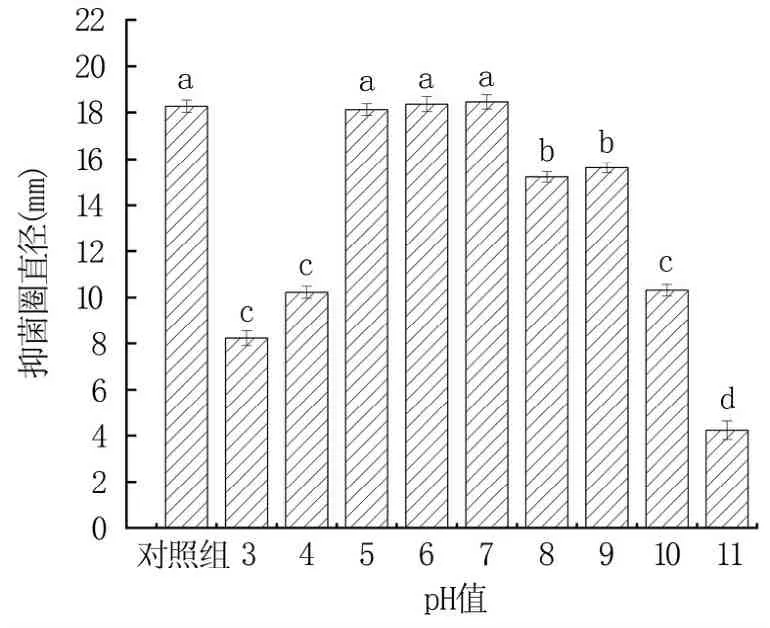
图6 不同pH值对抗菌肽稳定性的影响
2.2.2 抗菌肽温度稳定性 由图7可知,当温度在35~105℃下,抗菌肽均有一定的抑菌效果。65℃以下抗菌肽的抑菌效果无显著变化(P>0.05),75℃时抑菌效果开始显著下降,105℃时抑菌效果仅为对照组的32.3%。表明,抗菌肽具有一定的热稳定性,温度适应性较广。
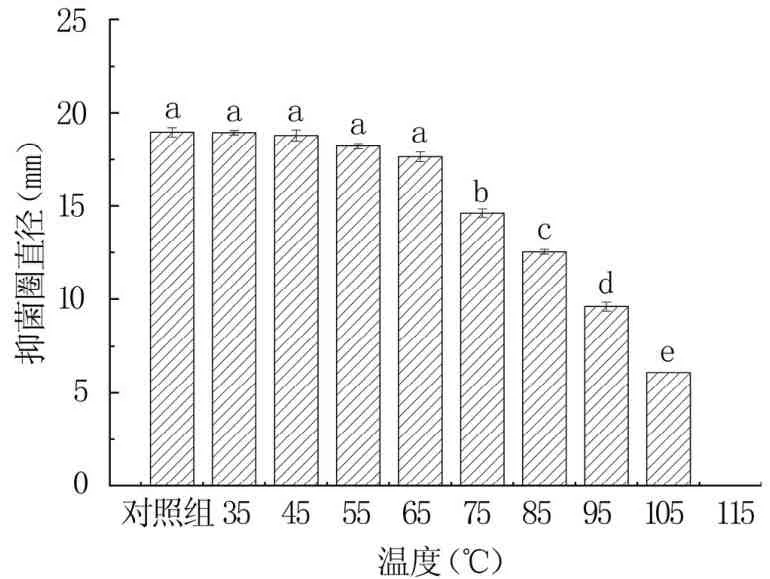
图7 不同温度对抗菌肽稳定性的影响
2.2.3 抗菌肽光照稳定性 由图8可知,光照时间在4~32 h下,抑菌效果相较于对照组无显著变化(P>0.05)。可见抗菌肽对光照具有很强的稳定性。
2.2.4 抗菌肽紫外线稳定性 由图9可知,与对照组相比,紫外照射时间在3 h内时,抑菌效果无显著差异(P>0.05)。随着紫外照射时间的增加,抑菌效果逐渐降低。总体看来,抗菌肽对紫外照射不敏感。
2.2.5 抗菌肽蛋白酶、有机试剂稳定性 与对照组相比,不同蛋白酶和有机试剂处理下的抗菌肽抑菌圈直径无显著变化(P>0.05,图10、图11)。说明抗菌肽对蛋白酶和有机试剂具有一定的稳定性。
图8 不同光照时间对抗菌肽稳定性的影响
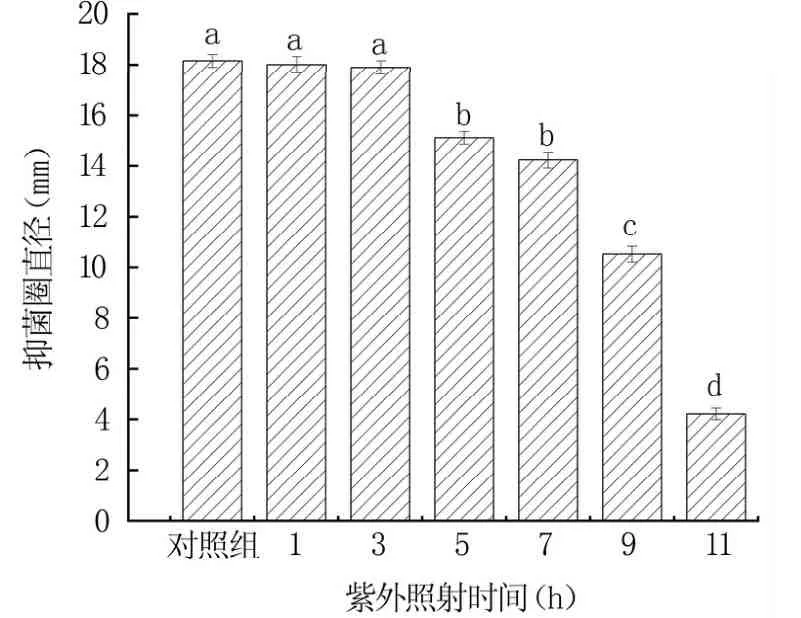
图9 紫外线照射时间对抗菌肽稳定性的影响
图10 不同蛋白酶对抗菌肽稳定性的影响
图11 不同有机试剂对抗菌肽稳定性的影响
3 讨论与结论
芽孢杆菌属是研究最多且广泛应用于生物防治的细菌[21,22]。作为一种生防菌株,主要通过生产各种生物活性化合物(如脂肽和聚酮化合物)发挥作用[23]。近年来,有研究者从多种样品中分离到具有不同功能的芽孢杆菌及其抗菌肽。从土壤中分离出的解淀粉芽孢杆菌RX7产生的抗菌肽具有良好的热稳定性和酸碱稳定性,在80℃处理30 min后活性完全保留,之后在较高温度下逐渐降低;该抗菌肽对α-糜蛋白酶、蛋白酶K和胰蛋白酶不敏感[24]。从土壤样品中分离的地衣芽孢杆菌VPS50.2中的新型抗利氏杆菌素地衣菌素50.2对溶菌酶和蛋白酶K不敏感,在100℃下处理30 min或在较大pH值范围(2~12)内仍然保持良好的稳定性[25]。抗菌肽对宏观生物和环境安全,几乎没有副作用,也不会引起敏感性和免疫抑制,因此已被广泛应用于食品工业和农业等[26]。
生物防治是选择对产品以及人体不造成危害的微生物,利用微生物之间的拮抗作用抑制病原菌生长的一种有效防治病害的新途径。本试验通过60%硫酸铵饱和溶液沉淀透析除盐,从暹罗芽孢杆菌X7中分离到抗菌粗蛋白,经DEAESephadex A-25层析、Sephadex G-75凝胶层析、SDS-PAGE纯化得到抗菌蛋白。该抗菌蛋白的抑菌活性具有较好的热稳定性、酸碱稳定性、紫外线稳定性和光照稳定性,对蛋白酶以及有机试剂不敏感,可以考虑将该菌用于果蔬采后病害防治。

