过表达海藻糖合成酶编码基因TvTPS/TPP的绿色木霉工程菌的构建及其抗逆特性分析
张豪,李哲,郭凯,郝永任
(齐鲁工业大学(山东省科学院)生物研究所,山东 济南 250014)
木霉(Trichoderma spp.)是一类重要的多功能丝状真菌,也是工业上重要的酶制剂生产菌株和农业生产中重要的生防菌株和植物促生菌株,在促生抗逆、生物防治、纤维素酶生产和生物质利用等方面有着广泛用途。
在生产、保存、运输以及工农业应用中,木霉不可避免地要面对自然环境和发酵环境中的不利影响,如高温、低温、盐碱、干旱等,这将直接影响木霉生存,进而影响其农业防治效果和工业生产能力。因此,提高木霉对不利环境的适应能力,对其在工农业上的应用意义重大。
木霉体内代谢途径丰富,代谢产物繁多,很多代谢产物参与调控木霉对不利环境的适应能力。利用基因组和基因工程技术进行分析发现,调控木霉中重要代谢产物的表达是提高木霉抗逆性、促生能力和产酶能力的有效途径。大多数生物在面对逆境胁迫时会大量合成一些相溶性物质用来保护细胞免受伤害[1],如糖、多元醇和氨基酸等小分子,可以缓解外界渗透压对细胞造成的压力[2]。Kunte[3]研究发现在微生物细胞内,许多相容性溶质会随着微生物的生长而不断变化。
海藻糖是一种典型的应激代谢产物,当生长环境良好时,生物体体内不积累海藻糖;当处于胁迫环境(如饥饿、干旱、高温和高盐碱等)时,体内会迅速积累海藻糖,且会随着不良环境的解除而被降解[4]。
海藻糖是由两个葡萄糖分子以α,α-1,1糖苷键连接的非还原性双糖,广泛存在于植物、藻类、真菌、细菌、昆虫等多种物种体内[4]。海藻糖是昆虫生长发育中的重要糖类和能量物质,被称为昆虫的“血糖”[5,6],不仅能作为能源物质在生物体内储存和作为保护剂保护生物膜、蛋白质等免受伤害,使生物更好地抵抗不利环境[7-9],还能帮助植物应对高温、高盐碱、干旱、严寒等极端环境,调节植物气孔导度和水利用率,并作为信号分子调节植物的生长、发育和代谢[10]。
Goddijn等[11]发现许多沙漠植物如折扇叶(Myrothamnus flabellifolius)、卷柏(Selaginella tamariscina)都含有高含量的海藻糖。Bell等[12]发现,在热激条件下酿酒酵母(Saccharomyces cerevisiae)中海藻糖大量积累。拟南芥(Arabidopsis thaliana)在盐胁迫环境中体内海藻糖含量增加,并提高了其耐盐碱能力[13]。
海藻糖及其前体物质海藻糖-6-磷酸(trehalose-6-phosphate,T6P)参与生物体内一些信号调控和植物中多种代谢通路。海藻糖普遍存在于真菌的孢子、子实体和营养细胞中。崔西苓[14]研究表明耐盐碱木霉菌株中存在海藻糖。
现在已知的海藻糖合成途径至少有5条,分别为OtsA-OtsB途径(TPS/TPP途径)、TreP途径、TreS途 径、TreY-TreZ 途 径 和 TreT 途径[15,16]。在真菌中存在OtsA-OtsB途径和TreP途径,分布最广的是OtsA-OtsB途径,在低等真核生物中,如酵母及丝状真菌中,海藻糖均是通过OtsA-OtsB(TPS/TPP途径)途径合成的。OtsAOtsB途径中主要的海藻糖合成酶包括海藻糖磷酸合成酶(trehalose-6-phosphate synthase,TPS)和海藻糖磷酸磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)。海藻糖合成途径包括两步酶促反应:首先由TPS催化尿苷二磷酸-葡萄糖与葡萄糖-6-磷酸形成T6P,然后由TPP催化T6P脱磷酸形成海藻糖,TPS是海藻糖合成过程中的关键作用酶[17-19]。
海藻糖在生物体内具有很强的抗脱水作用,在干旱、寒冷、高盐碱等逆境条件下可保护生物膜、蛋白质等免受伤害。因此,海藻糖能够提高生物体对逆境条件的抗性。此外,海藻糖以及其他相容性溶质的积累可增强生防菌抵御各种植物病原菌的能力[20,21]。因此,本研究构建了过表达海藻糖合成酶编码基因TvTPS/TPP的绿色木霉工程菌株,以研究TvTPS/TPP在海藻糖合成以及抗逆促生等方面的功能。
1 材料与方法
1.1 供试菌株
绿色木霉(Trichoderma viride)Tv-1511,由本实验室分离保存,在中国普通微生物菌种保藏中心的保藏号为CGMCC No.16800,保藏日期为2018年12月4日,保藏于中国科学院微生物研究所。
1.2 培养基
LB培养基、PDA培养基和PDB培养基等购自于青岛海博生物技术有限公司。PDB培养基(g/L):马铃薯浸粉6.0 g,葡萄糖20.0 g,PDA培养基另加入琼脂20.0 g。LB培养基(g/L):胰蛋白胨10.0 g,酵母浸粉5.0 g,氯化钠10.0 g,琼脂15.0 g。
1.3 试验试剂
T4连接酶试剂盒、高保真Taq酶等购自于南京诺唯赞生物科技股份有限公司;过表达载体构建质粒pBARGPE1-Hygro购自Addgene公司;限制性内切酶KpnⅠ和Eco RⅠ购自NEB公司;氨苄、潮霉素B和溶菌酶购自Sigma公司;裂解液:取0.15 g溶解酶(lysing enzyme,Sigma:L1412)溶于20 mL溶液Ⅰ(1.2 mol/L D-sorbitol,0.1 mol/L KH2PO4,pH 5.6),0.2μm滤膜过滤除菌。
1.4 绿色木霉TvTPS/TPP基因的克隆及表达载体的构建
1.4.1 TvTPS/TPP基因的克隆 参照真菌基因组提取试剂盒(E.Z.N.A Fungal DNA Kit,美国OMEGA公司)说明书提取绿色木霉Tv-1511基因组DNA。以基因组DNA为模板,扩增TvTPS/TPP基因的完整序列,扩增引物为:TvTPS/TPPFL-Eco RⅠ-F:5′-CGGAATTCATGGCGCGTTATGAGTCTCTCT-3′和TvTPS/TPP-FL-KpnⅠ-R:5′-GGGGTACCTCACAACTCCTCCTCCGGAATGT-3′;扩增体系(50μL):2×Phanta Master Mix 25μL,引物混合物4μL,基因组DNA 1 μL,ddH2O 20μL;扩增程序为:95℃3 min;95℃15 s,60℃15 s,72℃2 min,30个循环;72℃5 min。
1.4.2 DNA片段及表达载体双酶切 将得到的TvTPS/TPP基因和载体pBARGPE1-Hygro用限制性内切酶KpnⅠ和Eco RⅠ(NEB公司)进行双酶切;对酶切产物利用1%琼脂糖凝胶电泳进行检测,利用DNA回收试剂盒(FastPure Gel DNA Extraction Mini Kit,南京诺唯赞生物科技股份有限公司)回收酶切后的DNA片段和线性化的pBARGPE1-Hygro质粒。
1.4.3 过表达载体的构建及转化 DNA片段与表达载体的连接采用T4连接酶进行,反应体系(10μL):连接酶1μL,缓冲液1μL,pBARGPE1-Hygro线性化质粒1μL,TvTPS/TPP基因片段3 μL,ddH2O 4μL。16℃过夜反应,取50μL DH5α感受态细胞与10μL连接体系混匀进行质粒转化(冰上静置30 min,42℃静置90 s,冰上静置5 min),转化后涂布到含有100μg/mL氨苄青霉素的LB平板上;37℃培养12~20 h后,挑取菌落至含有100μg/mL氨苄青霉素的LB液体培养基上,37℃、200 r/min培养12~20 h后,送菌落PCR产物进行测序验证。
1.5 原生质体制备及过表达工程菌的构建
1.5.1 原生质体制备 接种绿色木霉Tv-1511于PDA平板,28℃培养10 d,待产生大量新鲜分生孢子,用10 mL生理盐水(0.9% NaCl,0.05%Tween-20)洗涤菌丝表面,经玻璃纸过滤,去除菌丝体得到孢子悬液;取200μL孢子悬液涂布于铺有玻璃纸的PDA平板上,28℃避光培养24 h;将长有菌丝的玻璃纸取出并反向贴在含有3~4 mL裂解液的平板上,于28℃、100 r/min条件下处理100 min;无菌超净台中将平板中的玻璃纸取出,确保大部分菌丝体保留在平板中,在此过程中可以用溶液Ⅰ冲洗玻璃纸上残留的菌丝块,利用枪头反复吹吸,充分释放内部原生质体;4层纱布过滤上述混合液,保留滤液并于4℃、2 000 r/min条件下离心10 min,弃上清,保留底部的原生质体加1 mL溶液Ⅰ,再次离心,弃上清;加1 mL 4℃预冷的溶液Ⅱ(1 mol/L sorbitol,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5),得到原生质体;用血球计数板计数,稀释原生质体至107个/mL。
1.5.2 原生质体转化及转化子筛选 冰上放置15 mL离心管,分别加入200μL原生质体悬浮液、10μL纯化的PCR产物、50μL PEG溶液(25% PEG6000,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5),混匀,冰上放置20 min;加2 mL PEG溶液,轻轻混匀,常温下放置5 min;加2 mL溶液Ⅱ,轻轻混匀;加2 mL混合液涂布在铺有层析纸的含1 mol/L蔗糖PDA平板上;28℃避光培养24 h;将层析纸转到含抗生素的PDA平板上,28℃避光培养36 h,待层析纸边缘长出菌落后,挑取菌落,转接至新的抗生素平板上,培养2 d。
1.6 TvTPS/TPP基因转录表达水平分析
将木霉野生型和TvTPS/TPP过表达工程菌(TvTPS/TPP-OE)的孢子液分别接种于PDB培养基中,28℃、180 r/min培养48 h,4层无菌纱布过滤获得菌丝体,经液氮充分研磨后,用Trizol法提取木霉菌总RNA,并反转录获得cDNA。采用荧光定量PCR检测试剂盒(AceQ®qPCR SYBR Green Master Mix,南京诺唯赞生物科技股份有限公司)检测TvTPS/TPP基因的转录表达水平,扩增引物为TvTPS/TPP-qPCR-F:5′-TTCCTCCAGCAGCATCTT-3′和TvTPS/TPP-qPCR-R:5′-ACCTTGTCCGTGTATCTCT-3′。扩增体系:SYBR Green Master Mix 10μL,引物混合液2μL,cDNA 3μL,ddH2O 5μL;反应程序:95℃5 min,95℃10 s,60℃30 s。
1.7 海藻糖磷酸合成酶(TPS)和海藻糖磷酸磷酸酯酶(TPP)的活性检测
离心收集菌丝体2 g,加入0.05 mol/L的磷酸二氢钾-氢氧化钠缓冲液10 mL,2%甲苯50℃处理30 min后超声波破碎,离心收集上清液。
上清液中添加40 mmol/L的tricine(pH 7.6)、2 mmol/L的磷酸烯醇式丙酮酸以及20 U的丙酮酸激酶进行催化反应,吸取200μL反应液并加入0.15%孔雀绿、1%钼酸铵和12.5%(v/v)的HCl。混合液充分反应后于630 nm处利用紫外分光光度计检测。TPS活性以在催化反应中尿嘧啶核苷(UDP)的生成量来表示,TPP活性以在催化反应中无机磷的释放量来表示。
1.8 耐盐能力的分析
平板耐盐试验:PDA平板上活化木霉原始菌株和TvTPS/TPP-OE工程菌,28℃避光培养48~72 h,使原始菌株和工程菌长势均一,使用打孔器制备大小相同的菌块并接种到含有300 mmol/L NaCl的PDA平板中央,置于28℃培养72 h后,测量菌落生长直径。
液体摇瓶耐盐试验:将200μL浓度为108个/mL木霉原始菌株和TvTPS/TPP-OE工程菌孢子液分别接种于PDB液体培养基中,28℃、180 r/min培养48 h,两层无菌纱布过滤获得菌丝体。将等量菌丝体分别接种于含有300 mmol/L NaCl的PDB液体培养基中,28℃、180 r/min培养72 h,收集菌丝体,测定菌体生物量。
1.9 耐热能力分析
平板耐热试验:PDA平板上活化木霉原始菌株和TvTPS/TPP-OE工程菌,28℃避光培养48~72 h,使菌株长势均一,使用打孔器制备大小相同的菌块并转移到新的PDA平板中央,分别置于35℃培养72 h后,测量菌落生长直径。
液体摇瓶耐热试验:将200μL木霉原始菌株和TvTPS/TPP-OE工程菌孢子液分别接种于PDB液体培养基中,28℃、180 r/min培养48 h,两层无菌纱布过滤获得菌丝体。将等量菌丝体分别接种于新的PDB液体培养基中,35℃、180 r/min培养72 h,收集菌丝体,测定菌体生物量。
1.10 耐旱能力分析
PDB液体培养基中加入30% PEG6000模拟干旱胁迫。将200μL木霉原始菌株和TvTPS/TPP-OE工程菌孢子液分别接种于PDB液体培养基中,28℃、180 r/min培养48 h,两层无菌纱布过滤获得菌丝体。将等量菌丝体分别接种于含30% PEG6000的PDB液体培养基中,28℃、180 r/min培养72 h,收集菌丝体,测定菌体生物量。
1.11 海藻糖含量的检测
将200μL木霉原始菌株和TvTPS/TPP-OE工程菌孢子液分别接种于PDB液体培养基中,28℃、180 r/min培养48 h,两层无菌纱布过滤获得菌丝体。不同胁迫条件下培养72 h后,收集菌丝体,采用高效离子色谱法(HPIC)检测菌丝体内海藻糖含量。
1.12 数据处理与分析
运用Origin 9.0对试验数据进行分析和图表制作,采用ANOVA法分析处理间的差异显著性。
2 结果与分析
2.1 TvTPS/TPP基因序列的克隆及表达载体的构建
从绿色木霉(Trichoderma viride)Tv-1511基因组中鉴定出一个双功能海藻糖合成酶的编码基因TvTPS/TPP。通过前期对Tv-1511开展的全基因组测序和精细基因组图谱绘制工作(Gen-Bank Accession No.VCEC00000000;BioProject:PRJNA543939;BioSample:SAMN11791795),得到了TvTPS/TPP基因及其编码蛋白的详细信息。TvTPS/TPP(NCBIaccession number MZ417548)基因序列已提交到NCBIGenBank数据库。TvTPS/将带有酶切连接位点(EcoⅠR和KpnⅠ)的TvTPS/TPP基因进行双酶切,获得一条2 625 bp的 DNA 片 段(图 2);将 DNA 片 段 连 接pBARGPE1-Hygro载体,得到的表达载体pBARGPE1-Hygro-TvTPS/TPP大小为8 583 bp。重组过表达质粒包含木霉启动子gpdA、终止子trpC、抗性筛选基因HygR以及TvTPS/TPP基因的完整序列(图3)。
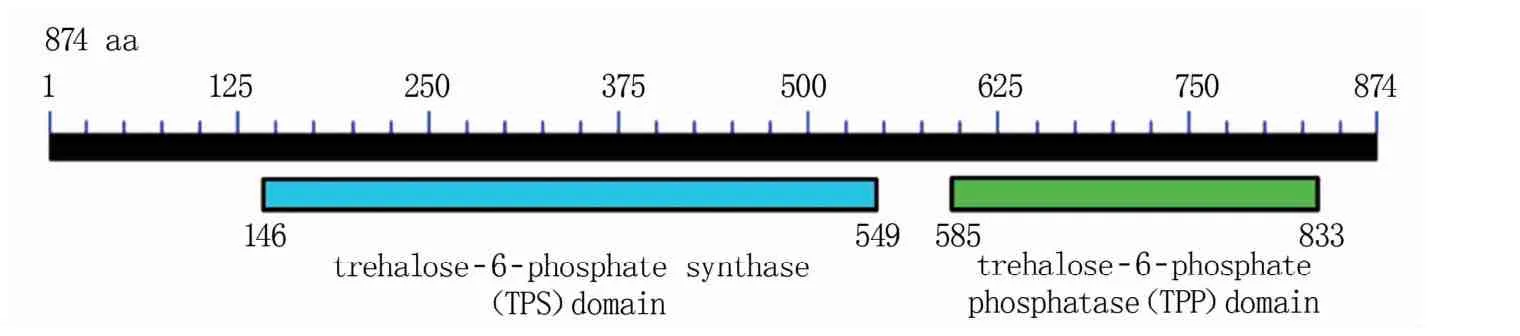
TPP蛋白的氨基酸序列包含trehalose-6-phosphate synthase(TPS)和trehalose-6-phosphate phosphatase(TPP)结构域(图1),具有海藻糖磷酸合成酶和海藻糖磷酸磷酸酯酶的双重活性。

图2 TvTPS/TPP基因克隆和pBARGPE1-Hygro-TvTPS/TPP载体构建
2.2 原生质体制备及过表达工程菌的构建
通过PEG介导的木霉转化法转化质粒,经潮霉素筛选后获得Tv-1511的阳性转化子,并采用荧光定量PCR法检测TvTPS/TPP的转录表达。结果表明,与野生型菌株相比,过表达绿色木霉工程菌中TvTPS/TPP基因的表达显著提高(图4)。过表达TvTPS/TPP基因后,工程菌中TPS和TPP酶的活性也显著高于野生型菌株(图5)。
2.3 过表达TvTPS/TPP基因绿色木霉的抗逆能力
抗逆试验结果表明,300 mmol/L NaCl以及35℃高温胁迫下,TvTPS/TPP过表达工程菌的平均直径均比野生型菌株显著增加(图6A、B;图7 A、B),生物量也显著提高(图6C、图7C)。在30% PEG6000模拟干旱胁迫的环境下,TvTPS/TPP过表达工程菌的生物量比野生型菌株显著提高(图8)。
以上结果表明过表达TvTPS/TPP基因可显著提高绿色木霉对高盐、高温和干旱逆境胁迫的耐受性。
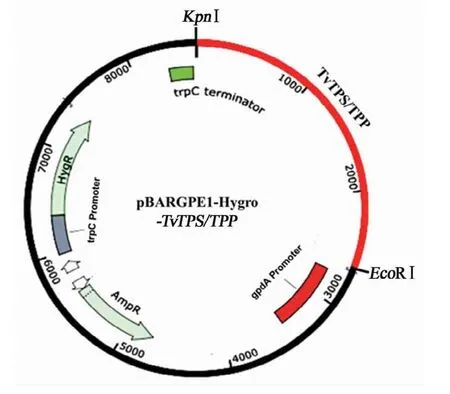
图3 TvTPS/TPP表达载体
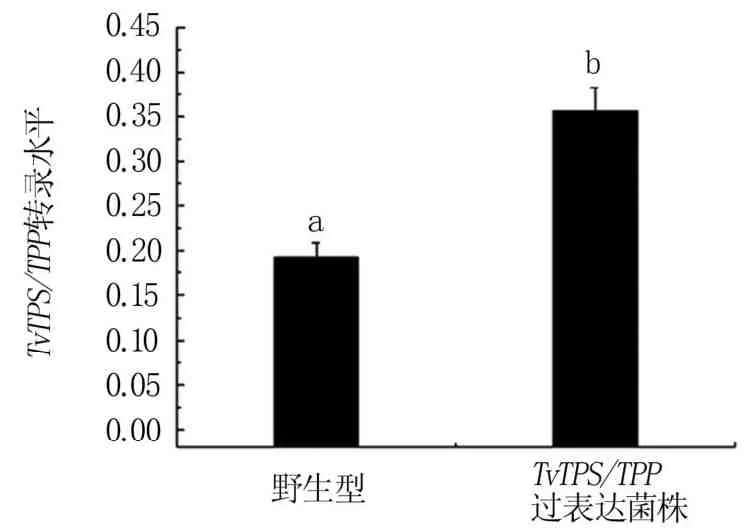
图4 绿色木霉工程菌中TvTPS/TPP基因转录水平
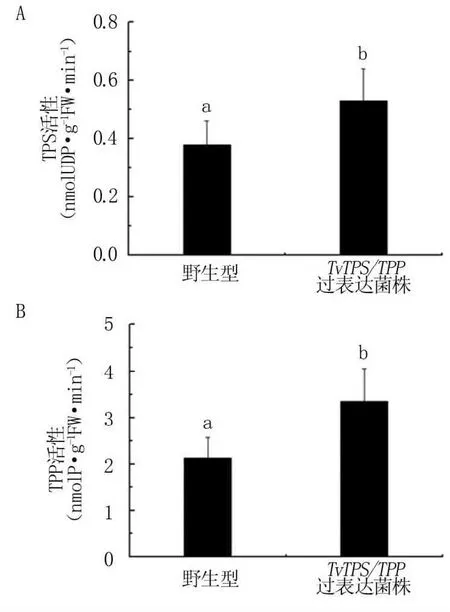
图5 绿色木霉工程菌中TPS和TPP的活性
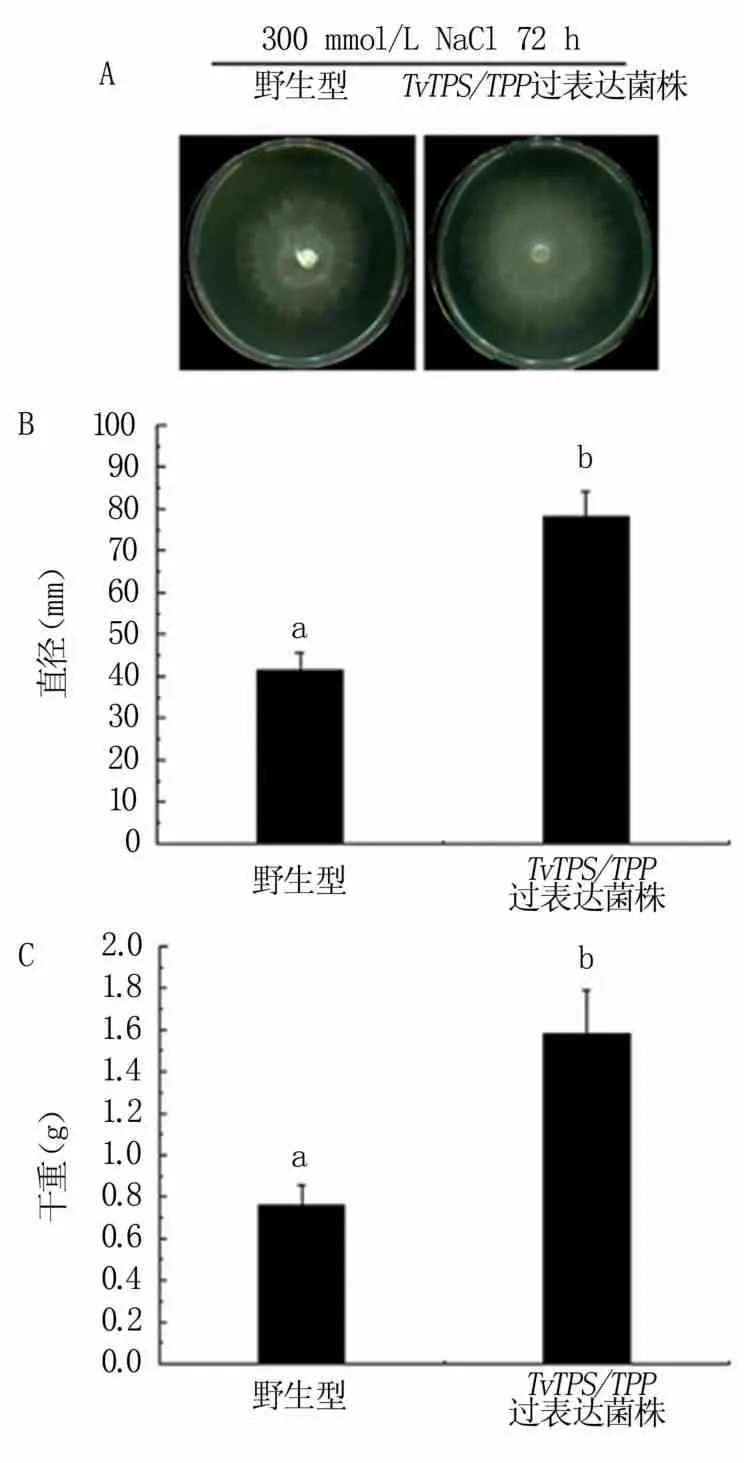
图6 绿色木霉工程菌的耐盐能力
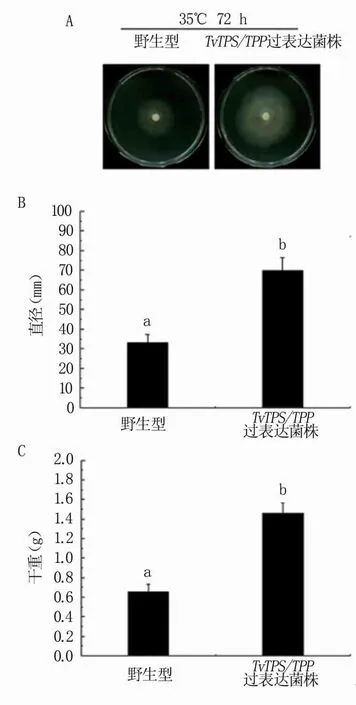
图7 绿色木霉工程菌的耐热能力
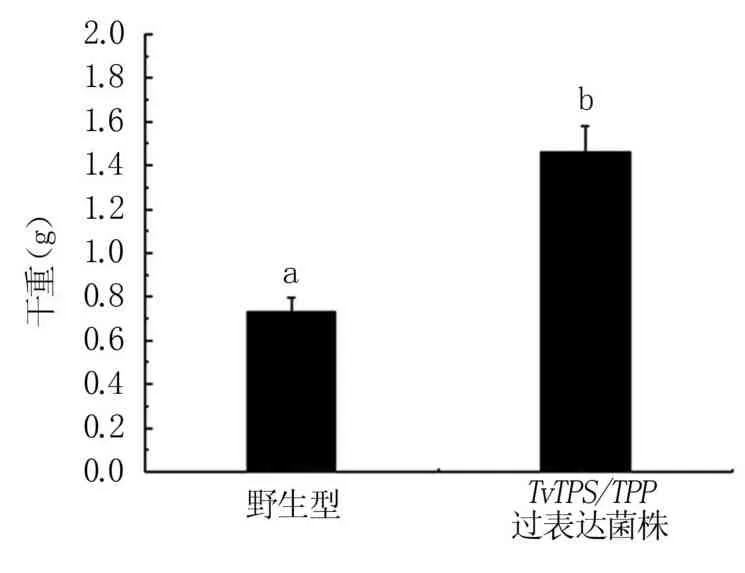
图8 绿色木霉工程菌的耐干旱能力
2.4 海藻糖含量及TPS和TPP酶活性变化
由图9可知,在盐胁迫、高温胁迫以及干旱胁迫条件下,TvTPS/TPP过表达工程菌中海藻糖含量高于野生型菌株,说明其对胁迫的耐受性增强。
对逆境胁迫下木霉菌株中TPS和TPP活性进行检测,结果(图10)显示,在盐胁迫、高温胁迫以及干旱胁迫条件下,TvTPS/TPP过表达工程菌表现更高的TPS和TPP活性。

图9 逆境胁迫下绿色木霉工程菌中海藻糖含量
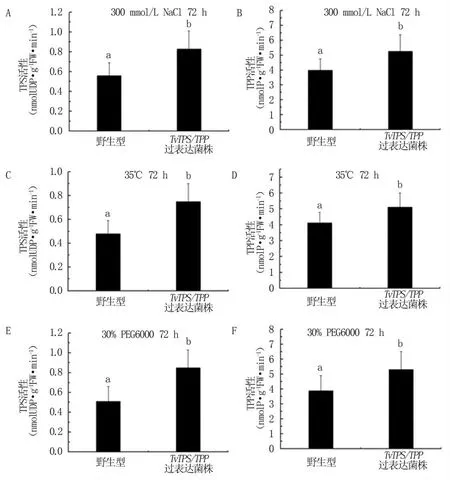
图10 逆境胁迫下绿色木霉工程菌中TPS和TPP活性
3 讨论与结论
海藻糖是一种不可或缺的生物代谢物[22,23],可在多种微生物和植物中抵御多种环境胁迫[24,25]。在极端非生物胁迫下,海藻糖作为膜、蛋白质和蛋白质复合物的非渗透性活性氧清除剂和稳定剂,是一种非常有效的保护剂[26]。Luo等[26]的研究证明了海藻糖对活性氧的直接清除能力,在热胁迫下,海藻糖可以使小麦中过氧化氢含量显著减少。Sadak等[23]的研究结果表明,盐分胁迫显著降低了小麦生长参数(地上部干重和鲜重、地上部高度等),H2O2、脂质过氧化和脂氧合酶(LOX)活性显著增加;添加海藻糖后,增加了其他渗透保护剂的水平,如脯氨酸、游离氨基酸、葡萄糖和总可溶性糖,同时降低了H2O2、脂氧合酶活性和丙二醛(MDA)含量。
在酵母和丝状真菌中,海藻糖是通过OtsAOtsB途径(TPS/TPP途径)合成的,海藻糖-6-磷酸合成酶TPS是海藻糖合成过程中的关键作用酶。海藻糖在酵母中的合成路径基本已经研究透彻,但在真菌中还未了解清楚。在酿酒酵母中,TPS是一种复合物,包括四个亚基(Tps1p、Tps2p、Tps3p、Ts11p)、两种酶和两个调节亚基[27];Tps1p和Tps2p活性在应激条件下显著增加。本研究中,在过表达TvTPS/TPP后,TvTPS/TPP的转录表达水平增高,海藻糖的含量也增加。
本试验从绿色木霉Tv-1511中克隆出了海藻糖磷酸合成酶和海藻糖磷酸磷酸酯酶的完整基因,构建了TvTPS/TPP过表达载体pBARGPE1-Hygro-TvTPS/TPP,并且通过原生质体转化将TvTPS/TPP基因转入绿色木霉Tv-1511中;对工程菌株进行了抗逆性试验和海藻糖含量的测定。结果显示,在过表达TvTPS/TPP基因后,绿色木霉Tv-1511中海藻糖含量显著增加,抵御高盐、高温和干旱胁迫的能力得到明显提高,说明TvTPS/TPP基因在绿色木霉Tv-1511的逆境胁迫方面起着重要作用。

