盐碱胁迫下外源油菜素内酯与AM真菌对羊草光合特性及抗氧化酶系统的影响
高战武,范春燕,鄢上钦,刘金霖,崔艳辉
(1.白城师范学院旅游与地理科学学院,吉林 白城 137000;2.农安县合隆镇高级中学,吉林 农安 130216)
在干旱半干旱灌溉区及主要牧场,土壤盐碱化已成为制约经济植物产量、土壤健康的关键性问题[1]。目前,我国盐碱地面积超过总耕地面积的30%,且由于土地耕用面积增加及管理措施不足,盐碱面积仍在不断扩大,盐碱化程度也在不断加剧。
盐碱胁迫是典型的非生物胁迫之一,其诱导的渗透胁迫、离子失衡和pH胁迫等不利影响可贯穿植物幼苗到成熟各个生长发育环节[2]。在绿色植物中,盐碱胁迫可对其光化学反应产生不利影响,导致气孔关闭、胞间CO2浓度增加、核酮糖-1,5-二磷酸羧化酶/加氧酶(rubisco)活性降低和活性氧(ROS)积累等[3]。其中ROS胁迫包括超氧阴离子(O2·-)、羟自由基(·OH)和过氧化氢(H2O2)过量导致碳水化合物、脂质、蛋白质和核酸产生氧化损伤从而严重破坏正常代谢[4]。植物拥有各种酶促和非酶促抗氧化剂,可通过不同生化步骤缓解过量ROS累积对细胞带来的不利影响。其中,超氧化物歧化酶(SOD)是消除超氧自由基的初始酶,其可催化超氧阴离子歧化为H2O2,随后H2O2被过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)转化为H2O和O2,从而大幅度缓解胁迫[5]。
丛枝菌根(AM)真菌隶属于球囊菌亚门,是一类在土壤中广泛存在的重要功能性微生物,大多数陆地植物可与其建立互惠共生关系,从而更好地应对环境生物/非生物胁迫等[6]。研究表明,盐碱土仍含有大量AM真菌,它可促进宿主养分吸收、改善根系功能、维持叶片光合效率和降低自由基伤害;此外,AM真菌可稳定植物细胞膜渗透性、增加光合色素、防御复合胁迫、保护细胞内水分等,在增强宿主植物耐盐碱胁迫能力方面起着重要作用[7]。油菜素内酯(brassinolide,BR)是一类甾醇类激素,它在植物生长发育以及耐逆性方面起着重要作用。研究发现,BR可减轻大豆、甜菜、玉米幼苗发育期间的盐碱抑制作用[8],改善垂丝海棠光合特征、荧光参数,增强生物膜的稳定性[9],同时可通过促进胁迫相关基因的表达,增强酶促抗氧化系统,降低丙二醛和H2O2水平以限制活性氧生成以及保护与叶绿素和光合作用有关的蛋白质[10]。
羊草(Leymus chinensis)是一种多年生根茎无性繁殖的C3植物,广泛分布于欧亚草原东部、中国东北平原及蒙古高原。它含有相对丰富的微量矿物质、维生素、优质蛋白质及碳水化合物,并且生长迅速、生物量高,因此具有重要的经济作用和生态价值[11]。目前,关于BR、AM真菌在减轻非生物胁迫方面的功能已被报道,然而关于两者复合使用对盐碱胁迫下羊草光合特性及相关生理生化的研究鲜有涉及。基于此,本试验就BR与AM真菌对盐碱胁迫下羊草叶绿素含量、光合气体交换参数、叶绿素荧光参数、相关氧化酶活性及其基因表达的影响进行研究,以期为外源油菜素内酯和AM真菌应用于恢复草地退化提供技术参考。
1 材料与方法
1.1 供试材料
供试吉生三号羊草种子来自吉林省松原市长岭县绿园草业公司。种子采用0.5%次氯酸钠表面消毒5 min,75%酒精再处理5 min,无菌水冲洗5次,之后放在培养皿内湿滤纸上暗处25℃预发芽48 h。
AM真菌为摩西斗管囊霉(Funneliformismosseae),购自北京农林科学院植物营养与资源研究所。菌株采用羊草和白三叶进行扩繁,试验接种物由孢子(30个/g)、菌丝、根系残体和土壤组成。供试油菜素内酯(BR),购自SIGMA-ALDRICH公司。
供试土壤取自吉林省松嫩草原生态站内(123°43′52″E,44°44′39″N)0~20 cm表层土壤(未受盐碱污染),为草甸土。其理化性质为有机质含量22.6 g/kg、全氮1.27 g/kg、全磷0.44 g/kg、碱解氮74.71 mg/kg、有效磷5.63 mg/kg、速效钾140.09 mg/kg,电导率225.67μS/cm。该区属温带大陆性干旱气候,年降水量300~450 mm,年均气温5℃。土壤去除植物残体,自然风干后混匀过3 mm网筛,高压蒸汽灭菌(121℃,1×105kPa,8 h)去除土著AM真菌和其它微生物,冷却混合后备用。
1.2 试验设计
试验于2021年4—7月在吉林省白城师范学院试验场遮雨塑料大棚中进行,棚内温度18±2℃。采用完全随机设计,设置2个接菌方式:不接种(-AM)、接种AM真菌(+AM)和2个油菜素内酯水平:0(-BR)、100μg/L(+BR)[12],且以上处理皆基于2个盐碱水平:0(NS)、150 mmol/L(SS)。试验共8个处理组合,重复5次。其中盐碱胁迫处理根据东北盐碱土离子组成模拟盐碱混合胁迫条件[13],即将NaCl、Na2SO4、NaHCO3和Na2CO3以摩尔质量比9∶1∶1∶9混合为盐碱溶液。
盆栽装置为聚乙烯塑料桶,高19 cm,口径14.5 cm,底径12 cm。每盆装土3 kg,播发芽羊草种子20粒。+AM处理即将30 g AM真菌菌剂接种于羊草种子下方1 cm处,-AM处理即采用灭菌剂,灭菌方式同土壤基质处理。SS处理:培养10 d后,间苗至10株,同时向盆中加入盐碱溶液100 mL,连续3 d,总用量300 mL;NS处理加蒸馏水。1周后待土壤盐碱均衡,同一天内分4次向盆中共添加油菜素内酯450 mL。此后,每2周向盆中加入0.5 mol/L Hoagland营养液50 mL且不定时适量加入水分,再培养50 d。试验共培养70 d。
1.3 样品采集及指标测定
1.3.1 羊草生物量及根系侵染率、孢子密度、菌丝长度测定 培养结束后,收获盆中全部羊草,将地上部、地下部分离,置于烘箱中105℃杀青30 min、65℃烘至恒重并称量记录。将根系切成1 cm长小段,采用品红溶液染色,光学显微镜下用网格交叉记数法计算菌根侵染率,采用湿式筛分-倾析法测定孢子数,网格线截距法测定菌丝长度,具体操作参照Phillips[14]的方法进行。
1.3.2 羊草光合色素、气体交换参数和叶绿素荧光参数测定 光合色素(叶绿素a、叶绿素b)采用丙酮-乙醇混合浸提法测定,具体步骤参照高俊凤[15]的方法。采用LI-6400便携式光合测定系统测定叶片净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)等指标。叶室温度设置为25±1℃,CO2浓度为380μmol/mol,光量子密度为1 600μmol/(m2·s)[16]。采用叶绿素荧光仪(WALZPAM-2500,德国PAM-WALZ)测定叶片的荧光动力学参数:初始荧光(Fo)、最大荧光(Fm)及正常光照下的初始荧光(Fo′)、最大荧光产量(Fm′)及稳态荧光(Fs)。叶绿素荧光参数中,PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm,非光化学荧光猝灭系数NPQ=(Fm-Fm′)/(Fm-Fo),实际光化学效率ΦPSⅡ=(Fm′-Fs)/Fm′,光化学荧光猝灭系数qP=(Fm′-Fs)/(Fm′-Fo′)。
1.3.3 抗氧化酶测定 羊草地上部丙二醛(MDA)含量采用硫代巴比妥酸比色法测定,过氧化氢(H2O2)浓度采用三氯乙酸提取-分光光度法测定,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)的测定采用李合生[17]的方法。
1.3.4 抗氧化酶相关基因提取与测定 取样后,用蒸馏水小心快速冲洗地上部,再用PBS缓冲液冲洗数次,置于干冰保温箱中,-20℃保存。称取样品100 mg,采用液氮快速研磨,使用RNA分离试剂盒(美国Qiagen公司)提取样品总RNA,采用1.0%琼脂糖凝胶电泳检测其含量与质量。采用逆转录酶M -MLV(RNaseH)催化Prime-ScriptTMRTreagent Kit gDNAr(TaKaRa)反转录构建cDNA。
根据目前GenBank序列数据库公布的羊草(Leymus chinensis)转录组序列信息,搜索到抗氧化酶相关的酶基因(Cu/Zn-SOD、CAT、APX)。根据以上基因的序列借助Primer Express 5.0软件设计扩增引物(表1),看家基因选择参考Yang等[13]的研究。使用SYBR Green Real-time PCR Master Mix(Toyobo,Osaka,Japan)和Bio-Rad CFX97实时检测系统,一式三份进行定量PCR检测。
实时荧光定量PCR由StepOnePlus Real-Time PCR仪完成。qRT-PCR反应条件参数:保持95℃预变性5 min;95℃熔化变性20 s,60℃退火60 s,72℃延伸30 s,循环40次。实时定量试验结果采用2-△△Ct算法进行相对表达量分析。

表1 qRT-PCR引物序列信息
1.4 数据处理与统计分析
采用Microsoft Excel 2013整理数据,SPSS 19.0软件进行三因素方差分析(ANOVA)和邓肯氏多重比较(P<0.05),Origin 8.0绘图。
2 结果与分析
2.1 盐碱胁迫下BR与AM真菌对羊草生物量(干重)及菌根发育的影响
图1A所示,与NS相比,盐碱胁迫(SS)下羊草地上部、根系及总干重皆整体降低,多达显著水平。无论NS还是SS条件下,无论菌根定殖与否,施加外源油菜素内酯(+BR)皆整体高于不施加处理(-BR);无论盐碱胁迫及油菜素内酯施加与否,接种AM真菌处理(+AM)亦皆显著高于不接种处理(-AM)。NS条件下,油菜素内酯结合AM真菌处理(+AM+BR)羊草具有最高的根系、地上部和总干物质重,分别为1.27、0.43 g/盆和1.70 g/盆;SS条件下,-BR-AM处理具有最低的根系、地上部和总干物质重,分别为0.94、0.26 g/盆和1.20 g/盆,前者较后者分别提高35.11%、65.38%和42.67%。
收获时镜检,显示:不接种AM真菌植株根系中未检测到菌根侵染,接种AM真菌处理根系侵染率、孢子数及菌丝长度见图1B、C、D。与NS相比,SS处理下根系侵染率(图1B)及菌丝长度(图1D)皆受到明显抑制,孢子数(图1C)变化不大。无论NS还是SS条件下,+BR处理根系侵染率、孢子数及菌丝长度皆显著高于-BR处理。其中NS条件下,与-BR 相比,施加油菜素内酯(+BR)根系侵染率、孢子数及菌丝长度分别提高28.57%、8.33%和53.38%(P<0.05),而SS处理下其增幅更为明显。
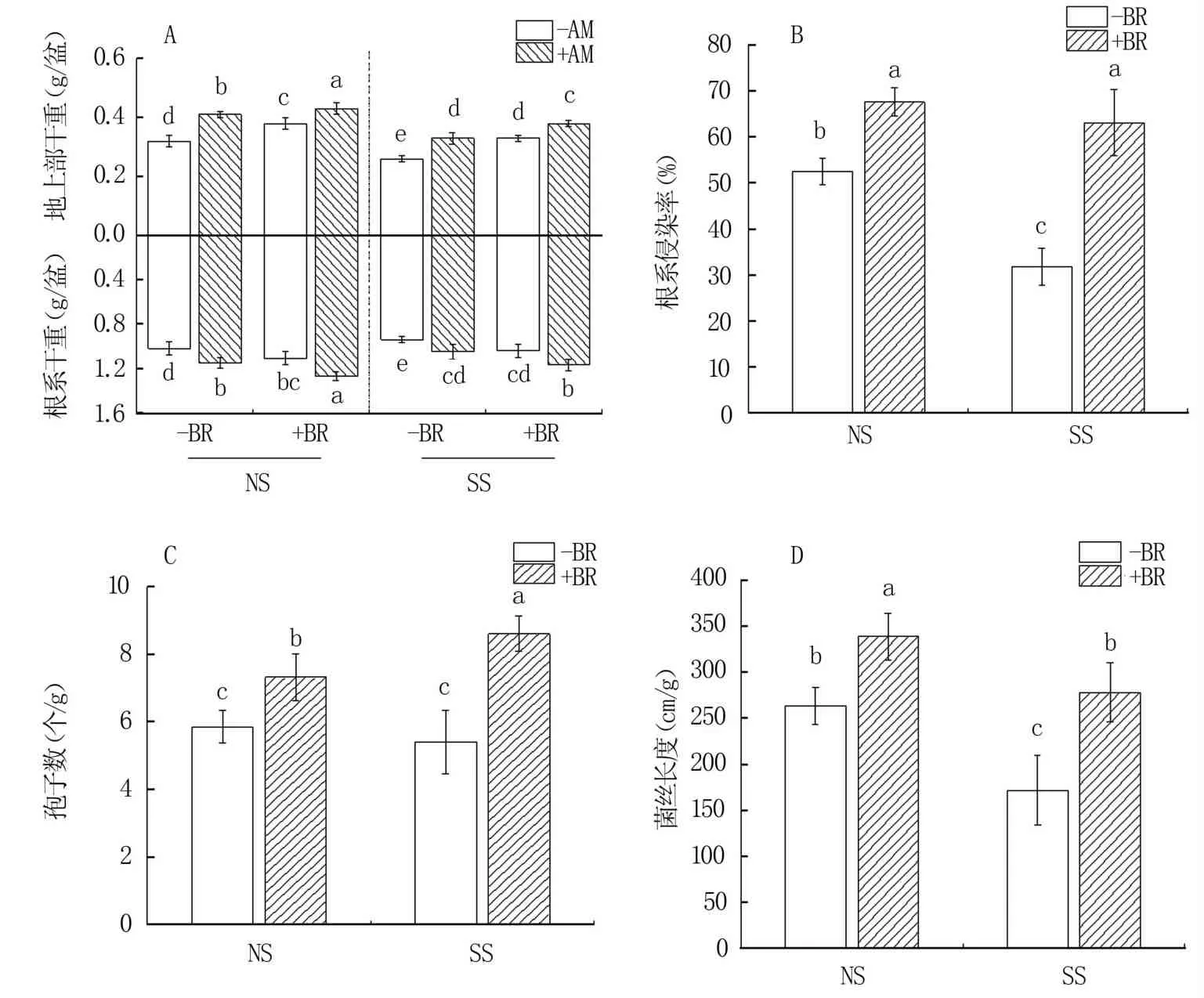
不同小写字母表示处理间差异显著(P<0.05),下同。
2.2 盐碱胁迫下BR与AM真菌对羊草光合色素含量的影响
由图2可知,NS条件下羊草叶绿素b含量整体高于SS,而叶绿素a含量两者间则波动较小。叶绿素a、叶绿素b含量,NS和SS条件下皆表现为-BR-AM<+BR-AM<-BR+AM<+BR+AM。其中NS条件下,光合色素含量表现为+BR处理高于-BR,其中叶绿素a无显著差异,叶绿素b则差异显著;AM真菌处理间,除-BR-AM与-BR+AM处理间的叶绿素a外,其它处理光合色素含量皆为+AM显著高于-AM。SS条件下,-BR-AM处理叶绿素a、叶绿素b含量皆低于其它处理7.95% ~15.63%、13.89% ~36.73%(P<0.05)。NS条件下,接种AM真菌导致叶绿素a/b值降低27.11%、9.25%;SS条件下,油菜素内酯施加处理分别降低6.41%、9.11%。
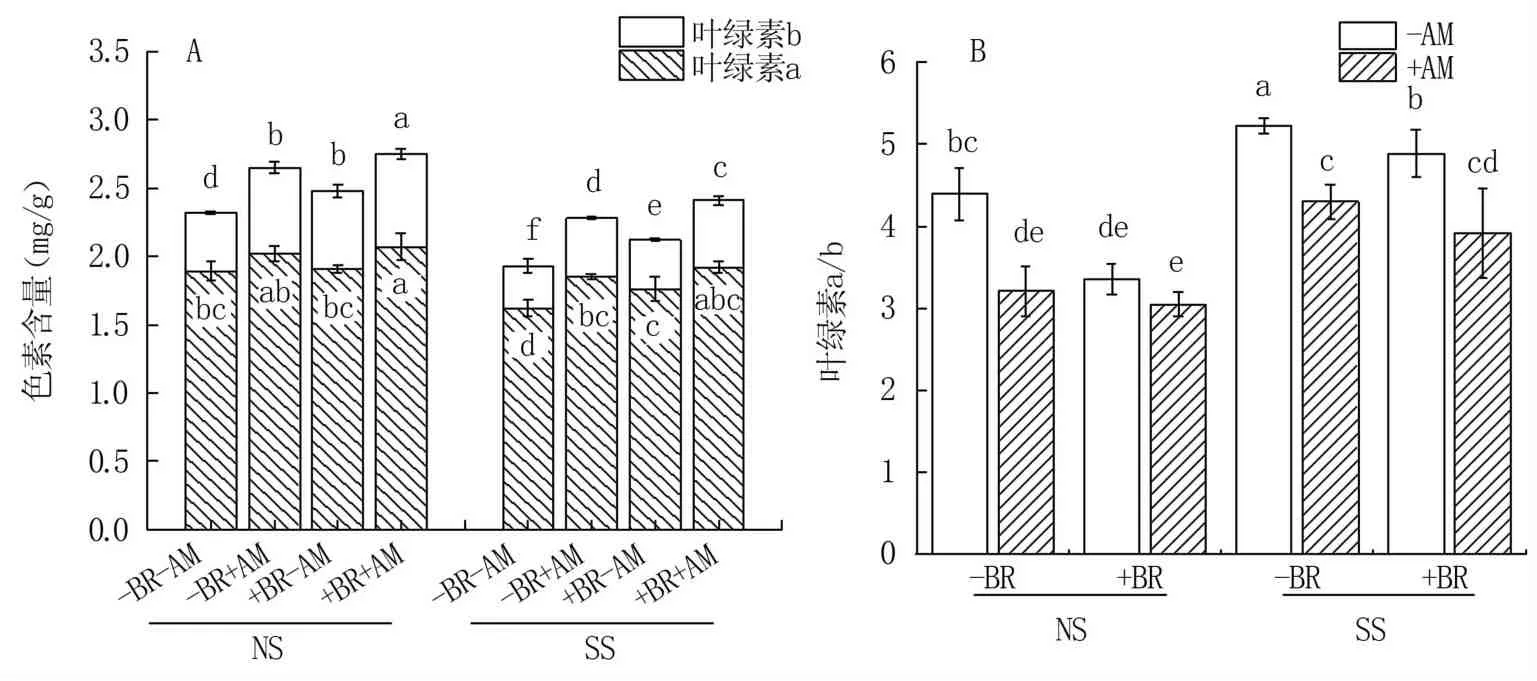
图2 盐碱胁迫下BR与AM真菌对羊草光合色素含量的影响
2.3 盐碱胁迫下BR与AM真菌对羊草光合气体交换参数的影响
由表2可看出,SS条件下所有处理羊草净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)均低于NS条件下对应处理,而AM真菌处理胞间CO2浓度(Ci)SS则高于NS。与不施加油菜素内酯+非菌根处理(-BR-AM)相比,无论NS还是SS条件下,接种AM真菌、施用外源油菜素内酯处理皆显著增加羊草叶片Pn、Gs及Tr值,其中NS条件下分别增加13.64% ~24.34%、12.86% ~31.52%及7.75%~21.64%(P<0.05),SS条件下分别增加22.78%~48.72%、13.60% ~41.95%及12.43%~29.10%(P<0.05)。NS条件下,Ci以不施加油菜素内酯+非菌根处理(-BR-AM)最低,较其它处理降低6.15% ~11.31%(P<0.05);SS条件下Ci则以-BR-AM处理最高,较其它处理增加9.92%~22.80%(P<0.05)。
三因素方差分析表明,SS×AM和BR×AM相互作用对Pn和Ci有显著或极显著影响,而对Gs和Tr则无显著影响。
2.4 盐碱胁迫下BR与AM真菌对羊草叶绿素荧光参数的影响
由表3可知,与NS相比,盐碱胁迫(SS)导致羊草PSⅡ最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)和光化学猝灭系数(qP)下降,而非光化学猝灭系数(NPQ)增大。无论是否处于盐碱胁迫条件下,接种AM真菌处理(+AM)的ΦPSⅡ和qP均显著高于-AM处理。就PSⅡ最大光化学效率而言,NS、SS条件下,无论油菜素内酯施用与否,与-AM相比+AM处理皆具有较大值,且在油菜素内酯与AM真菌双处理(+BR+AM)下Fv/Fm值最高,分别为8.56、8.26。NS条件下,+BR+AM处理ΦPSⅡ(0.46)、qP(0.56)亦具有最大值;而盐碱胁迫(SS)时,-BR-AM处理NPQ值最大,显著大于其它处理7.98% ~11.66%。
三因素方差分析表明,BR×AM相互作用对ΦPSⅡ、qN和NPQ有显著影响,对Fv/Fm无显著影响。
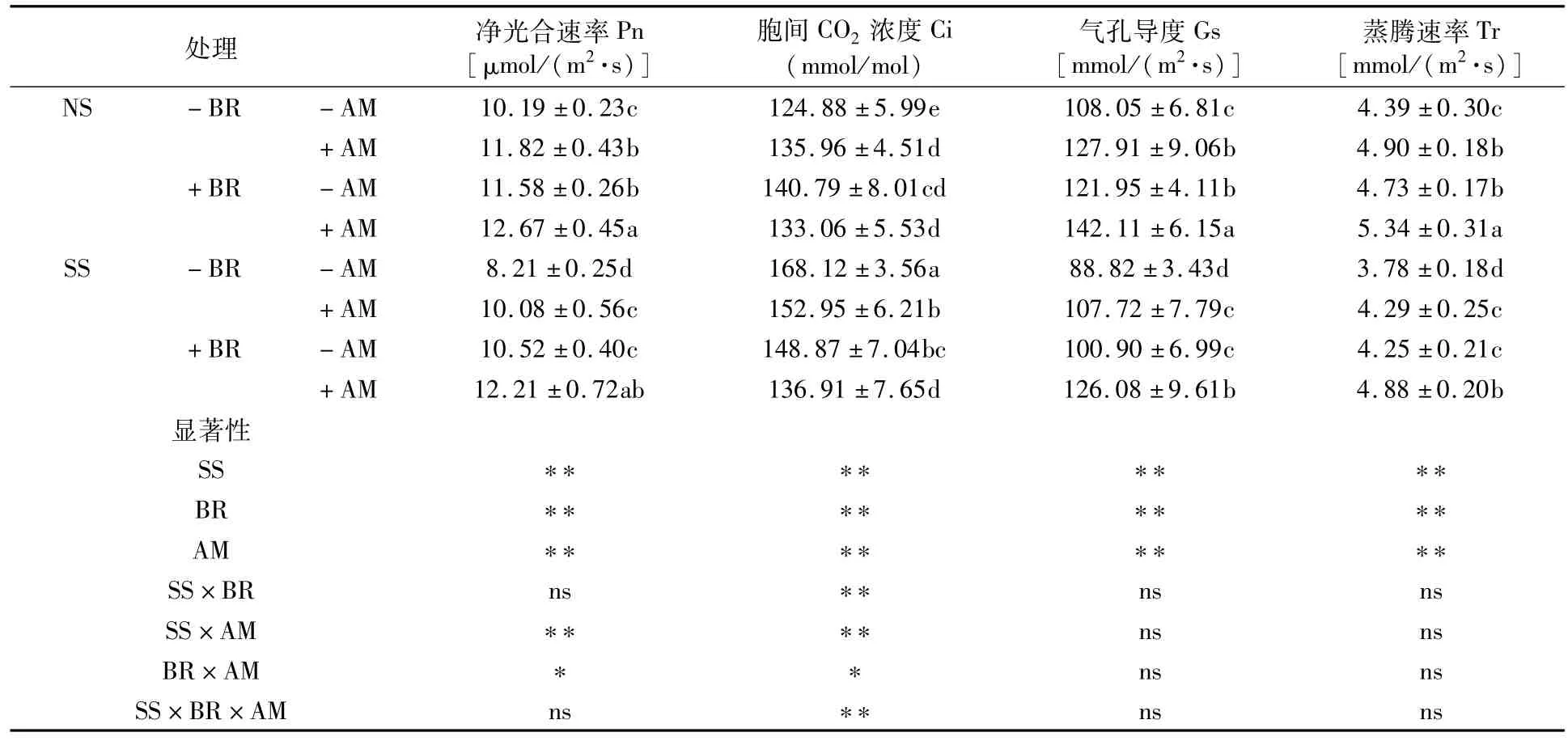
表2 盐碱胁迫下BR与AM真菌对羊草光合气体交换参数的影响
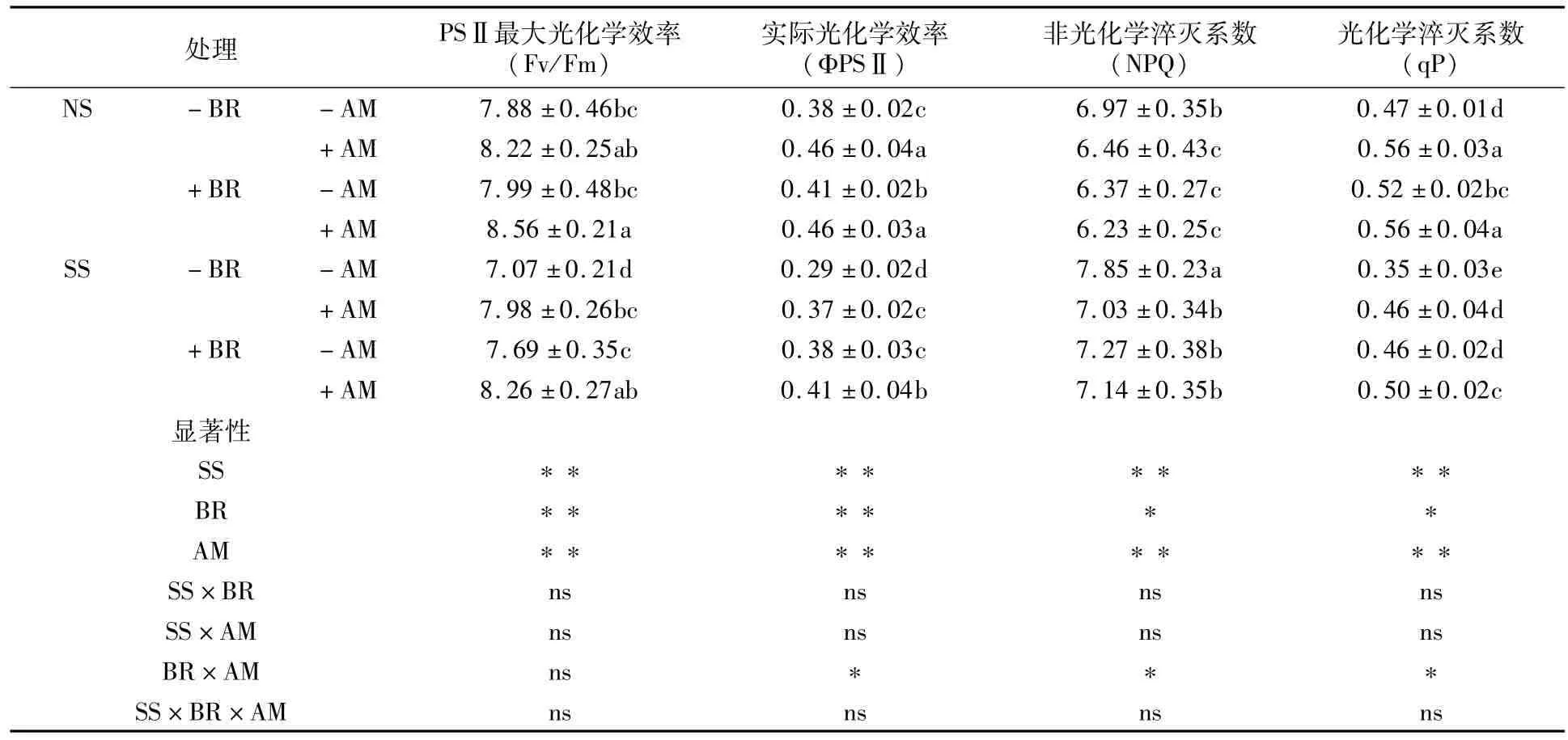
表3 盐碱胁迫下BR与AM真菌对羊草叶绿素荧光参数的影响
2.5 盐碱胁迫下BR与AM真菌对羊草抗氧化酶活性、MDA含量及H2O2浓度的影响
由图3A~D可见,无论盐碱胁迫及油菜素内酯施用与否,接种AM真菌(+AM)较-AM大多显著增加羊草地上部超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,皆增加抗坏血酸过氧化物酶(APX)及谷胱甘肽还原酶(GR)活性;而无论盐碱胁迫及AM真菌接种与否,施用油菜素内酯(+BR)较-BR增加羊草地上部SOD、CAT、APX及GR活性,且大多达到显著水平。
图3E、F显示,与NS相比,盐碱胁迫(SS)均显著增加羊草H2O2浓度和MDA含量。就接种AM真菌(+AM)而言,SS条件下施用油菜素内酯(+BR)较-BR具有较低的H2O2浓度和MDA含量,NS下则无显著差异。就施用油菜素内酯(+BR)而言,SS条件下接种AM真菌处理较-AM降低羊草MDA含量和H2O2浓度,且后者显著差异,但NS条件下没有显著影响。SS条件下,+BR处理H2O2和MDA含量显著低于-BR。
2.6 盐碱胁迫下BR与AM真菌对羊草抗氧化酶相关基因表达的影响
由图4可见,盐碱胁迫(SS)皆明显提高羊草Cu/Zn-SOD、CAT及APX基因表达水平,尤其是Cu/Zn-SOD基因。其中,NS条件下Cu/Zn-SOD基因(图4A)以-BR-AM处理表达水平最低,低于其它处理26.98%~33.33%(P<0.05);SS条件下,BR处理(-BR、+BR)、AM处理(-AM、+AM)之间皆存在显著差异,仍以-BR-AM处理表达水平最低,其它处理较其显著增加134.09%~186.36%。NS条件下,CAT基因(图4B)表达水平BR处理(-BR、+BR)间差异显著,AM 处理(-AM、+AM)间-AM+BR、+AM+BR处理差异不显著;SS条件下,BR处理(-BR、+BR)、AM 处理(-AM、+AM)之间皆差异显著,其中-BR-AM处理表达水平最低,较其它处理降低36.36%~57.57%(P<0.05)。各处理APX生物合成基因表达水平的规律与CAT基因基本一致。
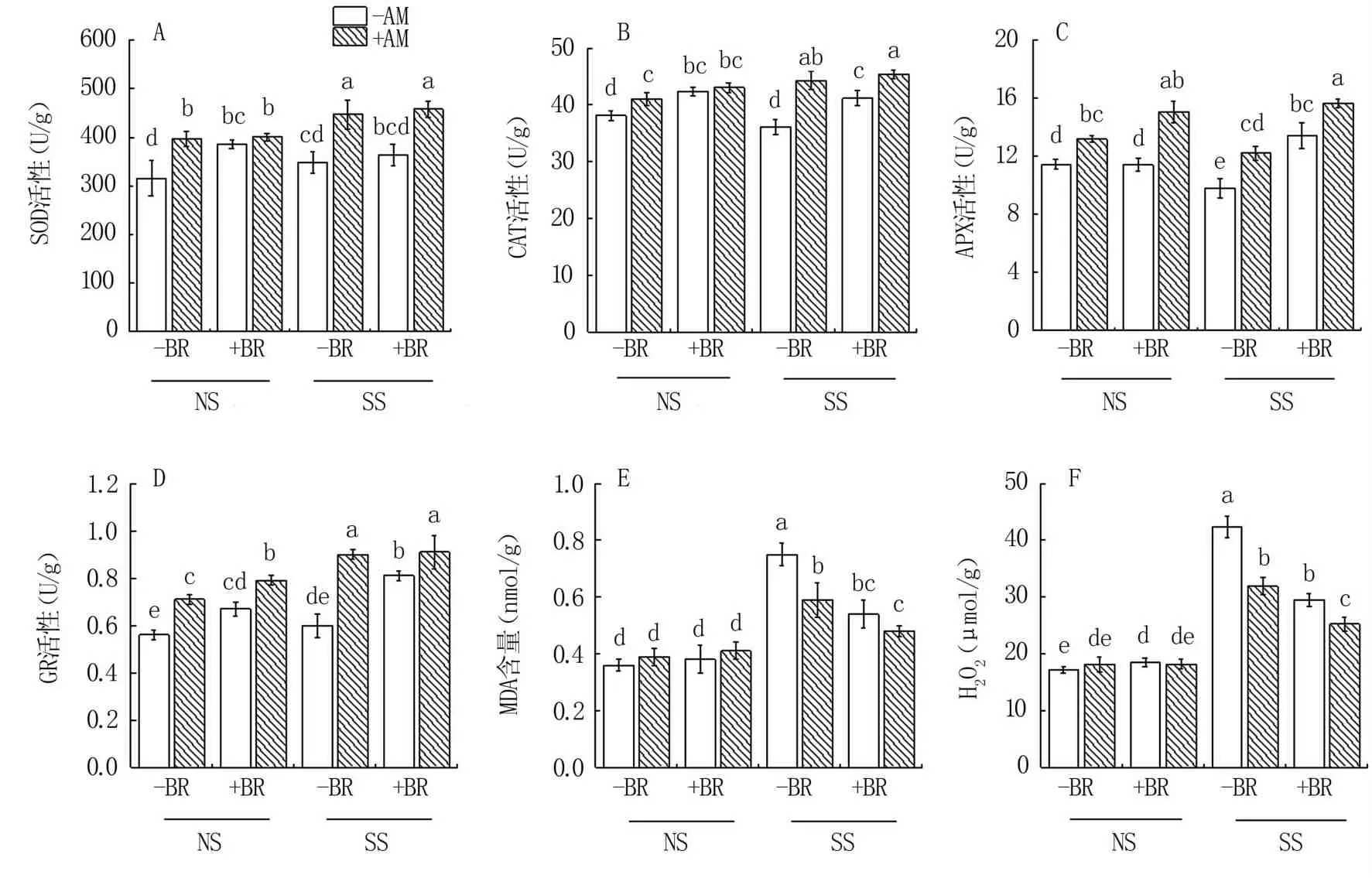
图3 盐碱胁迫下BR与AM真菌对羊草抗氧化酶活性(A~D)、丙二醛含量(E)及H2O2浓度(F)的影响
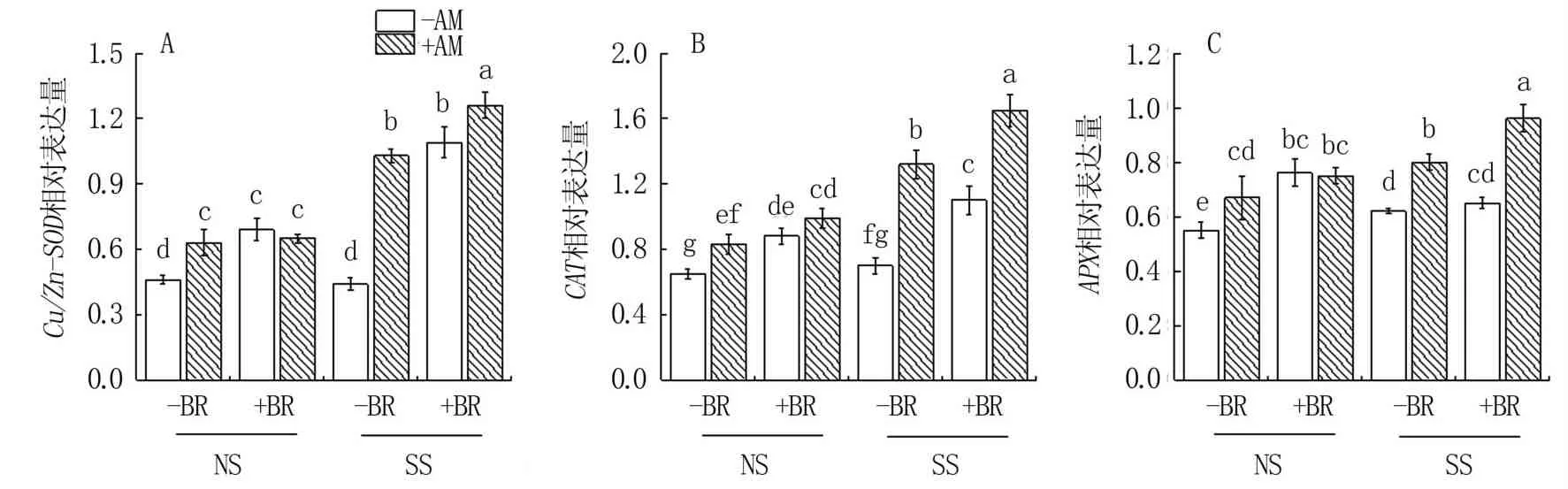
图4 盐碱胁迫下BR与AM真菌对羊草抗氧化酶Cu/Zn-SOD、CAT、APX基因表达水平的影响
3 讨论与结论
土壤盐碱化是农牧业生产面临的主要问题之一。它通过抑制一系列生理生化机制以限制植物的生长发育[2,18]。植物生物量积累及分配是评估其资源获取和环境适应策略的重要功能参数。本研究结果表明,盐碱胁迫可显著降低羊草地上部、根系及总干重,同时接种AM真菌可显著降低盐碱诱导的生长抑制,这与之前的研究结论一致[19]。油菜素内酯(BR)作为一种新的植物生长促进剂,被认为与植物应对非生物和生物胁迫有关[10]。本研究中,无论是NS还是SS(盐碱胁迫)条件下,施用油菜素内酯其生物量积累皆明显高于不施处理,此外,与单一-BR或-AM处理相比,油菜素内酯结合AM真菌接种处理(+BR+AM)羊草的地上部、根系和总干重亦更高,表明BR可促进AM真菌的功能作用。盐碱胁迫(SS)下,-BR处理羊草根系侵染率、孢子密度及菌丝长度皆显著降低,+BR处理菌根生长指标与NS条件下相当;同时无论NS还是SS条件下,+BR处理根系侵染率、孢子密度及菌丝长度皆明显增加。前人研究表明,在共生过程中植物激素是影响AM真菌发育的重要因子,目前已发现独脚金内酯、生长激素及赤霉素等是影响菌根共生的植物激素[6,20]。本研究结果从侧面说明油菜素内酯亦是影响AM真菌发育的功能激素之一[21]。
近年来,叶绿素荧光已被广泛用于阐述亚细胞和叶片发育水平的光合作用的组装、功能和适应化指标[22]。而光合色素含量和光合气体交换参数是决定光合作用强度及进程的重要生理前提,包括当植物暴露于盐碱胁迫时的气孔开合及自然条件下类囊体光合调节[23]。本研究中,盐碱胁迫条件下羊草叶绿素a+b含量整体下降,而叶绿素a含量基本不变。前人研究指出,影响内囊体吸收、传递光能的光合色素主要为叶绿素b,说明影响光合色素含量(尤其是叶绿素b)也是盐碱胁迫影响植物生长的重要参数。同时接种AM真菌羊草色素含量明显增加,这可能是由AM真菌可改善宿主营养水平所致[24]。本研究进一步表明,盐碱胁迫下光合气体交换参数(Pn、Gs、Tr)和叶绿素荧光参数(Fv/Fm、ΦPSⅡ、qP)更低,胞间CO2浓度(Ci)及非化学淬灭系数(NPQ)更高。就本研究的光合指标试验数据来看,无论是NS还是SS条件下,BR处理(-BR、+BR)间以+BR较大,AM处理中以+AM大于-AM,同时各处理皆表现为-BR-AM<+BR-AM<-BR+AM<+BR+AM。NPQ反映PSⅡ反应中心吸收的光能无法用于光合电子传递,而以热能形式损失掉的光能部分[25]。这些结果表明,盐碱胁迫导致气孔关闭进而增加细胞内CO2浓度也是其对植物产生的不利影响之一,而外源性油菜素内酯、AM真菌可以调节气孔打开,有助于PSⅡ光系统并减轻菌根植物中盐碱胁迫引起的光合作用抑制[26]。
正常条件下,植物细胞内活性氧(ROS)的产生和清除之间保持动态平衡[27],而生物/非生物胁迫下ROS会过度积累从而导致氧化酶应激及脂质过氧化。作为ROS中含量最高的物质之一,H2O2参与植物生长、发育及胁迫响应等一系列过程[28]。本研究发现,盐碱胁迫显著提高H2O2浓度,接种AM真菌、施用外源油菜素内酯可减轻盐碱胁迫引发的H2O2积累水平。膜损伤是应激条件下脂质损伤的必然结果[29],丙二醛(MDA)浓度通常被认为是细胞膜稳定性的重要表征[30]。本研究中,盐碱胁迫下油菜素内酯处理大多显著降低羊草H2O2浓度和MDA含量,同时AM真菌接种和油菜素内酯结合处理下MDA含量最低。结合菌根发育指标,本研究表明油菜素内酯可以减少菌根植物中活性氧过度积累引起的膜损伤,进一步说明它对AM真菌发挥作用具有正向叠加作用。
油菜素内酯作为一种天然甾醇类激素,其生理活性远超生长素、赤霉素、细胞分裂素等五大功能激素,是一种活性最高效、广谱、无毒的植物激素,目前已发现其可通过清除过多的ROS从而降低氧化应激带来的细胞损伤[31]。本研究显示,盐碱胁迫下接种AM真菌、施用油菜素内酯处理羊草抗氧化酶(SOD、CAT、APX和GR)活性皆较高,其抗氧化酶生物合成基因(Cu/Zn-SOD、CAT、APX)表达水平亦较高。无论是否接种AM真菌,施用外源油菜素内酯皆提高羊草体内Cu/Zn-SOD、CAT和APX基因的表达水平,并且接种AM真菌情况下抗氧化酶合成基因表达水平皆最高。这些结果表明施用油菜素内酯在提高菌根羊草体内的抗氧化酶活性以维持细胞活性氧在较低水平方面起着重要作用。
综之,本研究中接种AM真菌、施用油菜素内酯皆可有效改善羊草生长、保障光合进程及减轻盐碱胁迫带来的细胞损伤。油菜素内酯可促进AM真菌生长发育,盐碱胁迫环境下,两者结合使用效果更佳。其潜在机制可能是,改善AM真菌生长、保护光合色素、维持光合生理、激活抗氧化酶活性以及降低脂质过氧化和ROS累积。

