应激性高血糖比值与急性缺血性卒中患者临床预后的相关性研究
张东,李治璋,马瑞楠,岳蕴华
近年来,静脉溶栓、血管内治疗及抗血小板药物治疗已经成为急性缺血性卒中治疗及二级预防的标准方式,然而,在临床实践中,即便予以相应积极的治疗,仍有患者存在不同程度的预后不良。既往研究发现卒中时应激血糖水平可能与患者临床预后相关[1-2],但由于应激血糖水平会受糖尿病控制情况、饮食等基础血糖水平的影响[3],限制了其临床适用人群。自Roberts等[3]将应激性高血糖比值(stress hyperglycemia ratio,SHR)引入临床应用后,其与患者预后的相关性逐渐受到人们关注[4-7]。SHR是指机体在强烈因素刺激作用下,机体应激血糖与平均血糖的比值升高的现象。然而,目前关于SHR与急性缺血性卒中患者预后相关的研究仍然较少,因此,本研究对急性缺血性卒中患者资料进行回顾性分析,旨在探讨SHR与发病90 d临床预后的相关性及其预后预测价值。
1 对象与方法
1.1 研究对象 回顾性连续纳入2016年5月-2020年10月在同济大学附属杨浦医院就诊治疗的急性缺血性卒中患者。本研究经同济大学附属杨浦医院医学伦理委员会批准(LL-2021-LW-002)。
纳入标准:符合《中国急性缺血性脑卒中诊治指南2018》的诊断标准[8],结合CT或MRI确诊发病14 d以内的急性缺血性卒中患者。
排除标准:①肾功能衰竭,估计肾小球滤过率(estimated glomerular filtration rate,eGFR)≥60 mL×min-1×(1.73 m2)-1,接受血液透析、腹膜透析或肾移植;②有中度以上贫血(血红蛋白<90 g/L)和严重的血液系统疾病;③缺少完整病史、MRI报告、CT报告、实验室结果和NIHSS。
1.2 方法
1.2.1 资料收集 通过调阅住院医疗系统记录收集患者人口学信息、BMI、血管危险因素、卒中严重程度、实验室检验结果、治疗方式、随访90 d mRS评分及复合血管事件发生情况。人口学信息包括年龄和性别。血管危险因素包括吸烟、高血压、糖尿病、缺血性卒中、TIA、冠心病、心房颤动等疾病病史。卒中严重程度采用NIHSS评估。从入院时医疗记录中提取CRP、白细胞计数、红细胞计数、血小板计数、血红蛋白、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹血糖(fasting blood glucose,FBG)、TG、TC、HDL-C、LDL-C、肌酐、尿酸、Hcy等实验室检验结果,并计算SHR。糖尿病、高血压等既往疾病诊断均根据住院病历系统中病史记录获取。
1.2.2 治疗及随访 所有患者均按照《中国急性缺血性脑卒中诊治指南2018》的标准治疗方案进行治疗[8]。所有患者发病后90 d mRS评分及复合血管事件发生情况,均根据既往电话或门诊随访结果记录获取。
1.2.3 应激性高血糖比值的计算 患者入院48 h内空腹禁食(至少8 h)后清晨(5:00-8:00)抽取静脉血,检测FBG和HbA1c水平。FBG采用己糖激酶法测定,HbA1c采用离子交换色谱法检测。根据说明书得出正常参考范围如下:FBG 3.9~6.1 mmol/L,HbA1c 4.3%~6.1%。使用Nathan等[9]的估计平均血糖(estimated average glucose,EAG)计算公式计算,EAG=(1.59×HbA1c)-2.59。SHR计算公式:SHR=FBG/EAG。
1.2.4 评估方法及分组 将发病后90 d mRS≤2分定义为预后良好,mRS 3~6分或发病后90 d内发生复合血管事件(卒中复发、心肌梗死和血管性原因死亡)定义为预后不良,将患者根据预后分为预后良好组与预后不良组。
1.3 统计学方法 应用SPSS 22.0软件进行统计分析,非正态分布的计量资料以M(P25~P75)表示,组间比较使用Mann-WhitneyU检验。分类资料以例(%)表示,采用χ2检验或Fisher确切概率法进行比较。以发病后90 d临床预后为因变量(预后良好=0,预后不良=1),结合临床,将临床常见危险因素及单因素分析结果P<0.05的因素纳入logistic回归模型以分析SHR升高程度是否为影响患者脑梗死后90 d预后的独立危险因素。使用R 4.1.1软件绘制ROC曲线以评估SHR预测患者发病后90 d临床预后的效果并进行ROC曲线分析。采用Spearman相关性分析SHR与临床因素的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征 根据入组标准共1484例患者纳入研究,年龄范围26~102岁,中位年龄70(62~82)岁,男性948例(63.9%),女性536例(36.1%),中位基线NIHSS 3(2~7)分。发病后90 d内,923例(62.2%)预后良好,561例(37.8%)预后不良。
与预后不良组相比,预后良好组患者中男性比例、吸烟者比例、红细胞计数、血红蛋白和TG水平更高,差异均有统计学意义;年龄,既往有糖尿病、TIA/缺血性卒中、冠心病和心房颤动病史的患者比例,基线NIHSS、CRP、白细胞计数、FBG、SHR、Hcy水平更低,差异均有统计学意义;BMI、高血压、血小板计数、HbA1c、TC、HDL-C、LDL-C、肌酐、尿酸水平上,两组间差异无统计学意义(表1)。
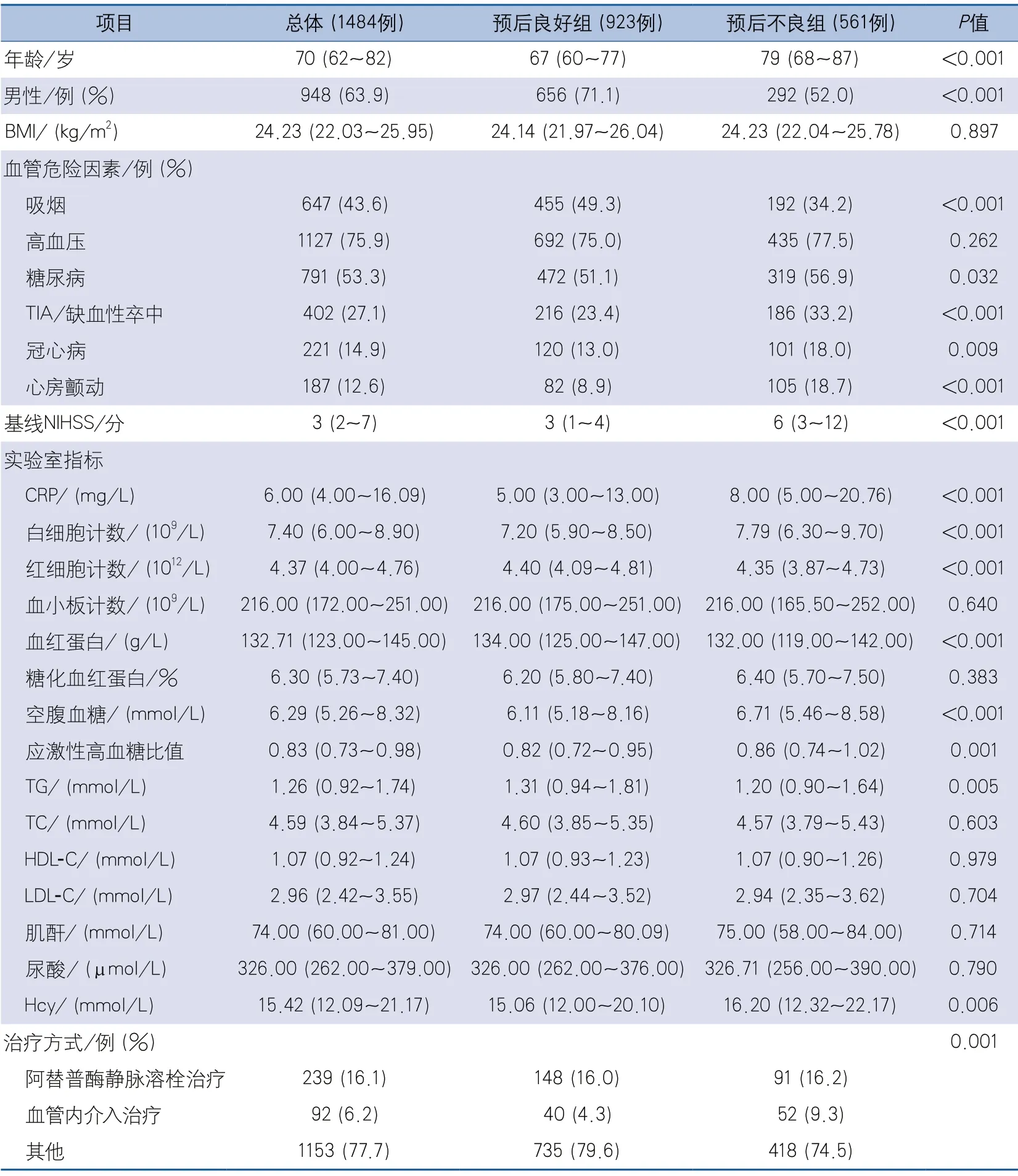
表1 影响急性缺血性卒中患者发病后90 d预后的基线资料单因素分析
2.2 多因素logistic回归分析 将患者按各组SHR四分位数进行分组并按从小到大编秩。在所有患者和非糖尿病患者组,患者90 d预后不良比例随SHR四分位数升高而上升。在校正年龄、性别、既往吸烟、高血压、糖尿病、心房颤动、TIA/缺血性卒中、冠心病、基线NIHSS、肌酐、FBG、HbA1c等因素后,多因素logistic回归分析结果显示,根据四分位数分组的高SHR是急性缺血性卒中患者90 d临床预后不良的独立危险因素。与SHR最低四分位数组相比,最高四分位数组患者90 d预后不良风险升高(OR2.22,95%CI1.26~3.91,P=0.006;趋势P=0.004)。亚组分析结果显示,在非糖尿病患者组,这一结果差异同样有统计学意义(OR2.11,95%CI1.19~3.75,P=0.010;趋势P=0.002)。然而,在糖尿病患者组并未发现统计学意义(OR1.53,95%CI0.69~3.42,P=0.298;趋势P=0.423)(表2)。
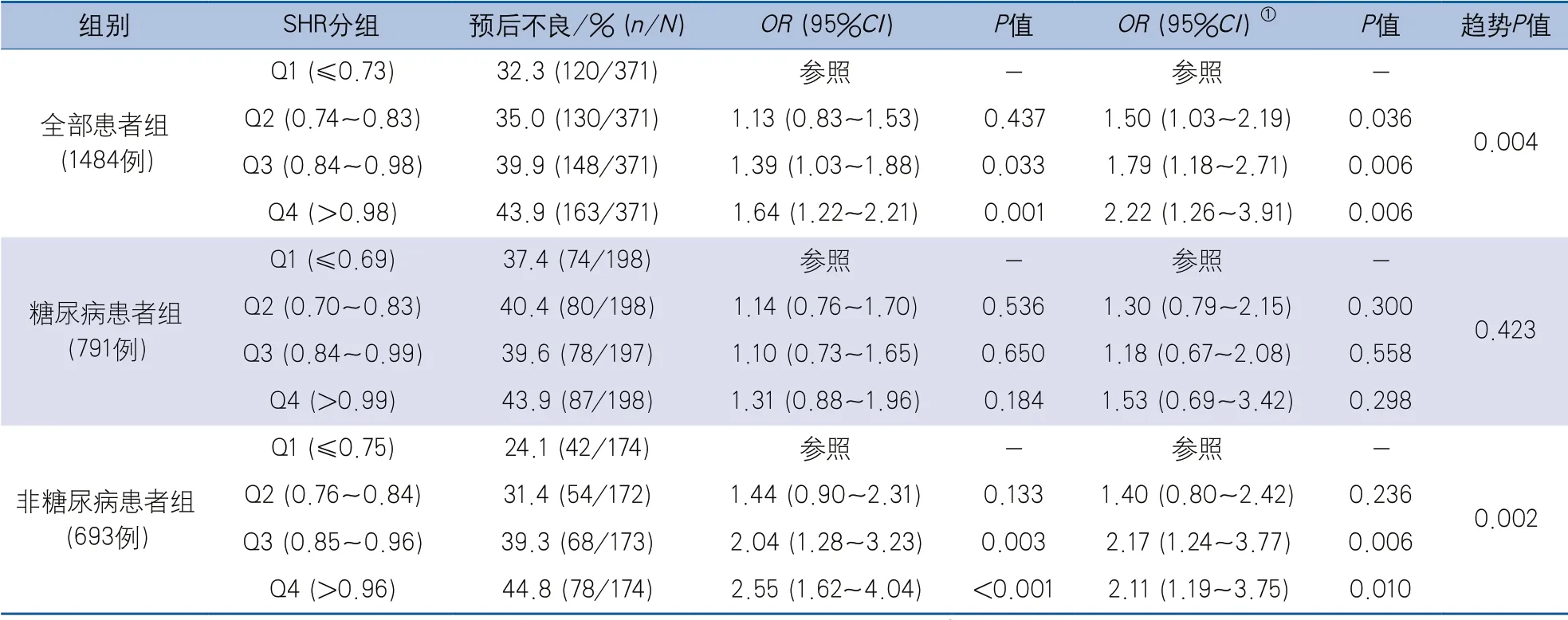
表2 SHR对急性缺血性卒中患者90 d预后不良的影响logistic回归分析
2.3 SHR对发病后90 d临床预后的预测价值 ROC曲线分析结果显示:在所有患者中,SHR预测急性缺血性卒中发病后90 d预后不良的AUC为0.552(95%CI0.526~0.578,P=0.001),最佳截断值为0.84,敏感度为52.94%,特异度为56.12%;在非糖尿病患者组,SHR预测急性缺血性卒中发病后90 d预后不良的AUC为0.600(95%CI0.563~0.637,P<0.001),最佳截断值为0.87,敏感度为52.48%,特异度为64.97%;在糖尿病患者组,SHR预测急性缺血性卒中发病后90 d预后不良的AUC为0.524(95%CI0.489~0.559,P=0.254),不存在统计学意义(图1)。
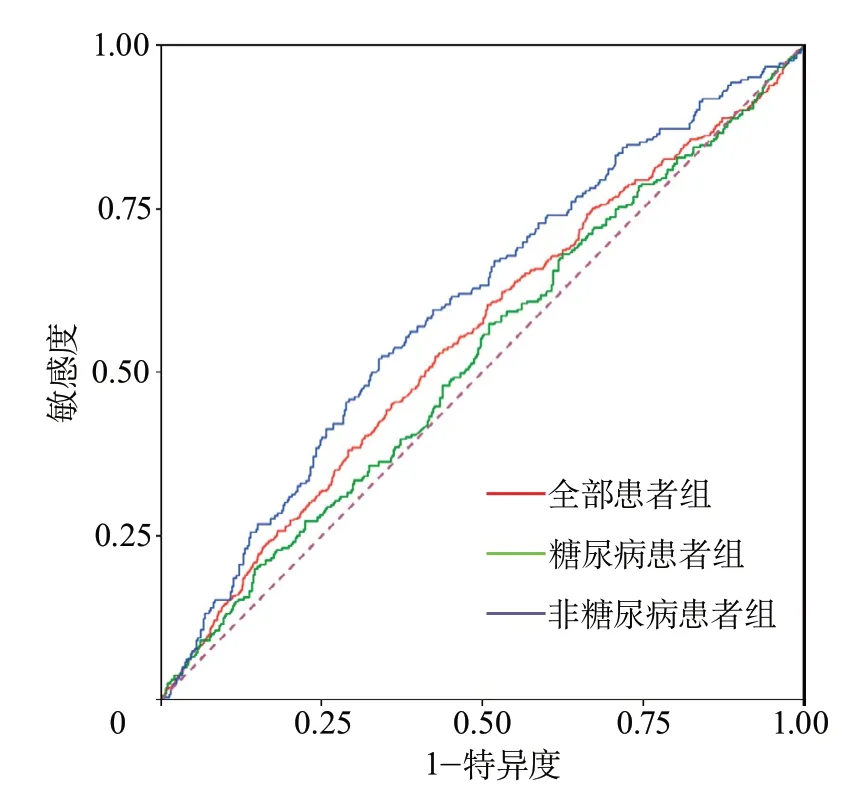
图1 各组应激性高血糖比值预测急性缺血性卒中患者发病后90 d不良预后的ROC曲线
2.4 SHR分组与入院时NIHSS、CRP、白细胞计数、血小板计数相关性分析 由于SHR反映了应激状态,因此本研究将SHR与卒中急性期应激反应可能相关的指标——NIHSS、CRP、白细胞计数、血小板计数进行Spearman相关性分析,结果显示,SHR分组与基线NIHSS(r=0.115,P<0.001)、CRP水平(r=0.079,P=0.002)、白细胞计数(r=0.126,P<0.001)呈正相关,与血小板计数呈负相关(r=-0.094,P<0.001)。
3 讨论
SHR是一类新型的应激血糖水平定量表示方式,能够考虑到既往糖尿病或既往糖尿病伴血糖控制较差的情况,通过校正基础血糖水平[10-11],从而反映出机体发生急性疾病时血糖真正升高程度,已被证实与疾病预后相关[12]。既往研究表明,以血糖/糖化血红蛋白(glucose-to-glycated hemoglobin ratio,GAR)或血糖/糖化白蛋白计算的应激血糖比值升高与接受静脉溶栓的急性缺血性卒中患者的不良预后密切相关[13],会增加1年内发生严重神经功能缺陷和死亡的风险以及卒中复发风险[14-16]。但考虑到这两种计算方式相对来说较难以理解,可能会限制其接受程度,如Nathan建议将糖化血红蛋白转化为更易理解的平均血糖[14-16],SHR使用EAG替代糖化血红蛋白或糖化白蛋白,更加科学且易被理解。然而,目前有关SHR对急性缺血性卒中患者临床预后影响的研究相对较少,且主要集中于接受血管内介入和静脉溶栓治疗的患者[17-19]。由于这部分患者本身病情较重,预后不佳比例更高,且血管内介入及静脉溶栓治疗很可能改变其原本预后轨迹,因此SHR对这类患者预测价值可能有限。所以,本研究选择SHR作为研究指标,以全部急性缺血性卒中患者作为研究对象,探讨相对SHR对急性缺血性卒中患者临床预后的影响。
同既往研究结果相似,本研究表明SHR是急性缺血性卒中患者90 d临床预后的独立预测因子,亚组分析表明,在非糖尿病患者组,预测效果更显著。尽管本研究结果与以其他形式表示的SHR研究结果相似,但由于其表示方式不同,对患者预后定义不同,且考虑到回顾性研究的缺陷,认为研究结论仍需要多中心前瞻性研究进一步证实,同时,对于不同方式计算的SHR对卒中预后预测效果的异同也需进一步分析。
目前SHR与急性缺血性卒中患者卒中严重程度及预后相关的病理生理机制仍不清楚,本研究通过相关性分析表明SHR主要和卒中严重程度、炎症反应相关,SHR越高,患者入院时卒中越严重,炎症反应越强烈。这与其对卒中预后影响的可能机制具有一致性,并可能存在一定的恶性循环效应。一方面,卒中发生作为应激事件,导致下丘脑-垂体-肾上腺轴和交感神经自主神经系统的激活[20]。神经内分泌激素的紊乱促进胰高血糖素的分泌[21-22],抑制胰岛素释放,导致胰岛素抵抗,促进肝脏糖异生和糖原分解[23],引起血糖升高。因而卒中程度越严重,其带来的应激反应越强烈,从而SHR水平越高。另一方面,高血糖会导致炎症和血管收缩因子释放[23],动物实验证实,高血糖可以通过NO途径介导脑血管痉挛[24],也可以通过超氧化物产生对血小板功能产生有害作用,诱导血小板聚集[25],激活凝血系统,抑制纤溶系统,产生自由基,使患者易受到缺血性损伤。同时高血糖还可能导致血脑屏障受损,加剧脑水肿程度,造成更严重的缺血性脑损伤[26]。此外,血糖升高导致卒中患者血管内皮功能障碍和氧化应激加剧[27],脑血流量降低并伴有脑血流量自我调节受损,加剧缺血性损伤[28]。最后,高血糖可能对缺血半暗带有直接神经毒性,导致神经元损伤[7,25,29],加重卒中严重程度。这一系列反应可能引起恶性循环,最终影响患者临床预后。
SHR与急性缺血性卒中患者发病后90 d预后的ROC曲线分析结果显示,在全部患者组SHR预测预后不良的AUC为0.552,截断值为0.84,敏感度为52.94%,特异度为56.12%。在非糖尿病患者组,AUC为0.600,其截断值为0.87,敏感度为52.48%,特异度为64.97%。在本研究中,各组ROC的AUC均<0.7,且SHR对患者发病后90 d预后不良预测的敏感度和特异度均欠佳,因此,SHR预测患者发病后90 d预后不良的价值可能有限,这可能与影响脑梗死患者预后的不良因素较多有关,单一指标或不能充分反映整体情况,需要联合两种或两种以上指标以进一步提高预后预测价值。
综上所述,SHR与急性缺血性卒中患者发病后90 d临床预后相关,并对患者预后可能具有一定预测价值,尤其是在非糖尿病患者人群。同时,SHR与卒中严重程度、炎症反应可能相关。根据研究结果和以往的研究,SHR或可有助于确定临床预后不良的人群,为临床及早采取措施、调整治疗方案改善患者不良预后提供临床资料。
虽然本研究发现SHR可能与早期急性缺血性卒中患者预后存在联系,但是仍然存在一些不足之处。首先,作为单中心、回顾性研究,由于研究方法本身的限制,并不能得出SHR与预后的因果关系,研究结论仍有待多中心、大样本的前瞻性研究证实。其次,研究可能存在一定选择偏倚,这可能会限制其预测价值。再次,本研究并未动态检测SHR,与单次测量相比,动态监测SHR可能是一种更强的预后预测工具。因此,在未来的研究中,将进一步扩大研究人群,动态检测SHR及其他形式相对应激血糖比值,以进一步探讨相对应激血糖比值对急性缺血性卒中预后的影响。
【点睛】应激性高血糖比值和卒中严重程度、炎症反应相关,是急性缺血性卒中患者90 d预后不良的预测因素。

