CRISPR/Cas基因编辑技术及其在微藻研究中的应用
陈映丹 张扬 夏嫱 孙虹霞
(1. 遵义医科大学珠海校区 免疫与病原生物学教研室,珠海 519041;2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室,广州 510301)
基因编辑技术是指在基因水平上,对目标基因进行精确插入、删除和修饰,从而改变基因的结构与功能的生物技术。近年来,基因编辑技术已从锌指核酸酶(zinc finger nuclease,ZFN)技术、转录激活因子样效应物核酸酶(ranscription activator-like effector nucleases,TALEN)技术,发展到成簇的规律间隔的短回文重复序列CRISPR/Cas(clustered regularly interspaced short palindromic repeats/CRISPR associated)核酸酶系统。其中,ZFN和TALEN技术依赖于DNA序列与蛋白质模板的特异性结合,设计和组装非常繁琐,且成本较高。相比之下,CRISPR/Cas技术作为一种新兴的基因组编辑工具,能够引导gRNA对DNA的识别及编辑,具有成本低、设计简单、高效、特异的显著优势。
微藻作为初级生产者[1],种类繁多,约有5万余种,且分布广泛,生存条件多样化,甚至可在高温、高盐等极端条件下生存。目前,其在食品、工业、农业、医学等多个领域均有应用[2],具有改善免疫功能、预防心血管疾病、调节土壤理化性能、生产生物柴油、降解重金属等功效[3-10]。另一方面,随着人口的增长,资源储备的枯竭,以及土地资源和自然环境资源等的不可再生性,使得人们面临着资源短缺和环境污染的巨大挑战,对微藻进行遗传改良,以寻找可替代的资源,成为了人们应对挑战的重要举措之一。然而,野生微藻因其自身碳固定率、油脂积累率和产氢效率都较低,加之商业成本高昂等原因,严重影响了其大规模应用。因此,寻找并利用一种强大、廉价、精确的基因编辑技术,建立更加经济绿色的生产工艺,是克服这些问题并实现后期大规模生产的重要策略,其中,CRISPR系统的优越性,无疑可为微藻的遗传改良和应用提供重要的支持。
鉴于此,本文在简要介绍CRISPR/Cas基因编辑技术的发展历程的基础上,讨论了在微藻中应用较为成熟的Cas9和Cpf1两种系统的不同特征,着重阐述了CRISPR技术在微藻领域的发展方向和应用,并探讨了CRISPR基因编辑技术在微藻生物资源开发利用上的发展前景,以期为CRISPR/Cas系统在微藻基因编辑的相关研究提供参考。
1 CRISPR/Cas基因编辑技术概述
1.1 CRISPR/Cas基因编辑技术的发展历程
CRISPR/Cas可通过特异性RNA引导Csa蛋白对DNA进行靶向切割,是迄今为止已知的原核生物中唯一的适应性免疫系统。自1987年,Ishino等[11]在研究大肠杆菌碱性磷酸酶同工酶转化时,发现了串联的、间隔的短回文重复序列,并在其他细菌中得到鉴定[12-17]。但直到2002年,才正式将存在于细菌和古细菌中的有规律的重复序列命名为成簇的规律间隔的短回文重复序列CRISPR,并首次发现在其附近还有CRISPR相关基因Cas[18]。之后,西班牙学者Mojica等[19]发现CRISPR间隔序列与噬菌体和外来质粒序列具有同源性,推测CRISPR可能与细菌的免疫防御有关联。随后,Barrangou等[20]证明了CRISPR/Cas系统参与了细菌对噬菌体免疫防御作用的功效。2008年和2010年,CRISPR的干扰工作[21]及其干扰机制[22]分别得到了揭示。此时,科研人员已经对CRISPR/Cas系统的作用机制有了基本了解(图1)。
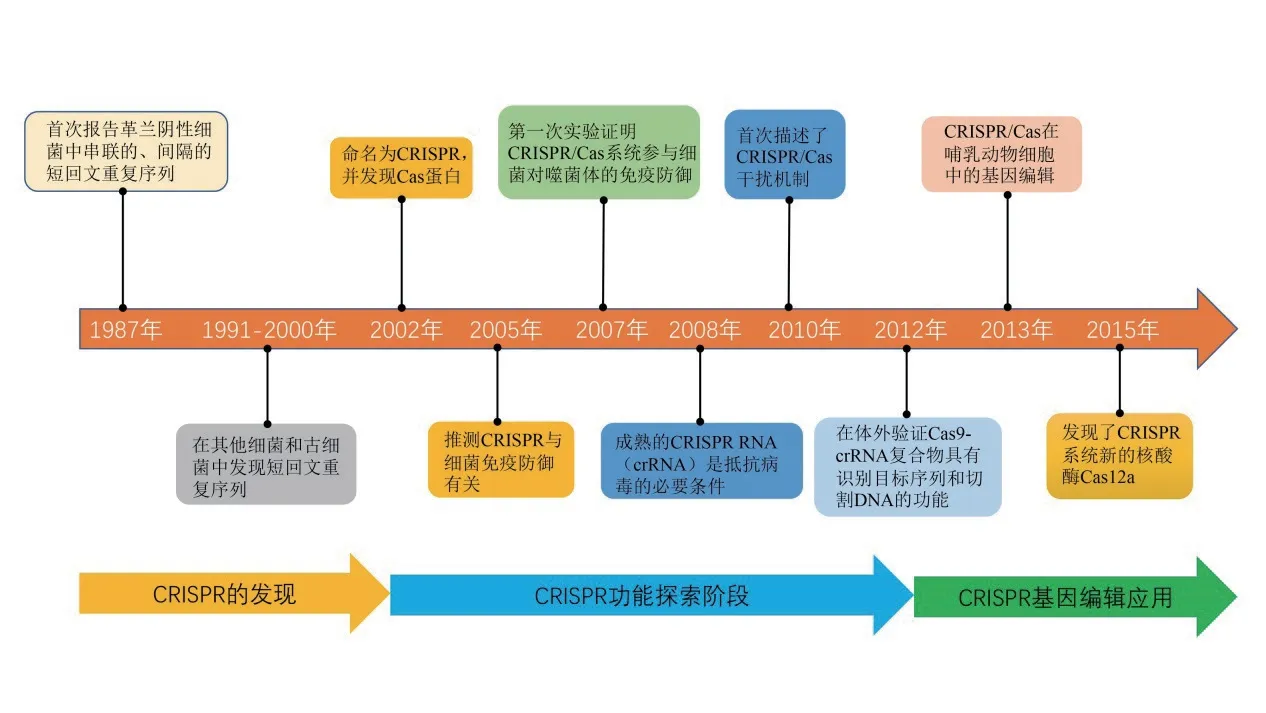
图1 CRISPR研究发展过程时间线Fig. 1 The time line of the CRISPR development process
2012年,美国Emmanuelle和Jennifer实验室发现嗜热链球菌CRISPR/Cas系统的Cas9-crRNA复合物在体外引入了DNA特定位点的双链断裂,该断裂序列可与crRNA互补,证实Cas9-crRNA复合物作为由RNA引导的核酸内切酶,具有识别目标序列和切割DNA的功能[23-24]。2013年,张锋团队首次使用CRISPR/Cas9工具在哺乳动物细胞中进行了有效的基因组编辑[25]。自此,使用CRISPR/Cas9敲除靶基因逐渐成为生物科技领域的热门研究技术,为基因功能研究、动植物育种和生物量产率增加提供了新的技术支持。
1.2 CRISPR/Cas基因编辑技术的分类
CRISPR系统包括一段成簇的短回文重复序列和一系列Cas蛋白编码基因,如Cas 1、Cas 2、Cas 4和效应蛋白Cas 9、Cpf 1等,进一步细 化,其可被分为2大类、6种类型和33个子类型(图2)[26]。其中,Class I类系统包括type I、type III以及type Ⅳ,依赖于多亚基蛋白质复合物,可利用几种Cas蛋白和crRNA形成效应复合物;Class II类系统包括type II、type V以及type VI,仅使用单一效应蛋白,利用大量的单组分Cas蛋白与crRNA结合以介导干扰过程。目前,由于克隆及在宿主细胞传递的便利性,Class II类效应子核酸酶应用更为广泛,而type II的CRISPR/Cas9系统和type V的CRISPR/Cpf 1系统,是目前研究最深入、应用最广泛的两种类型(表1)。

表1 Cas9和Cpf1的不同特征Table 1 Distinct characteristics of Cas9 and Cpf1
1.2.1 依赖于Cas9的CRISPR基因编辑 化脓性链球菌Cas9核酸酶(SpCas9)是在植物、动物和微藻中进行基因组编辑最常用的Cas9变体。CRISPR/Cas9免疫防御系统主要包含两部分,引导RNA(gRNA)和Cas9蛋白。gRNA可结合到一个特定的目标DNA序列,并通过一个简短的DNA序列,邻近原间隔相邻基序(protospacer adjacent motif,PAM)定位,通常是“NGG”[27]。由于 PAM 序列位于外来的 DNA 的原始间隔区旁边,不在基因组 CRISPR 基因座中的间隔区旁边,因此 PAM 有助于区分自身和非自身 DNA,从而防止自身免疫的产生。Cas9具有核酸酶活性,负责切割DNA双链。当形成gRNA-Cas9复杂形式,Cas9在PAM序列前的3个碱基点进行双链切割,主要产生平末端[24];切割点通常经过非同源端连接((non-homologous end joining,NHEJ)修复,这种连接通常容易出错,导致切割点插入或删除,而这种突变通常会导致移码突变,影响蛋白质转录翻译,从而破坏基因的功能。
1.2.2 依赖于Cpf1核酸酶的CRISPR基因编辑 2015年,张峰团队发现了CRISPR系统新的核酸酶Cas12a(后期更改命名为Cpf1)[28]。CRISPR/Cpf1系统与Cas9系统在功能原理上相似,但与Cas9系统相比,存在着以下差别。首先,Cpf1相关的CRISPR阵列在转录为成熟的crRNA的过程中,无需tracrRNA和RNase III参与;其二,Cas12识别富含T的更长的PAM序列“TTTN”,Cas9识别富含G的PAM序列“NGG”;其三,Cpf1蛋白切割产生了黏性末端[28]。
与Cas9系统相比,CRISPR/Cpf1系统更具有一些优势[29],主要表现Cpf1可在不需要tracrRNA的特性的条件下更简单地制备指导RNA,且Cpf1具有的单个核酸酶结构域(RuvC)体积比Cas9小,编辑效率更准确有效;Cpf1蛋白切割产生的黏性末端,有利于目的基因利用非同源重组的方法插入位点;Cpf1识别更长的原间隔子相邻基序(PAM),减少了其在富含GC的基因组上被误读的机会,从而导致靶标突变效率大大提高[29]。在PAM识别后,Cpf1将目标DNA切割到PAM位点的下游更远的位置,以使其在非同源末端连接过程中得以保留。而在Cas9中,PAM位点靠近切割位点通常会导致其破坏,从而排除了之后的编辑工作。CRISPR/Cpf1基因编辑可将目标基因重新定位以进行重复编辑,从而提高了目标效率。
1.2.3 CRISPR基因调控 CRISPR干扰和CRISPR激活 CRISPR/Cas 系统还可通过催化失活的 DNasedead Cas(dCas)变体进行基因调控,用于CRISPR干 扰(CRISPR interference,CRISPRi)和CRISPR激活(CRISPR activation,CRISPRa)。如果Cas9的两个蛋白结构域(HNH和RucV)失活,即可突变为一个保留了靶向DNA结合能力而无催化活性的Cas9蛋白(dCas9)[30-31]。dCas9是调节目标基因转录水平的工具,基因抑制的程度可以通过调节dCas9的表达或调节gRNA的结合位置来控制。为了提高效率,dCas9蛋白通常与各种转录抑制因子(如KRAB)或者转录激活因子(如VP64)融合,使目标基因在双重效应下受到最大的抑制或上调。此外,与传统的基因组编辑方法相比,使用CRISPRi造成的抑制是可逆的过程,甚至可以同时调节多个靶基因的表达。基于此,CRISPRi具有发展为一种操纵和修饰代谢途径关键基因工具的潜能。
2 CRISPR/Cas基因编辑技术在微藻中的 应用
作为一种新兴的生物技术工具,CRISPR基因编辑技术在生物的基因功能研究,以及动植物品种如水稻、高粱、小麦、大豆和玉米等的遗传改造等方面展现出了广阔的应用前景[32-37]。随着技术的成熟和基因组测序成本的降低,CRISPR技术在微藻上的应用也得到了快速发展。据报道,CRISPR技术在微藻中的应用最早是在模式生物莱茵衣藻中实现的[38],随着莱茵衣藻[39]和小球藻[40]等藻类基因组测序的完成,明确的遗传背景更有力地推动了其在衣藻、蓝藻等多种微藻基因工程中的研究和应用。将CRISPR技术应用于微藻中,不仅可证明特定基因的功能,开发具有工业性状的菌株,而且与其他工程核酸酶相比,还具有高效率,高准确性和简便性的特性。
2.1 衣藻
对模式藻莱茵衣藻的基因工程研究早在几十年前就开始了[41]。莱茵衣藻具有单细胞形态,培养条件简单,可自养、异养、混合营养生长等特征,是首批对其线粒体和叶绿体基因组进行测序的藻类之一[42]。同时,许多异源转基因已在衣藻中表达,包括许多抗生素抗性标记、报告基因等,这些工具的开发对研究基因表达和筛选转化细胞至关重要。这些特征使得其作为早期研究基因编辑技术的模型藻类。
自2014年CRISPR/Cas9系统首次被应用在莱茵衣藻的基因编辑中,Jiang等[43]也成功将Cas9和sgRNA转入衣藻细胞进行了短暂表达,并成功敲除了莱茵衣藻中内源的雷帕霉素敏感性基因FKB12。然而,在超过109个细胞的16次独立转化实验中,仅有一个带有雷帕霉素抗性的突变体菌落产生,表现出极低的转化效率,并提示Cas9潜在毒性的存在。为了避免Cas9载体引起的细胞毒性和脱靶效应,2016年,Shin等[44]在体外合成Cas9-gRNA核糖核蛋白复合物(RNP),并通过电穿孔方法直接将其转化至莱茵衣藻中,成功在MAA7,CpSRP43和Ch1M三个不同基因座上获得CRISPR/Cas9诱导的突变,与载体驱动转化相比,RNP方法对基因沉默的效率提高了100倍,而且无非靶向效应。
作为具有多种代谢工程技术和工具的模式生物,莱茵衣藻可用于黄斑色素的工业生产。叶黄素和玉米黄质是膳食类胡萝卜素,可降低年龄相关性黄斑变性,在维持眼睛健康方面发挥着关键作用。Baek等[45]使用预组装的RNP递送方法敲除玉米黄质环氧化酶(zeaxanthin epoxidas,ZEP)基因,发现ZEP敲除突变体可持续产生玉米黄质,光合产量也得到了大幅度提高[46]。再者,由于Cas9蛋白只具有瞬时活性并随后被细胞内源蛋白酶降解,因此RNP也减少了脱靶效应和细胞毒性。
2017年,Cpf1核酸酶第一次在莱茵衣藻进行了试验,通过将Cpf1 RNP与单链寡聚脱氧核苷酸(ssODNs)作为DNA修复模板,在莱茵衣藻中实现了同源定向的DNA替代,其共转染可达到10%的精确效率,且Cpf1 RNP单独转化FKB12基因的靶向效率与Cas9 RNP相似。同年,研究人员首次使用CRISPRi系统用于莱茵衣藻中脂质的基因调控[47]。磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)是脱羧酶家族中的一种关键酶,它与磷酸烯醇丙酮酸(Phosphoenolpyruvate,PEP)形成草酰乙酸直接相关,草酰乙酸流入三羧酸循环以进行蛋白质合成。通过下调PEPC1编码蛋白的表达,调节碳在脂质中的流向,成功提高了莱茵衣藻的生物量和脂质积累速率。MAA7是编码色氨酸合酶 β-亚基的基因,无功能的MAA7突变体可以在含有5-FI色氨酸类似物的培养基上进行营养缺陷型选择。为解决低下的基因编辑效率,2020年,研究者选择研究MAA7基因,使用预先组装的RNP复合体,成功靶向敲除莱茵衣藻MAA7基因[48],通过MAA7突变体的选择和鉴定,评估MAA7的基因编辑效率[44];通过在RNP上添加双链HDR模板,评估靶向MAA7的HDR敲入效率,阐明了优化RNP复合物的浓度和转化方案对于实现高效率的靶向敲除的重要性;同样的,重组位点和HDR模板的浓度的优化对于实现高效率的HDR介导的敲入也至关重要[48]。同时,该优化方法也可以扩展到其他具有工业潜力的藻类。
2.2 蓝藻
蓝藻以其能利用太阳光和CO2,且遗传操作适应性好的特性,成为了生产生物燃料和生物衍生化学品的理想底盘生物[49-50]。然而,蓝藻基因组的修饰由于部分蓝藻是寡倍体或多倍体而变得耗时和复杂。直到CRISPR/Cas技术对基因组编辑方式的改变,使得蓝藻的代谢工程有了新的突破。
2016年,研究者第一次在蓝藻中使用了CRISPR/Cas9系统。nblA 基因是聚球藻 2973 中藻胆体降解的必需元素。野生型聚球藻 2973 菌株在缺乏硝酸盐的培养基中生长时表现出黄色漂白效果,但nblA删除菌株具有明显的非漂白表型,并在相同条件下保持绿色。通过选择敲除nblA基因,可观地表明了在蓝藻中瞬时Cas9表达可以实现基因编辑,并且Cas9的存在提高了编辑效率[51]。随后,Li及其同事通过敲除glgC基因,使蓝藻中的大部分碳通量从糖原转移到琥珀酸酯,从而产生更高水平琥珀酸酯的glgC缺失突变体[52]。但也发现高浓度的Cas9具有毒性,可降低蓝藻细胞的生存力,从而促使人们探索通过使用新的Cpf1核酸酶来克服这一障碍。2016年,Ungerer研究团队[53]对Cpf1和Cas9两种蛋白的毒性评估结果显示,Cpf1的毒性显著低于Cas9,Cpf1是蓝藻基因组编辑的较为合适的核酸酶,并首次通过2种蓝藻的缺失突变、点突变以及插入突变,研究了Cpf1系统的多功能性[53]。
基因的敲除或敲入有时会损害宿主生物的生存力,但CRISPRi为蓝藻工程学提供了另一种可行的方法,该方法依赖于无酶活性的dCas9,这对不能删除而只能降低其表达的必需基因的研究尤其重要。Yao等[54]首次在蓝细菌中引入了CRISPRi系统通过下调phaE和glgC基因,降低多羟基丁酸酯和糖原的产生,抑制phaE基因有效消除了集胞藻属中的聚羟基丁酸酯(polyhydroxybutyrate,PHB)的合成,抑制glgC基因可使糖原合成大幅度降低。同样的,Huang等[55]通过抑制glgC、sdhA和sdhB基因,下调糖原合成,使琥珀酸水平提高了12.5倍。Higo及其同事采用CRISPRi技术,通过抑制鱼腥藻glnA基因不仅可高效生产铵盐,还可控制细胞以诱导剂依赖的方式开启和关闭铵的产生[56]。然而,研究人员在2018年发现dCas9可改变大肠杆菌的形态,使其成异常的丝状形态,推测dCas9影响了细菌的细胞分裂,并对细胞膜的结构产生了影响[57]。这促使了研究者对不同Cas蛋白CRISPR干扰系统开展了进一步的研究。甲基-赤藓糖醇-4-磷酸(methylerythritol-4-phosphate,MEP)途径中关键酶的过度表达和融合导致蓝藻光合角鲨烯的大量生产,首次蓝藻中使用CRISPR/dCpf1系统,有效阻止了转录启动,通过抑制acnB、cpcB2关键基因,提高了光合角鲨烯的产量[58]。由此可见,dCpf1介导的CRISPRi系统极大地促进了蓝藻代谢工程的研究,是提高蓝藻生物量切实可行的技术和方法。
CRISPR的另一个功效是多路复用,即多个基因可以并行编辑而不是单独靶向。Kaczmarzyk等[59]的研究中运用CRISPR多路复用的作用,将脂肪酰基重新定向至脂肪醇合成,同时抑制了6个编码消耗酰基ACP途径的酶的天然基因,使C18脂肪醇生产率提高了3倍左右。多路复用开辟了应用组合方法优化蓝藻的可能性,反过来又使蓝藻代谢过程得到更大更广的覆盖。总之,CRISPR技术的出现及广泛应用无疑加速了蓝藻代谢工程的研究和进展。
2.3 硅藻
硅藻是单细胞真核生物,在全球海洋中碳和硅的循环利用中起着至关重要的作用。同时,由于脂质的高水平积累,硅藻被认为是生物燃料生产的重要候选者,在药物,化妆品,营养补充剂和生物燃料中具有潜在应用价值。因此,了解CRISPR技术在硅藻工业上的开发应用也极为必要。
2016年,Nymark等[60]首次在硅藻中报道了基于Cas9的基因组编辑技术,通过转化Cas9-gRNA质粒,对8个突变体的高光敏性生长测定和qRT PCR进行了表征,获得了生长缓慢,对高光的敏感性增强的CpSRP54突变菌株。同年,Hopes等[61]使用两个sgRNAs诱导脲酶基因的精确删除,证明在硅藻Thalassiosira pseudonana进行基因编辑的可行性。
然而,CRISPR / Cas9技术在硅藻中的优化改进仍在进行中,以求突变型菌株的生产不被时间、步骤、脱靶等限制住。2018年,Stukenberg等[62]通过优化CRISPR/Cas9载体构建,简化了筛选步骤,并诱导了单等位基因和双等位基因突变。此外,通过CRISPR / Cas9切口酶进行基因组编辑是另一种改良方法。2020年,在海洋硅藻中使用Cas9切口酶进行基因组编辑诱变,靶向TpθCA3基因编辑[63]。通过这种修饰,使得Cas9诱变中潜在的脱靶频率被最小化。同样的,Moosburner等[64]通过将Cas9转录融合到2A肽的选择标记上,为Cas9基因选择抗生素,减少了生产和验证突变细胞系的时间。然而,Cas9切口酶仅适用于少数几种模式生物,在微藻的应用报道较少。
2.4 其他
微藻具有巨大的物种多样性,在生态系统、水产养殖以及生物能源,粮食和饲料部门中都发挥着重要作用。除了上述藻类,CRISPR技术也在不断地的探索性地应用在其他非模式藻类上。2016年,以工业产油微藻Nannochloropsis oceanica菌株IMET1为模型,建立了一种有效的基于CRISPR / Cas的微藻靶向基因敲除方法[65],从靶向基因敲除的突变菌株中获得了大约1/1 000-1/100的成功率,比之前报道的[43]编辑效率高了几个数量级。2017年,Ajjawi等[66]通过删除在脂质生物合成中充当负调节剂的转录因子,使Nannochloropsis gaditana脂质产量增加了一倍。2019年,CRISPR / Cas9系统首次应用于小球藻FSP-E中,通过编辑fad3基因,达到脂质积累增加的结果[67]。尽管目前应用在非模式藻类的种类还不够多,但随着研究的深入,相信在不久的未来,CRISPR/Cas技术在藻类的潜力将得到更充分的发挥和利用(表2)。
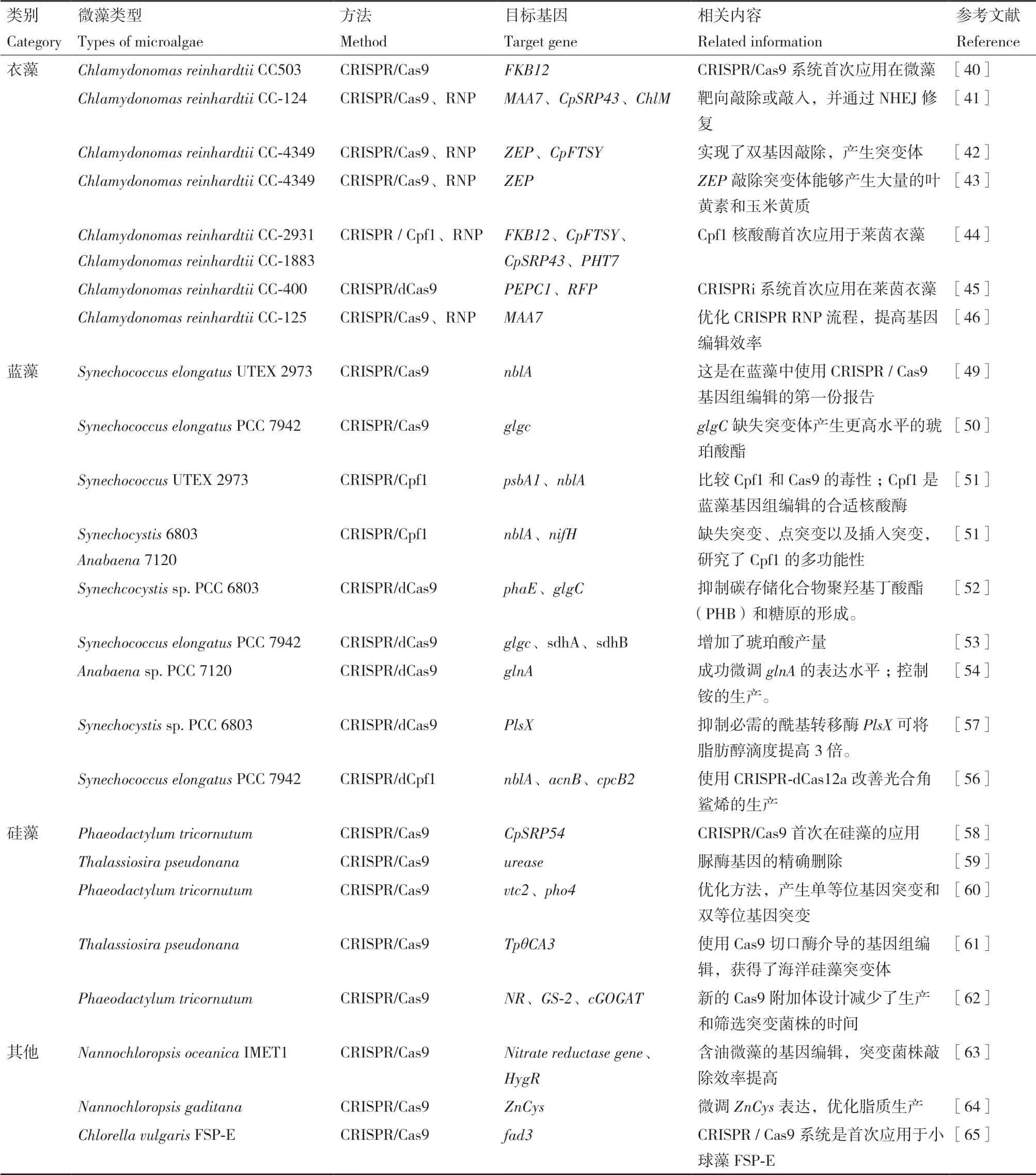
表2 CRISPR技术在微藻中的应用研究Table 2 Research on the application of CRISPR technology in microalgae
3 转化方法
植物的转化技术滞后于动物,而微藻的转化又是在植物转化技术基础上实现的。正如Altpeter所指出的,成功的基因编辑是基于生物体的转化技术的[68]。因此,此部分总结了微藻的转化技术。
微藻转化技术的滞后,可能与藻体细胞较小,以及存在保护细胞的细胞壁阻碍有关。藻类细胞壁是阻止外来DNA通过细胞膜进入的物理屏障,因此,许多转化的方案依赖于细胞壁缺陷的衣藻细胞。目前,微藻常用的核转化方法有粒子枪介导的生物转化、玻璃珠方法和电穿孔等3种。1988 年首次使用包被DNA的钨微粒轰击莱茵衣藻细胞叶绿体[69]。粒子枪介导的生物转化是利用微粒输送系统,将含有外源基因的金属微粒输送整合到藻类细胞中,从而越过了细胞壁的生理屏障。但这种方法效率低下,获得的转化体少且需要专门的设备。玻璃珠核转化是一种借助质粒和玻璃珠的存在,搅动细胞壁缺陷的衣藻细胞的方法[70]。玻璃珠方法仅适用于没有细胞壁的菌株,否则会限制转入细胞核的DNA量。虽然玻璃珠方法操作简单,不需要专门的设备,但它的限制性是需要在转化前用自溶素处理以去除菌株的细胞壁,使这种缺陷的衣藻细胞很难杂交,进而增加了遗传分析的困难。尽管后期改良的玻璃珠技术(碳化硅代替玻璃珠)可以转化具有细胞壁的微藻[71],但这种技术形成的毒副产物仍需谨慎处理。
电穿孔是使用最广泛的转染方法之一,因为它具有很高的效率和便利性。电穿孔转化方法,可以用一个或几个DNA分子将具有完整壁的细胞瞬时或稳定转化,不需要特殊的细胞壁缺陷菌株或去除细胞壁的处理方法[72],也不会产生有毒的副产物。电脉冲在细胞的质膜上形成瞬时孔后,紧邻质膜的带电分子被嵌入膜中,几小时后,带电分子会完全穿过质膜并进入细胞,是一种快速简便的方法。此外,电穿孔技术也是建立筛选目标表型的突变体文库的简便方法,其产生的突变体数量比玻璃珠方法高100倍左右,这是其他方法无法比拟的。然而,其所需的设备也比较昂贵。
4 编辑效率的提高
合成生物学时代,依赖于藻类基因工程有望生产如色素、油和脂类、甾醇、淀粉、多糖化合物等新型代谢物,在其中,CRISPR/Cas 系统已逐渐成为主要的基因组编辑工具。目前,提高微藻基因编辑效率可从两方面入手:(1)合适的转化方法;(2)CRISPR/Cas 系统引入微藻的模式。
在藻类物种中利用 CRISPR/Cas 的主要限制之一是缺乏高效和稳健的转化系统。转化方法的选择极大地影响了目标宿主工程策略的整体有效性。电穿孔是首选方法,其增加了 DNA 传递的数量,缺点在于由于机械损伤导致细胞死亡率较高。除了上述3种传统的转化方法,另一种克服细胞壁障碍的策略是利用农杆菌或者细菌结合来介导转化使 DNA 转移通过细胞壁。将环状自我复制附加型质粒转移到硅藻中,细菌结合方法显示出在某些微藻物种中进行染色体整合的前景[73]。此外,蓝藻在没有表面活性剂的情况下可从周围环境中自然吸收 DNA[74]。除了这些经典方法之外,基于细胞穿透肽、细胞穿透聚合物、金属有机框架、脂质体介导的转化已在非藻类宿主中得到证实[75],这些尚未广泛应用于藻类的新兴转化技术可能为DNA表达构建体传递到藻类基因组开辟新的途径。总体而言,DNA 递送和细胞壁透化的方法根据宿主生物体和目标细胞区室(细胞器或细胞核)而异,不存在一刀切的转化策略。每个宿主生物都有自己的特性,尤其是细胞壁的存在与否的情况。大多数藻类系统的主要限制是在转化中提供多组转基因,而这些新型转化技术是否有助于在单个转化步骤中稳定转化包含多基因途径的较大 DNA 片段还有待观察。
另一个决定编辑效率的重要因素是 CRISPR/Cas系统引入微藻的模式。最常用的方法是基于载体的传递,Cas9 与sgRNA 一起置于启动子和终止子的控制之下。生物之间缺乏相容性是合成生物学工具扩展受限的原因之一,尤其是密码子优化。尽管外源基因整合到微藻中,但转基因表达通常很弱,根据目标藻体的密码子偏好性,对Cas基因进行密码子优化,以确保有效表达。另外,有报道称Cas9组成型表达对衣藻细胞有毒性,可利用诱导型的启动子和终止子来解决[43,60]。另一种方法是 Cas9 和 sgRNA 的附加体递送[76]。附加体,即自我复制且不整合到染色体中的环状质粒。附加体避免了非目标位置的插入和敲除,并独立于染色体进行复制,使用附加体表达载体的优势是,一旦去除选择压力,转化细胞就会逐渐摆脱附加体。与电穿孔、微粒轰击和玻璃珠搅拌相比,通过细菌结合转化方法在递送更大的 DNA 片段方面具有优势。细菌结合转化微藻的附加型载体提供了多基因途径转移的有效手段。第三种Cas递送方法是通过 Cas9 核酸酶蛋白和 sgRNA 形成的核糖核蛋白复合物(RNP)。将纯化的 Cas9 和体外合成的 sgRNA 孵育以促进复合物的形成并引入靶细胞。RNP 复合物执行 DNA 切割的功能,并在进入细胞后数小时内降解。由于在细胞内的停留时间较短,其具有较小的脱靶率[77]。
5 挑战与展望
采用 CRISPR/Cas 的编辑系统是一种新兴的绿色微藻技术。对CRISPR/Cas的理解和优化使这种生物技术成为一个有前途的手段,可以操纵一些淡水和海洋微藻的基因组。在两种不同类别和6种不同类型的 CRISPR 系统中,以Cas9 驱动的II型系统在微藻的 CRISPR 研究中使用最多。本文除了回顾CRISPR的机制分类、一些经典的转化方法外,还重点总结了CRISPR技术在藻类的应用,以期这些新兴的转化方法和不同的递送方式,为提高转化效率和转基因的表达水平提供一些思路和方法。
从目前的报道来看,虽然CRISPR技术已经在藻类的研究中取得了一定成效,但其在应用过程中也存在诸多问题:(1)由于藻类存在细胞壁结构,很难将遗传物质转化到微藻中。藻类电穿孔转化应用最广泛,但转化效率还有待进一步的提升。而目前脂质转染与电穿孔相结合是提高转化效率的较好选择。(2)Cas9 RNP的方法虽比载体驱动的Cas9更有效率,但高质量的无毒的重组Cas9蛋白不容易制备,购买成本也较为高昂。(3)微藻可能存在沉默系统[78],在转录之后的水平上对抗遗传物质。沉默组件的暂时关闭可能会提高转换效率。(4)精确的基因组编辑技术需要精确的诱变而不会产生脱靶事件,这在微藻类中尚未建立良好的诱变体系。总体而言,CRISPR技术还存在一定的局限性,仍需后期的改进,以在微藻进行精准基因编辑。
与其他基因编辑技术相比,CRISPR技术在微藻中的应用进展较缓。随着全基因组测序技术的更新,CRISPR技术有望加深我们对微藻基因功能和代谢机制的认识,提高对微藻生物燃料和其化学品的开发,为解决能源短缺和环境污染等问题提供了新思路。同时,应警惕基因突变带来不可预知的风险和潜在的生物安全危机[79],在将CRISPR技术应用于商业用途之前,须考虑CRISPR转基因产品对环境和生物遏制问题的影响。

