军曹鱼nanos1的克隆及其在胚胎和性腺发育过程中的表达分析
李豫 陈刚 马骞 邝杰华 陈有铭
(1. 广东海洋大学水产学院,湛江 524025;2. 广东蓝粮种业有限公司,湛江 524000)
在鱼类的早期胚胎发育过程中,生殖细胞系与体细胞系发生分离并形成原始生殖细胞(primordial germ cells,PGCs),随着胚胎的发育PGCs迁移至性腺原基,并逐步转化为生殖干细胞(精原细胞或卵原细胞),随后经过减数分裂和进一步的发育,最终形成成熟的精子和卵子[1]。从PGCs起源到配子发生的整个过程受基因、激素、环境因子等多种因素的调控,然而其分子调控机制尚不明确。近年来,越来越多生殖细胞相关基因,如vasa、dnd、nanos、dazl等被广泛地应用于PGCs的起源和迁移研究,这些基因的发现有助于揭示生殖细胞分化发育的调控机制[2-5]。
nanos基因最早在果蝇(Drosophila melanogaster)中被确认为一种母源效应基因,编码一种含有两个锌指基序(Cys-Cys-His-Cys,CCHC)的RNA结合蛋白,可介导果蝇腹部的形成,并在多种生物的PGCs发生、迁移和存活以及生殖细胞发育过程中发挥重要作用[6-7]。研究表明,nanos基因功能的缺失会导致PGCs过早进行有丝分裂,无法进行正常迁移并最终发生凋亡,还可能导致胚胎的大量死亡,对生殖干细胞的形成和维持也会产生一定的影响[8-9]。nanos基因存在3种同源基因,分别为nanos1、nanos2和nanos3,其基因功能在不同物种中存在差异[10]。在脊椎动物中,nanos1基因对机体的调控作用存在较大差异。小鼠(Mus musculus)nanos1基因在PGCs中不表达,而生精细胞和卵母细胞中则可以检测到nanos1基因的表达信号;敲除nanos1基因后,小鼠未出现任何异常,且具有正常的生殖功能[11]。在鱼类中,施氏鲟(Acipenser schrenckii)nanos1基因在除心脏外的所有组织中均有表达,其中,卵巢中的表达水平最高[12]。斜带石斑鱼包含两种类型的nanos1(nanos1a和nanos1b),其表达模式各不相同,其中nanos1a在斜带石斑鱼垂体中的动态变化与其精巢分化和精子的形成相关[4]。抑制斑马鱼(Danio rerio)胚胎发育过程中nanos1基因的表达,将对其PGCs的迁移和存活产生影响[13]。此外,在其它鱼类中也相继克隆出nanos1的同源基因,包括河川沙塘鳢(Odontobutis potamophila)[14]、大黄鱼(Larimichthys crocea)[15]、中 华 鲟(A. sinensis)[7]、黑脊倒刺鲃(Spinibarbus caldwelli)[16]等。
军曹鱼(Rachycentron canadum),隶属于鲈形目(Perciformes)、军曹鱼科(Rachycentridae)、军曹鱼属(Rachycentron),又称为海鲡和海龙鱼,是一种大型的远洋洄游性鱼类[17]。军曹鱼因其生长速度极快、抗病能力强以及经济价值高,已成为我国极具前景的海水养殖鱼类之一,目前在超过23个国家和地区启动了军曹鱼的研究和开发工作,其中一半集中在亚太地区[18-20]。为了促进军曹鱼的规模化种苗培育及种质资源改良工作,需对其性腺发生发育作进一步研究。
本研究以军曹鱼为实验对象,克隆分析Rcnanos1基因cDNA全长序列,利用实时荧光定量PCR(qRT-PCR)技术检测Rcnanos1基因在13种组织中的表达分布以及在胚胎和性腺发育过程中的表达模式,为阐明nanos1基因在硬骨鱼类胚胎发育和配子发生过程中的生理功能及其调节作用提供基础资料。
1 材料与方法
1.1 材料
实验所用的军曹鱼胚胎于2019年4月采自广东海洋大学海洋生物研究基地。从海上网箱中挑选自养的3-4龄以上成鱼作为亲鱼,在室外水泥池(100 m3)中强化培育,注射LRH-A2和HCG催产,雌鱼注射剂量为LRH-A28 μg/kg + HCG 1 200 IU/kg,雄鱼的注射量为雌鱼的1/2,效应时间为10-12 h。准确掌握亲鱼的产卵时间,将受精卵置于培养皿内,在显微镜下进行连续观察,现场记录胚胎不同发育期的时序及形态特征,分别采集2细胞期、4细胞期、8细胞期、16细胞期、多细胞期、囊胚期、原肠期、神经胚期、器官形成期、孵化期及孵化后1 d的胚胎样品,经0.1%焦碳酸二乙酯(DEPC)水冲洗后放入装有RNA Later的EP管内,4℃静置过夜后转存至-80℃待用。
不同发育期的军曹鱼性腺组织于2019年6月-2020年4月采自广东省茂名市某工厂化养殖基地。军曹鱼幼鱼饲养于直径9 m、水深2.5 m的金属圆形水池内,流水充气,养殖盐度27.0%-30.5%,温度25.0-30.0℃,分别对90、120、150、185、210和360 dph体质良好的军曹鱼进行采样,其中,雌鱼共23尾,体重215.0-5 050.0 g,体长29.8-68.5 cm;雄鱼共18尾,体重230.0-4 225.0 g,体长29.2-64.5 cm。军曹鱼经40 mg/L丁香酚麻醉,解剖取出性腺进行性别鉴定,随后将性腺组织浸入RNA Later中,4℃静置过夜,最后转移至-80℃超低温冰箱保存,用于qRT-PCR实验。此外,选取150 dph军曹鱼雌雄各1尾,将其脑、肌肉、鳃、肝、肠、胃、脾、体肾、心、皮肤、眼睛、精巢和卵巢分离,经DEPC水冲洗后放入RNA Later中,-80℃保存待用。
1.2 方法
1.2.1 Rcnanos1基因全长cDNA的克隆 将采集的军曹鱼卵巢放入液氮中进行研磨,采用Trizol法(Invitrogen)提取总RNA。通过SimpliNano超微量核酸蛋白测定仪检测总RNA浓度和纯度,并以1.5%琼脂糖凝胶电泳检测其完整性。参照EasyScript One-step cDNA Synthesis试 剂 盒(TransGen)说 明书,将2 μg总RNA反转录合成第一链cDNA,另取2 μg总RNA,按照SMARTer® RACE 5'/3' Kit试剂盒(Clontech)说明合成5'/3' RACE-Ready cDNA。
从课题组前期获得的军曹鱼全基因组数据库(暂未上传至NCBI数据库)中提取Rcnanos1基因的CDS序列信息,使用Primer Premier5.0分别在序列两端设计上下游特异性引物Rcnanos1-F和Rcnanos1-R(表1)。按 照95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 45 s共35个循环,72℃ 10 min 的PCR反应条件进行扩增,产物经1.5%琼脂糖凝胶电泳检测,目的片段用Gel Extraction Kit(TransGen)纯化回收,纯化产物连接到pMD-18T(TaKaRa)载体,进而转化至DH-5α感受态细胞,筛选挑取单克隆阳性菌落由生工生物工程公司(广州)测序。根据测序片段,分别在靠近序列5'和3'末端各设计2条RACE引物Rcnanos1 5'-R1/R2和Rcnanos1 3'-F1/F2(表1),采用巢式PCR的方法获取Rcnanos1基因5'和3'末端序列。
1.2.2 序列比对及系统进化分析 根据基因测序结果,利用DNAMAN软件将序列进行拼接,得到Rcnanos1基因全长cDNA序列。将预测的RcNanos1氨基酸序列与GenBank数据库中其它物种的序列进行BLASTP一致性比对;下载其它硬骨鱼类及高等脊椎动物的Nanos1同源氨基酸序列,使用Clustalx1.83进行序列多重比对分析,通过GenDoc 软件将比对结果输出;使用MEGA5.0软件以邻接法(Neighbour-joining,NJ)构建系统进化树,针对进化树各分支结点均进行1 000次重复计算检验。
1.2.3 实时荧光定量PCR(qRT-PCR) 通过组织学观察并参照刘筠[21]对鱼类性腺的分期方法,依据性腺中生殖细胞的种类、成熟度、数量占比及排列方式进行发育分期的划分,提取军曹鱼不同发育期胚胎和性腺组织以及150 dph军曹鱼个体各组织的总RNA,按照反转录试剂盒说明书合成cDNA。基于测序获得的Rcnanos1基因序列,设计一对特异性扩增引物Rcnanos1-F1/R1,以军曹鱼β-actin作为内参基因(表1),qRT-PCR实验流程按照SYBR® Premix Ex TaqTM试剂盒(TaKaRa)说明进行操作,使用ABI 7500型实时荧光定量PCR仪检测Rcnanos1基因的组织表达分布及在胚胎和性腺发育过程中的表达,每个实验样品均设置3个重复。根据测得的Ct值,采用2-△△Ct法计算Rcnanos1的相对表达量。数据均以平均值±标准差(means±SD,n=3)表示,利用统计学软件SPSS 19.0进行单因素方差(One-way ANOVA)分析及Duncan’s多重比较,当P<0.05,表示有显著性差异。

表1 本实验所用引物序列Table 1 Primer sequences used in this study
2 结果
2.1 Rcnanos1 cDNA全长及序列分析
实验克隆所得的Rcnanos1序列全长为1 290 bp,其中5'非编码区139 bp,3'非编码区470 bp,开放阅读框(ORF)长度681 bp,共编码226个氨基酸,已提交NCBI GenBank(登录号:MW436699);预测的编码蛋白的分子质量为24.77 kD,等电点(pI)为8.74。结构域预测结果显示,在推导的RcNanos1氨基酸序列的C端具有两个连续且高度保守的锌指功能结构域(图1,2)。氨基酸序列多重比对结果显示,军曹鱼Nanos1氨基酸序列与鲈形目鱼类的一致性最高,如与尖吻鲈和斜带石斑鱼的序列一致性分别高达99.6%和99.1%,与小鼠(Mus musculus)和智人(Homo sapiens)等的序列一致性则较低,仅为30.9%和27.7%(图2)。

图1 Rcnanos1 cDNA全长序列和氨基酸序列分析Fig.1 Complete sequence of Rcnanos1 cDNA and analysis of deduced amino acid sequence
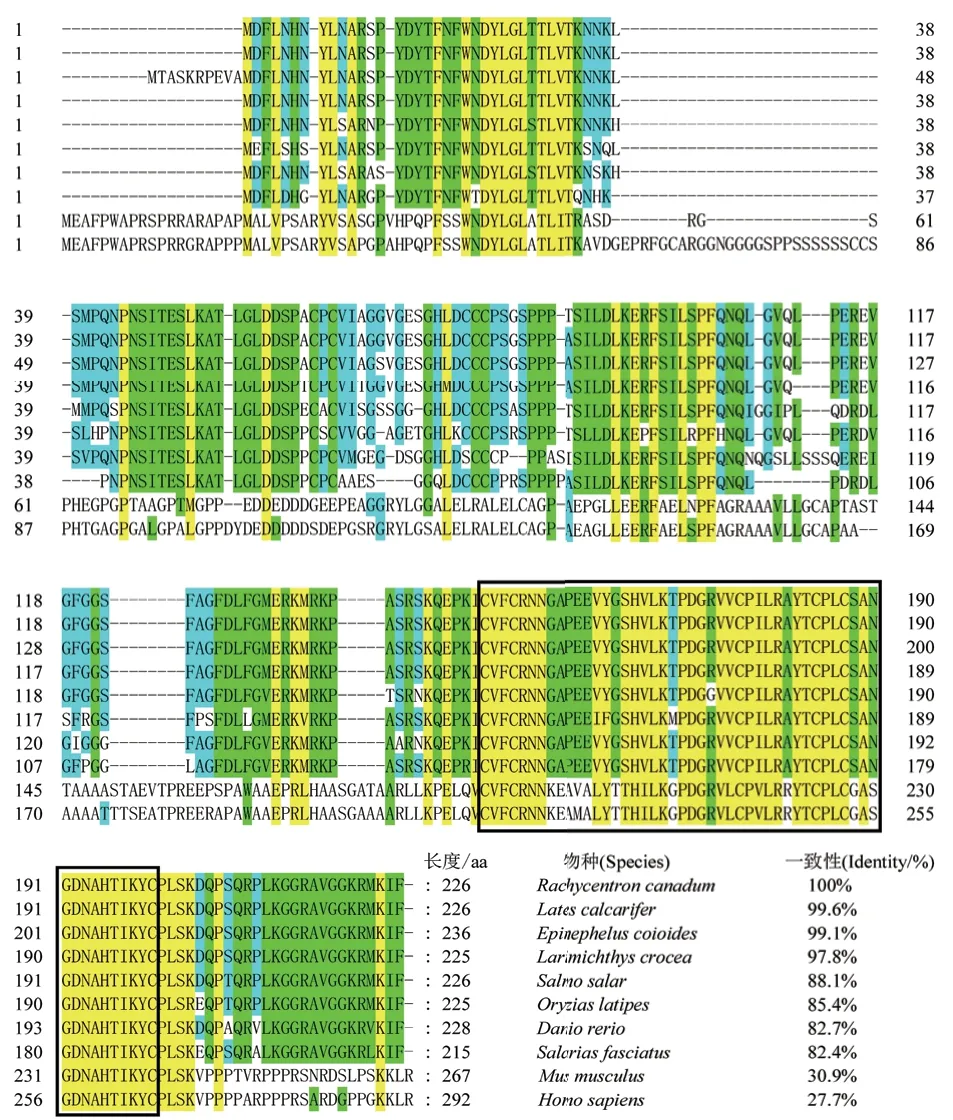
图2 军曹鱼nanos1氨基酸序列多重序列比对分析Fig.2 Multiple alignment of R. canadum nanos1 deduced amino acid sequence
基于军曹鱼与GenBank数据库中已发表的其它物种Nanos1氨基酸序列所构建的系统进化树中(图3),军曹鱼与其它硬骨鱼类聚为一簇,哺乳类、鸟类和两栖类等高等脊椎动物则聚为另一簇,其中,军曹鱼先与尖吻鲈和斜带石斑鱼聚为一支,在物种进化上距离最近,其次与大黄鱼(Larimichthys crocea)、红鳍东方鲀(Takifugu rubripes)、大西洋鲑(Salmo salar)、日本青鳉(Oryzias latipes)、高体鰤(Seriola dumerili)等分支聚为一簇。

图3 基于nanos1氨基酸序列构建的系统进化树(NJ树)Fig.3 Phylogenetic tree of nanos1 amino acid sequences based on Neighbor-Joining(NJ)method
2.2 Rcnanos1的组织表达分布模式
qRT-PCR检测了Rcnanos1在150 dph军曹鱼各组织中的表达水平,结果显示,Rcnanos1在13种组织中均有表达,其中在性腺中的表达水平最高,显著高于其它组织,并且卵巢中的表达水平显著高于精巢;其次是心脏、脑、眼、皮肤和肌肉;在肝、脾、体肾、鳃、胃和肠中的表达水平最低(图4)。

图4 qRT-PCR分析Rcnanos1在军曹鱼不同组织中的表达Fig.4 Expressions of Rcnanos1 in the tissues of R. canadum by qRT-PCR
2.3 Rcnanos1在胚胎发育过程中的表达模式
通过qRT-PCR检测发现,Rcnanos1在胚胎发育的各个时期均有表达,其在1细胞期、2细胞期、4细胞期和8细胞期中的表达量均无显著差异,从16细胞期开始表达量出现显著升高,随后由多细胞期发育至器官形成期的过程中,表达水平趋于稳定且无显著变化;孵化期时,Rcnanos1的表达量进一步显著升高,直至胚胎孵化后1 d,Rcnanos1的表达量达到峰值,约为1细胞期的2.8倍(图5)。

图5 Rcnanos1在胚胎发育过程中的表达分析Fig.5 Expressions of Rcnanos1 during the embryonic development stages
2.4 Rcnanos1在性腺首周年发育过程中的表达 模式
90-360 dph军曹鱼的精巢共分为4个发育时期,包括精母细胞增长期(Ⅱ期)、精母细胞成熟期(Ⅲ期)、精子变态期(Ⅳ期)和精子成熟期(Ⅴ期)。90 dph时,精巢处于Ⅱ期;120 dph时,精巢处于Ⅱ-Ⅲ 期;150 dph和185 dph的精巢均处于Ⅲ期,而210 dph和360 dph的精巢分别处于Ⅳ期和Ⅴ期。在精巢发育过程中,Rcnanos1的表达水平呈逐渐升高趋势,90 dph时的表达量最低,随后表达水平出现显著升高,并于360 dph时上升至表达量的峰值,约为90 dph的3.6倍(图6-A)。90-360 dph军曹鱼的卵巢可分为卵原细胞增殖期(Ⅰ期)、卵母细胞小生长期(Ⅱ期)、初级卵母细胞大生长期(Ⅲ期)。90 dph时,卵巢处于Ⅰ期;120 dph时,卵巢处于Ⅰ-Ⅱ期;150 dph、185 dph和210 dph的卵巢均处在Ⅱ期;360 dph时,卵巢发育至Ⅲ期。在卵巢发育过程中,Rcnanos1的表达水平呈不断上升的变化趋势,其在90 dph的表达量最低,120-360 dph的表达量均显著高于90 dph,其中120 dph、150 dph和185 dph三个时间点的表达量无显著差异;360 dph时,Rcnanos1的表达量显著升高至最大值,约为90 dph的3.1倍(图6-B)。
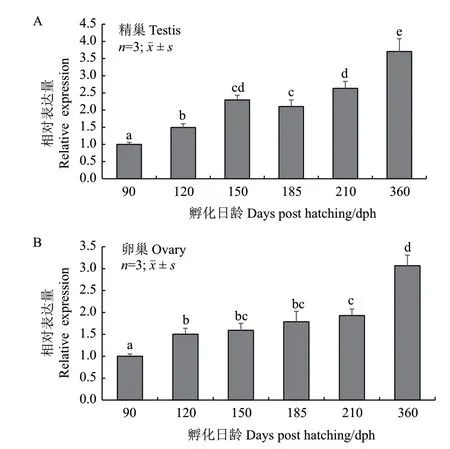
图6 军曹鱼性腺周年发育过程中Rcnanos1 mRNA的表达水平Fig.6 Rcnanos1 mRNA expression in annual gonadal development of R. canadum
3 讨论
本研究利用RACE技术首次克隆了军曹鱼nanos1基因的全长序列,其全长为1 290 bp,共编码226个氨基酸,推导的氨基酸序列与尖吻鲈的一致性高达99.6%。RcNanos1包含两个连续且高度保守的锌指功能结构域,与已报道的小斑点角鲨(Scylorhinus canicula)[22]、牙鲆(Paralichthys olivaceus)[10]、果 蝇[23]、非 洲 爪 蟾(Xenopus laevis)[24]等 物 种 的Nanos1同源蛋白的结构相似。相关研究表明,锌指结构域是RNA的结合部位,在维持nanos1的功能上发挥着至关重要的作用[25]。虽然不同物种间nanos1基因序列存在一定差异,但其RNA结合功能域的氨基酸序列在进化过程中高度保守。在系统进化树中,军曹鱼Nanos1属于硬骨鱼类的进化分支,且与尖吻鲈和斜带石斑鱼的亲缘关系最接近,也进一步表明克隆的Rcnanos1基因属于鱼类nanos1同源基因。
基于qRT-PCR检测的组织表达分布结果显示,Rcnanos1在150 dph军曹鱼的13种组织中均有表达,其中,性腺中的表达丰度最高,而卵巢中的表达水平又显著高于精巢,与施氏鲟[12]的组织表达模式相似,暗示Rcnanos1可能与军曹鱼性腺发育相关,且在卵巢发育过程中可能发挥更显著的调控作用。然而大黄鱼nanos1在精巢中的表达水平要显著高于卵巢[15];在中华鲟的研究中发现,nanos1在除脂肪外所有组织中均有表达,但垂体和端脑中的表达量最高,而卵巢中的表达量则较低[7],上述结果表明nanos1的组织表达模式具有明显的物种差异性。相关报道证实,nanos1在脊椎动物神经系统中具有一定的作用,Zhu等[14]发现河川沙塘鳢(Odontobutis potamophila)nanos1基因在脑组织中的表达水平最高且显著高于其它组织,表明其在神经系统中可发挥一定的功能。Ye等[26]的研究表明,果蝇nanos1基因可参与外周神经系统的形成。此外,在人类、小鼠、非洲爪蟾等高等脊椎动物的神经系统中均可检测到nanos1的表达[10],而本研究发现Rcnanos1在脑组织中有较高的表达水平,由此推测Rcnanos1也可能在军曹鱼的神经系统中发挥相关功能,关于其具体调控机理有待进一步的探究。
据报道,nanos基因参与PGCs的迁移和维持,在生殖干细胞的更新及生殖细胞的发育中起到关键作用,nanos基因发生突变后,可抑制PGCs的形成及分裂,甚至造成胚胎的死亡[1],因此研究nanos基因在胚胎发育中的表达具有重要意义。本研究利用qRT-PCR技术检测了Rcnanos1在军曹鱼胚胎发育12个不同时期中的表达情况,结果显示,Rcnanos1在胚胎发育的各个时期均有表达,表明Rcnanos1可能参与军曹鱼胚胎发育的分子调控机制,然而在大黄鱼整个胚胎发育过程中均未检测到nanos1基因的表达[15]。Rcnanos1在胚胎发育早期的表达水平较低,16细胞期时表达量开始显著升高,表明Rcnanos1可能在卵裂后的胚体形成过程中发挥重要作用,但在早期卵裂阶段的作用不显著。当胚胎发育至多细胞期后,Rcnanos1在囊胚期、原肠胚期、神经胚期和器官形成期中的表达均维持在较高水平。目前,研究学者普遍认为PGCs主要起源于中胚层或内胚层[27],而原肠胚期是形成外、中、内3种胚层的时期,可为胚体器官的形成奠定基础[28]。此外,关于PGCs迁移的研究表明,PGCs起源后主要通过脏壁中胚层从肠道侧膜迁移至生殖嵴,或沿着体壁中胚层通过体节进行迁移后到达生殖嵴[29]。上述研究表明Rcnanos1可能与PGCs的形成及迁移相关,并可能参与胚胎的器官形成过程。Rcnanos1在孵化出膜阶段的表达量显著升高,暗示Rcnanos1可能在胚体孵化后的生长发育中起到重要的作用,但具体的调控机制仍需通过进一步的原位杂交及功能分析阐明。
基于Rcnanos1在军曹鱼精巢和卵巢中的表达较强,本研究进一步分析了Rcnanos1在性腺首周年发育过程中的表达模式。随着精巢和卵巢发育,Rcnanos1的表达水平呈逐渐升高的趋势,且均在360 dph时达到表达量的峰值,此时精巢和卵巢分别处于精子成熟期(Ⅴ期)和初级卵母细胞大生长期(Ⅲ期),表明Rcnanos1可能参与调控军曹鱼精子和卵子的发生过程。然而,河川沙塘鳢nanos1的表达水平随着精巢发育(Ⅰ-Ⅳ期)呈不断下降的趋势,在卵巢发育过程中则呈先下降(Ⅰ-Ⅲ期)后上升(Ⅳ期)的趋势,表明不同物种间nanos1基因在性腺发育过程中的表达模式存在一定差异,由此推测nanos1基因在配子发生过程中的调控作用同样存在种间差异。
4 结论
本研究克隆获得的Rcnanos1基因与其它鱼类的保守性较高,在各组织中均有表达,其中,在性腺中的表达量最高。在军曹鱼胚胎发育和性腺周年发育过程中,Rcnanos1表达水平总体均呈逐渐升高的趋势,表明Rcnanos1基因可能在军曹鱼胚胎和性腺发育过程发挥一定的调控作用。

