调控猪ETV5基因miRNA的筛选鉴定
李虹仪 彭国良 肖正中 张茂
(韶关学院英东生物与农业学院,韶关 512005)
ETV5(E-twenty-six variant gene 5)是 一 种 转录因子,属于多瘤病毒增强子激活剂PEA3(poly- omavirus enhancer activator 3,PEA3)亚族,是ETS(E-twenty-six,ETS)家族中的一部分[1],ETS因子在哺乳动物发育和成年组织中广泛表达,可以作为多个基因的转录激活因子或抑制因子,调节生物过程如细胞增殖、分化、凋亡和细胞-细胞或细胞-基质相互作用,ETS因子在多种内分泌系统中都很活跃,包括垂体、甲状腺、乳腺、前列腺、卵巢、睾丸和胰腺等[2]。
ETV5基因最早发现在小鼠睾丸支持细胞(sertoii cells)中表达,对精原干细胞的自我更新及维持起着重要的调节作用,靶向破坏ETV5基因的小鼠在没有阻断精原干细胞正常分化的情况下失去了精原干细胞自我更新的维持能力,从而发生进行性生殖细胞消耗和仅支持细胞综合征[3-4]。后来,研究人员对小鼠ETV5基因进行敲除发现,ETV5敲除雄性小鼠生长及睾丸发育异常,小鼠经历第一波生精时精原干细胞开始消失至最终只有支持细胞,ETV5敲除小鼠虽然有产生精子但是不育[5]。将ETV5敲除小鼠的生殖细胞植入W/Wv小鼠睾丸中不能生成精子,从而说明ETV5对精原干细胞的存活和数量稳定具有重要作用[6]。将ETV5敲除小鼠作为受体移植入正常小鼠生殖细胞没有得到后代,同时还意外的发现ETV5敲除小鼠血睾屏障发生异常,敲除ETV5后可能改变了睾丸免疫特权。ETV5的敲除在雌性小鼠上面也同样导致不育,雌性小鼠在敲除ETV5后出生两周龄时卵巢结构出现缺陷,成年雌性小鼠即使在促性腺激素治疗后排卵也减少并且出现对交配不感兴趣的现象[7]。在ETV5突变的小鼠研究中还发现转录因子ETV5的错义突变会导致小鼠不育、胚胎和围产期死亡增加、出生后生长受限、肾脏不对称和多指[8]。以上研究表明,ETV5是维持小鼠精原干细胞自我更新和增殖能力的关键转录因子,对小鼠的生殖具有非常重要的作用。
miRNAs(microRNAs)是一类内源性的短片段非编码RNA,调控体内多数基因,广泛参与生物体的生长发育,比如细胞增殖、凋亡和分化,系统的免疫,疾病的发生、发展等[9]。ETV5基因对小鼠精原干细胞及精子的生成具有重要调控作用,在生殖方面发挥重要作用,然而对调控ETV5基因的miRNA还了解很少,特别是在农业动物猪上面。本试验预测调控猪ETV5的miRNA,构建猪ETV5基因UTR区的荧光素酶报告载体进行筛选,将筛选出来的miRNA转染猪睾丸支持细胞及胎儿成纤维细胞,检测ETV5基因表达情况,验证筛选出来miRNA对ETV5基因的调控作用。
1 材料与方法
1.1 材料
PCR酶PrimeSTAR MAX DNA Polymerase、限制性内切酶Nhe I和Xba I、连接试剂盒In-Fusion® HD Cloning Kit、DNA Marker、反转录试剂盒Prime-ScriptTMRT reagent Kit with gDNA Eraser购自TaKaRa公司,胶回收试剂盒Gel Extraction Kit、无内毒素质粒提取试剂盒Endo-free Plasmid Mini Kit I、细胞RNA提取试剂盒Total RNA Kit I购自Omega公司,转染试剂LipofectamineTM3000 Reagent、定量试剂PowerUpTMSYBRTMGreen 预混液购自Life Technologies,双荧光素酶报告基因检测试剂盒购自Beyotime公司,miRNA的合成由苏州吉玛基因合成,引物由深圳华大基因合成。
293细胞、ETV5基因敲除猪胎儿成纤维细胞、猪睾丸支持细胞、猪DNA、双荧光素酶报告基因载体(pmirGLO载体)为本实验室保存。
1.2 方法
1.2.1 调控ETV5基因miRNA的信息学预测 使用在线分析软件TagetScan 7.1(http://www.targetscan.org/vert_71/)、miRanda(http://www.microrna.org/)预测调控ETV5的miRNA,同时将结合位点的序列与猪序列进行比对。
1.2.2 质粒构建 参考GenBank中猪ETV5基因(NM_001243025.1)序列设计引物ETUF:5'-tgtttaaacgagctcgctagcCTACACTGAGGGCTTTGCTTACTAAG-3';ETUR1:5'-tgcctgcaggtcgactctagaTTTTTTAAACTGAAAGCAAACTTCTTT-3',以猪DNA为模板,用PrimeSTAR® Max DNA Polymerase进 行 扩增,扩增后进行琼脂糖凝胶电泳检测,扩增产物送华大基因测序。利用胶回收试剂盒Gel Extraction Kit回收目的片段。利用限制性内切酶Nhe I、 Xba I对质粒pmirGLO进行双酶切,然后进行回收 目 的 片 段。利 用In-Fusion® HD Cloning Kit对扩增片段UTR和经过酶切的质粒pmirGLO进行连接构建双荧光素酶报告质粒,连接结束后进行转化、挑菌及菌液PCR检测,检测引物如下:ETF:5'-CTACACTGAGGGCTTTGCTTA-3',ETR1:5'-AAACTGAAAGCAAACTTCTT-3',将PCR检测阳性菌液送华大基因测序,对测序结果进行分析。
1.2.3 293细胞的培养及转染 复苏293细胞系于37℃、5%的CO2培养箱中进行培养,将构建成功的质粒与合成的miRNA mimics共同转染入293细胞,利用LipofectamineTM3000进行转染,以乱序序列作为阴性对照(NC),转染48 h后收集细胞进行双荧光素酶活性检测。
1.2.4 双荧光素酶活性检测 收集的细胞吸尽细胞培养液后用 PBS洗涤两次,加入100 μL报告基因细胞裂解液,充分裂解后4℃,12 000 r/min 离心3 min后取上清液,取50 μL上清液于96孔板(白板)中,加入100 μL萤火虫萤光素酶检测试剂,于多功能酶标仪中检测萤火虫荧光素酶活性。检测完再往各孔里加入50 μL含有100 μL海肾萤光素酶检测工作液,再次于多功能酶标仪中检测海肾荧光素酶的活性。
1.2.5 荧光定量PCR检测 复苏ETV5敲除细胞系,39℃、5%的CO2培养箱中扩大培养后提取细胞总RNA,用miR-19特异颈环引物进行反转录,荧光定量PCR检测用miR-19 的表达量,以U6作为内参。引物使用如下:miR-19特异颈环引物:5'-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACTCAGTTTT-3',miR-19R:5'-GGCTGTGCAAATCTATGC-3',miR-19F:5'-AGTGCGTGTCGTGGAGT-3'。
复苏猪胎儿成纤维细胞及睾丸支持细胞,利用LipofectamineTM3000分别将miR-19 mimics、inhibitor和对照序列(NC)转染到细胞中,48 h后荧光定量PCR检测ETV5的表达情况,以GAPDH为内参。引物如下,ETVF2:5'-GCCAGCCATGAACTACGACA-3',ETVR2:5'-CACTCGGACTCGGCTTTCAG-3'。
检测结果根据以下公式计算出目的基因相对于内参基因的比值来反应各检测基因的表达丰度: 2-ΔCt= 2-(Ct 目的基因 -Ct 内参基因)。
1.2.6 数据统计 组间差异采用t检验进行分析,以 P<0.05作为差异显著性检验标准,用GraphPad Prism6完成数据的统计及图表制作。
2 结果
2.1 信息学预测作用于ETV5基因的miRNA
分别用在线分析软件TagetScan 7.1和miRanda 预测调控ETV5的miRNA,结果显示,TagetScan 7.1网站预测到9个miRNA,miRanda得到31个,预测得到的共同miRNA有8个,其中猪保守结合的有6个,分别为miR-19、miR-137、miR-129、miR-101、miR-219和miR-200(图1),其中miR-19与ETV5 3'UTR有两个结合位点。

图1 调控猪ETV5基因的miRNA预测Fig. 1 Prediction of miRNA regulating porcine ETV5 gene
2.2 MiR-19通过抑制猪ETV5 3'UTR序列降低荧光素酶活性
为了检测预测的miRNA与ETV5之间的靶关系,设计引物扩增的猪ETV5 3'UTR序列2 260 bp并将其连接到pmirGLO载体上,构建pmirGLO-ETV5质粒。将pmirGLO-ETV5质粒分别与紧密结合的小RNA miR-19、miR-137、miR-129和miR-101共转细胞,检测结果显示,转染miR-19的细胞其荧光素酶活性显著低于对照组(P<0.01,图2)。
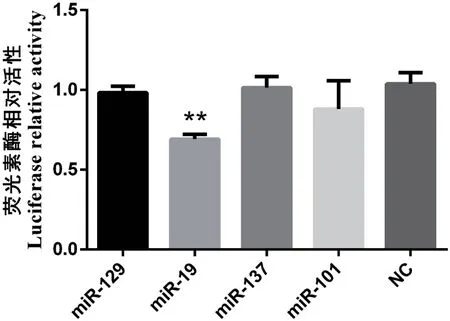
图2 荧光素酶活性检测Fig.2 Detection of luciferase activity
2.3 miR-19抑制胎儿成纤维细胞和睾丸支持细胞中ETV5基因的mRNA表达
在猪胎儿成纤维细胞和睾丸支持细胞中分别转染miR-19 mimcs、inhibitor和NC,荧光定量PCR检测两种细胞中ETV5的mRNA表达量。结果显示,miR-19 mimcs 可显著降低猪胎儿成纤维细胞和睾丸支持细胞中ETV5的mRNA表达,miR-19 inhibitor 则结果相反(P<0.01,图3-4)。

图3 MiR-19调控胎儿成纤维细胞中ETV5 mRNA的表达Fig.3 MIR-19 regulating the mRNA expression of ETV5 in the fetal fibroblasts
2.4 细胞ETV5基因的敲除升高miR-19的表达
利用CRSPR/Cas9技术敲除猪胎儿成纤维细胞中的ETV5基因,检测敲除细胞中miR-19的表达量,发现miR-19的表达量极显著高于对照组(P<0.01,图5)。

图4 MiR-19调控睾丸支持细胞中ETV5 mRNA的表达Fig.4 MIR-19 regulating the mRNA expression of ETV5 in the Sertoli cells
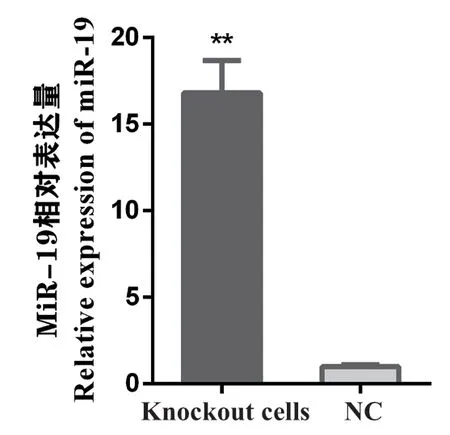
图5 miR-19在ETV5敲除细胞中的表达量Fig.5 Expression of miR-19 in the ETV5 knockout cells
3 讨论
雄性个体在青春期后能够源源不断地产生精子以繁殖后代,这一过程的持续发生有赖于睾丸中的精原干细胞,精原干细胞的自我更新及分化能力对于成年雄性生殖力的维持起着决定性作用,相关研究也因此成为生殖领域研究的热点[10]。在小鼠上面的研究表明,ETV5的缺失造成精原干细胞渐行性消亡最终导致枯竭,进而不能正常生精及不育,同时ETV5还能激活与精原干细胞自我更新相关的基因如Bcl6b、Lhx1等促进精原干细胞的更新[11]。此外ETV5还能直接调控对小鼠精原干细胞体外维持非常重要的miRNA21[12],而ETV5基因在哺乳动物性别发育过程中的表达受到SOX9基因的调控[1]。综上所述,ETV5基因在生殖方面的功能非常重要,既能调节其它基因及miRNA的表达,也在特定时期受到上游基因的调节。miRNAs在各组织系统的基因表达控制中起着关键作用,其功能包括调节自我更新、细胞分化、增殖和凋亡[12],在精原干细胞方面有很多的miRNA参与精原干细胞的更新和分化,如在小鼠上面发现的有miRNA-125a[13]、miRNA-20和miRNA-106a[14]、miRNA-224[15]、miRNA-322[16]、miRNA-486-5p[17]等,在 人 上 面 有miRNA-31-5p[18]、miRNA-663a[19]等。然而,猪上面关于ETV5的报道较少,特别是调控ETV5基因的miRNA鲜有报道。本研究初步筛选调控猪ETV5基因的miRNA,为研究调控猪ETV5基因的miRNA提供参考。
利用在线软件对调控猪ETV5基因的可能miRNA进行预测发现,不同软件出来的结果相差较大,miRanda得到的数量较多,筛选工作量也较大,采用韦恩图将不同软件的预测结果进行合并,可在一定程度上缩小筛选范围。而从荧光素酶检测结果上看,仅有miR-19显著降低荧光素酶的活性,miR-19以8mer方式与靶序列进行结合,且在ETV5 3'端有两个保守结合位点,由此可见,在预测时有意识地挑选更保守结合方式且多结合位点的miRNA,可在一定程度上提高筛选的成功率。
ETV5基因在小鼠睾丸、脑、肾、肺等组织中表达并发挥着不同的功能,此外还对小鼠体细胞和胚胎干细胞(mESCs)存在调控作用[20]。在医学方面的研究中还发现ETV5基因在肿瘤侵袭[21]、甲状腺癌形成[22-23]、肝脏脂肪代谢[24]及祖神经元细胞分化[25]等方面有重要作用。在猪中,本研究前期检测到了ETV5基因除了在睾丸组织中表达外,还在脑、心脏、肝脏、肾脏及肺中表达。通过PCR扩增得到ETV5基因3'UTR片段并构建pmirGLO-ETV5质粒,在初步预测miRNA中选择较为保守结合的miR-19、miR-137、miR-129、miR-101分别与pmirGLO-ETV5质粒共同转染293细胞,荧光素酶检测发现4条miRNA中只有miR-19转染的293细胞荧光素酶活性显著降低,表明miR-19可能对ETV5基因有调控作用。合成miR-19模拟物分别转染猪胎儿成纤维细胞及睾丸支持细胞,定量检测ETV5的mRNA表达量发现ETV5基因的表达显著降低,而转染抑制物时ETV5基因的表达显著提高,表明miR-19能够下调ETV5 mRNA的表达,而抑制miR-19则能够提高ETV5的基因表达量。
猪胎儿成纤维细胞是一种体细胞,通常作为供体用于体细胞核移植制备克隆猪,同时基因编辑猪的制备中也常选用猪胎儿成纤维细胞用于筛选出基因编辑细胞系进而制备基因编辑猪进行研究。睾丸支持细胞附着于曲细精管基膜上,是唯一一种与生精细胞直接接触的体细胞,为精原干细胞提供生长、发育和自我更新所需的各种细胞因子,并为精子发生提供物理支撑和稳定微环境[26-27]。本研究选择猪的胎儿成纤维细胞及睾丸支持细胞来研究ETV5基因与具有调控作用miRNA具有较好代表性,并且也验证了miR-19在这两种细胞中对ETV5基因具有明显调控作用。在后面试验中对猪胎儿成纤维细胞的ETV5基因进行敲除后检测miR-19的表达情况,结果显示miR-19相对表达量显著升高,再次验证了miR-19与ETV5基因之间的调控关系。
4 结论
miR-19对猪ETV5基因的表达有调控作用,为进一步开展miRNA调控猪ETV5基因影响猪生殖方面的研究提供参考。

