过表达Spt7对黑曲霉生长及抗逆性影响
薛鲜丽 王静然 毕杭杭 王德培,2
(1. 天津科技大学生物工程学院,天津 300457;2. 工业发酵微生物教育部重点实验室,天津 300457)
Spt-Ada-Gcn5-乙酰转移酶(SAGA)复合体是一种多蛋白复合物,是一个多亚基保守的转录辅助因子,主要负责体内10%以上的基因转录[1]。Spt7是构成 SAGA 复合物的核心结构之一,维持 SAGA 复合物的稳定。其含有至少一个保守结构域,参与生物体转录调控,例如Bromo结构域,可以结合乙酰化赖氨酸[2-3]。SAGA作为一类多功能蛋白复合体,通过对组蛋白进行乙酰化[4]和去泛素化[5]修饰,实现染色质结构在沉默和活跃状态之间的转换,为基因转录起始创造了合适的遗传条件;另外它通过与转录激活因子以及RNA 聚合酶 II等结合,帮助将它们募集到靶基因的启动子区域发挥作用;除此之外它还参与到DNA损伤修复、mRNA输出[6-8]等多种生物学过程。
目前发现 SAGA 复合体由至少 20 个蛋白组成[9],以酵母SAGA复合物为例,它是由20个亚基组成,在结构上可分为4个不同的模块:由Ubp8、Sgf11、Sgf73和Sus1组成的双歧化(DUB)模块,由Gcn5、Ada2、Ada3和Sgf29组成组蛋白乙酰转移酶(HAT)模块,TATA结合蛋白(TBP)相关因子(TAF)模块,以及由Spt3、Spt8、Tra1、Spt20、Spt7和Ada1组成Ty(SPT)模块。SAGA复合体的完整性主要依赖核心组件Spt7、Spt20和Ada1三个亚基,其中SPT模块与SAGA复合体的招募有关。研究发现Spt7参与调节Spt20和Ada1的水平,并且含有Spt7的部分SAGA复合物可以在Spt20和Ada1都不存在的情况下组装[10]。Spt7最初被发现是通过在酿酒酵母HIS4和LYS2基因的5'非编码区的δ 插入突变以及Ty表型的影响[11],后来发现spt7编码一种定位于细胞核的大型酸性蛋白质,缺失spt7基因的细胞可以存活,但生长缓慢,并呈现多种表型如肌醇营养不良、细胞形态发生改变、产孢缺陷以及Ty元素的转录改变[12]等。最新研究发现来自酿酒酵母的SAGA复合物核心是Taf5、Sgf73和Spt20亚基和组蛋白八聚体样折叠[13-14],八具体折叠中还包含了异二聚体Taf6-Taf9、Taf10-Spt7和Taf12-Ada1,以及Spt3中的两个组蛋白折叠结构域。
SAGA 复合体在真核生物中高度保守,酿酒酵母中 SAGA 复合物各亚基的同源蛋白已在果蝇、植物与人中得到鉴定[15-19]。虽然 SAGA 复合体三维结构在酵母与人体细胞中高度相似,但研究发现SAGA 复合体在不同物种中发挥的功能存在差异性。迄今为止,黑曲霉乃至丝状真菌范畴中均未见有关Spt7的报道。本实验过程中意外的发现spt7基因缺失使菌株与原始菌株黑曲霉的菌落形态大相径庭。与原始菌株相比,Δspt7菌株菌丝顶端膨大、菌丝短小、粗细不均匀,且部分区域出现类似酵母的念珠状结构,不生成分生孢子。且spt7基因的缺失无法通过添加外源碳源得到弥补。从文献得知此基因是 SAGA 复合物结构稳定核心亚基之一,其缺失可能使 SAGA 复合体失活,从而影响黑曲霉菌体生长发育及分生孢子形成关键性基因的转录表达。为了进一步验证Spt7的功能,本研究构建一株过表达Spt7的菌株,对其生长形态、分生孢子形成、抗氧化胁迫、高温及高渗耐受性等进行观察分析。
1 材料与方法
1.1 材料
1.1.1 菌种 黑曲霉(Aspergillus niger 1062)由江苏国信协联能源有限公司天津分公司保藏。大肠杆菌DH5α和根癌农杆菌AGL1采购于中国普通微生物菌株保藏管理中心,由天津科技大学生物工程学院生化过程与技术研究室保藏。
1.1.2 试剂 无水葡萄糖、酵母粉、琼脂粉、胰蛋白胨采购自天津市北方天医试剂公司,硫酸铵、磷酸二氢钾、磷酸氢二甲、硫酸镁、氯化钙、氯化钾、七水合硫酸亚铁、五水合硫酸铜、硫酸锰、硼酸、七水合硫酸锌、六水合氯化钴、苯酚、氯仿、冰乙酸、甲醇、氯化钠、氢氧化钠、氢氧化钾、无水乙醇、甘油、乙酰丁香酮、头孢噻肟钠、氨苄青霉素、卡那霉素、潮霉素(均为分析纯)采购自北京市索来宝科技有限公司,DL5000 DNA Maker、快速 DNA 聚合酶(5 U/μL)采购自南京诺唯赞生物科技有限公司,T4-DNA连接酶(10 U/μL),限制性内切酶 BamH I(15 U/μL)采购自宝日医生物技术有限公司,真菌RNA提取试剂盒(50T)采购自北京酷来博科技有限公司,RNA反转录试剂盒HiS cript III RT Super Mix for qPCR(+Gdna wiper)(100rxn)采购自南京诺唯赞生物科技有限公司,ChamQ Universal SYBR qPCR Master Mix(500 rxns)采购自南京诺唯赞生物科技有限公司。
1.1.3 培养基 LB培养基:1% NaCl,0.5%酵母粉,1%胰蛋白胨;大肠杆菌感受态转化筛选培养基:LB培养基添加(0.01%)卡那霉素;电转根癌农杆菌筛选培养基:LB培养基添加0.012%卡那霉素;CM培养基:ASP+N-母液2%、葡萄糖1%、1 mol/L MgSO4母液0.2%、CM Trace elements 0.1%、酪蛋白水解物0.1%、酵母浸出物0.5%(ASP+N-母液:氯化钾2.61%、磷酸二氢钾7.48%、硝酸钠29.75%、氢氧化钾调节pH至5.5;CM Trace elements:七水合硫酸锌2.1%、硼酸1.1%、四水合氯化锰0.5%、七水合硫酸亚铁0.5%、四水合氯化钴0.17%、五水合硫酸铜0.16%、二水合钼酸钠0.15%、EDTA5.1%);根癌农杆菌介导的转化初步筛选培养基:CM培养基外源添加0.01%氨苄青霉素、0.008%头孢噻肟钠和0.015%潮霉素;根癌农杆菌介导的转化初步筛选培养基:CM培养基添加0.025%潮霉素;农杆菌转化所用 IM 培养基参照文献[20]配制;提RNA 所用培养基:2%葡萄糖,1%酵母粉,0.2%磷酸二氢钾,0.2%硫酸镁。
1.1.4 仪器与设备 LRH-250A生化培养箱采购自韶关市泰宏医疗器械有限公司,WXL-A30002电子天平采购自北京赛多利斯仪器系统有限公司,LDZX-50FB 立式压力蒸汽灭菌器采购自上海申安医疗器械厂,ChampGel5000全自动凝胶成像仪采购自北京赛智创业科技有限公司,Eppendorf PCR仪采购自上海恒久医疗器械有限公司,CX23 型光学显微镜采购自OLYMPUS 公司,实时荧光定量PCR仪(Stepone Plus)采购自美国ABI公司,由天津科技大学生物学院分析测试中心保存。
1.2 方法
1.2.1 Spt7同源序列分析及进化树的构建 根据 GenBank中登录的相关Aspergillus niger CGMCC 10142中spt7序列,采用NCBI比对后获得的Spt7的同源氨基酸序列。选取酿酒酵母及黑曲霉中的Spt7蛋白序列在SMART网址进行比对分析其内部结构。选取序列Aspergillus niger CBS 513.88来源的转录激活因子Spt7(XP 001399796.1),Aspergillus sclerotioniger CBS 115572来源的溴结构域 蛋 白(bromodomain protein)(XP 025466510.1),Aspergillus saccharolyticus JOP 1030-1来源的组蛋白乙酰转移酶SAGA/ADA 催化亚基PCAF/GCN5(XP 025427320.1),Penicilliopsis zonata CBS 506.65来源的假定蛋白ASPZODRAFT 127728(XP 022586128.1),Byssochlamys spectabilis No. 5来源的溴结构域蛋白(GAD99092.1),Monascus purpureus来源的转录激活因子Spt7(TQB67779.1),用MEGA7.0.26软件构建Spt7氨基酸序列系统进化树。
1.2.2 spt7过表达质粒pOE spt7的构建 pOE spt7质粒即p66-PglaA-spt7的构建:以p66质粒为出发质粒,选用BamH I进行单酶切线性化,A. niger 1062基因组为模板,分别通过引物spt7-F和spt7-R(含终止子)、引物Pgla-F和Pgla-R扩增片段片段spt7和pgla;将片段pgla和片段spt7通过Over-lap PCR的方法融合成一个片段pgla-spt7。通过重组酶进行连接获得质粒pOE spt7,并热激转化至大肠杆菌。以大肠杆菌菌液为模板验证pOE spt7质粒。本研究所用引物均由金唯智生物科技公司合成,如表1 所示。

表1 试验中用到引物Table 1 Primers used in the experiment
1.2.3 农杆菌转化黑曲霉及过表达spt7阳性转化子的筛选 将pOE spt7质粒电转化农杆菌 AGL1 感受态细胞,并以菌液为模板验证农杆菌。按照文献所述方法孵育农杆菌[21],之后将农杆菌与黑曲霉新鲜孢子置于 IM 固体培养基硝酸纤维膜上,25℃避光共培养 48 h。待共培养过后用无菌生理盐水将黑曲霉孢子从膜上洗到筛选培养基,37℃黑暗培养 2-3 d。待初筛版上长出白色单菌落后,挑单菌落进行复筛验证。
1.2.4 OE spt7转化子菌落、菌丝观察及分生孢子计数 将OE spt7转化子及出发菌株同时接种到CM培养基,30℃培养3 d,取爬片显微镜下观察菌丝形态;对菌落孢子数进行计数:用直径 20 mmol/L 的打孔器从菌落中心打孔采样,将孢子用 1 mL 无菌水洗下,血球计数板计数,进行产孢量分析。
1.2.5 OE spt7菌株抗氧化胁迫性观察 将OE spt7转化子及出发菌株同时接种到含有6 mmol/L H2O2、15 mmol/L H2O2的CM培养基中,培养4 d,观察菌落生长情况。
1.2.6 OE spt7转化子高温、高渗抗逆性实验 将OE spt7转化子及出发菌株同时接种到含有15% NaCl的CM培养基中,置于30℃下培养9 d,观察菌落生长状况。
将对照组与OE spt7转化子点种在CM培养基上,置于39℃下培养,观察1-4 d菌落生长形态。
1.2.7 OE spt7菌株RNA提取及过氧化物酶及热休克蛋白转录水平 将OE spt7菌株及对照组的孢子置于含有15 mmol/L H2O2的CM液体培养基中培养40 h,参考真菌RNA提取试剂盒说明书提取RNA,经反转录后进行qRT-PCR。目前在生物体内常见的抗氧化酶有过氧化氢酶(catalase,CAT),超氧化物歧化酶Orgotein(superoxide dismutase,SOD),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px),过氧化氢酶过氧化物酶编码基因(catalase-peroxidaseencoding gene,CpeB)。
选取热休克蛋白家族中的Hsp40、Hsp70、Hsp90蛋白进行转录水平的检测。将OE spt7菌株及对照组的孢子置于CM液体培养基中培养36 h后在置于42℃水浴分别热处理3 h和5 h,提取RNA,经反转录后进行qRT-PCR。
qRT-PCR方法及操作步骤参考 ChamQ Universal SYBR qPCR Master Mix试剂盒说明书进行,所使用的引物如表1所示。
2 结果
2.1 Spt7氨基酸序列比对及遗传进化树分析
目前关于以Spt7为核心组分的SAGA复合物的研究仅集中在酵母、果蝇、人、植物细胞内,不同物种的Spt7氨基酸相似性极低,但结构相似,如图1-A所示,在黑曲霉与酿酒酵母的Spt7序列中,都含有溴结构域,但是溴结构域所在位点不同。本研究中黑曲霉和酿酒酵母Spt7多肽链全长分别含有1 175和1 332个氨基酸残基,二者Spt7氨基酸多序列比对结果如图1-B所示,相似性仅有21.96%。将不同丝状真菌来源的Spt7的氨基酸序列比对后构建进化树如图1-C所示,结果发现黑曲霉Spt7与曲霉菌A. sclerotioniger的溴域蛋白处于同一分支,通过文献查找发现1995年报道了一篇关于酵母的Spt7,它是一个含有溴结构域的酸性蛋白,推测在曲霉菌中Spt7同样含有溴结构域。同时与糖曲霉A. saccharolyticus JOP 1030组蛋白乙酰转移酶SAGA/ADA催化亚基PCAF/GCN5也有较近的亲缘关系。曲霉菌与带状青霉P. zonata CBS 506.6的假定蛋白分别处于一分支。与丝衣霉B. spectabilis No. 5的溴域蛋白及紫色红曲M. purpureus的转录活性因子Spt7的亲缘关系较远。
2.2 Spt7对丝状真菌菌丝形态及分生孢子形成的影响
将转化子与对照组孢子点种在CM培养基上观察3 d,结果如图2-A所示,对照组与转化子的菌落大小无明显区别,两菌株整体呈棕色,菌落中间有大量棕色孢子,边缘菌丝呈乳黄色;与对照组菌株相比,转化子菌落中间褶皱更深,有更多凸起,而对照组菌株较为平整。第2天对照组产孢比转化子多但是转化子菌丝更加茂密,而到第3天转化子的孢子产量(数值)明显比对照组高(数值)(图2-B),3个转化子的孢子数量分别是5.8×107/cm2、6.2×107/cm2、6.3×107/cm2比对照组2.3×107/cm2高了2.5-2.7倍。说明过表达spt7基因使菌体产孢延迟,但是增加了孢子产量。为了进一步观察过表达spt7对菌体菌丝的影响,通过制备爬片并在显微镜观察菌丝形态,如图2-C所示,对照菌株菌丝相对疏松,枝节细长且直,转化子菌株菌丝稠密,枝节较多且短而粗。
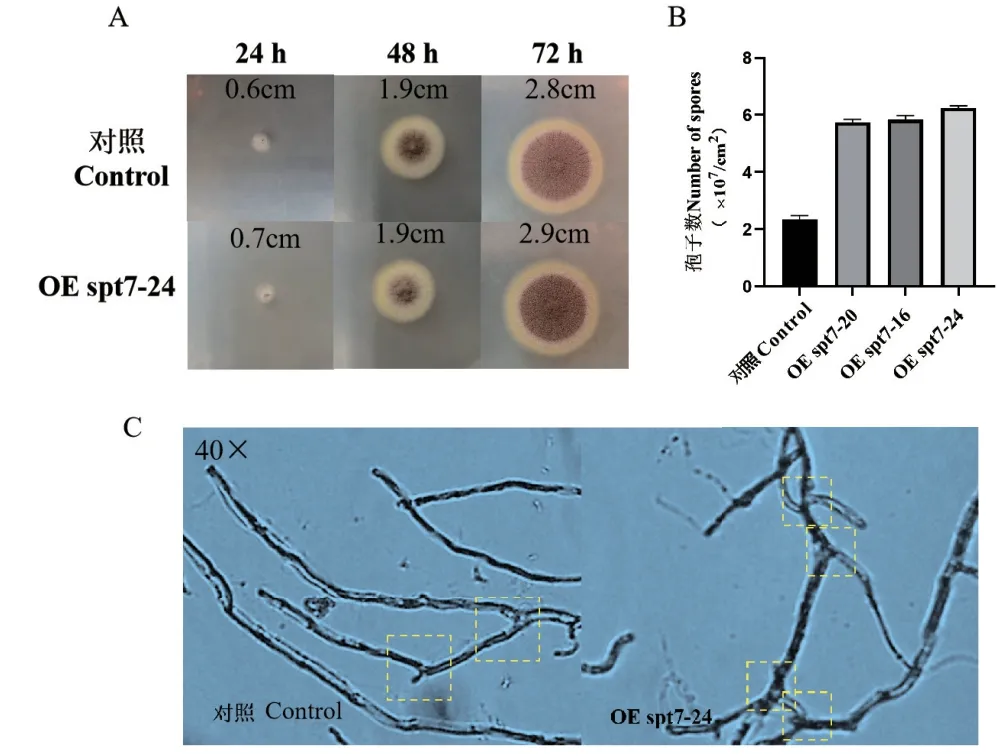
图2 30℃下对照组及转化子的生长形态观察及孢子计数Fig. 2 Growth morphology observation and spore count of control and transformants at 30℃
2.3 OE spt7菌株抗氧化胁迫性分析
氧化胁迫的产生是由于胞内活性氧含量过高,使得胞内氧化还原的状态失衡,进而引起菌体一系列应激反应,菌体通过激活相关基因的表达来降解活性氧从而修复和维持细胞的动态平衡。为探究Spt7对黑曲霉氧化耐受的影响,分别测定6 mmol/L H2O2以及15 mmol/L H2O2胁迫下,黑曲霉对照组及OE spt7菌株的生长情况。如图3 所示,在6 mmol/L H2O2上对照组延迟24 h萌发,但在后期4-5 d时生长情况与转化子无明显差异。在15 mmol/L H2O2的CM培养基上,对照组孢子延迟萌发且萌发后菌落生长受到抑制,菌落直径明显小于转化子,充分说明了过表达Spt7可以提高菌株的抗氧化胁迫能力。通过转化子对H2O2的抗逆性观察实验发现过表达Spt7增加了菌体对的H2O2耐受性。
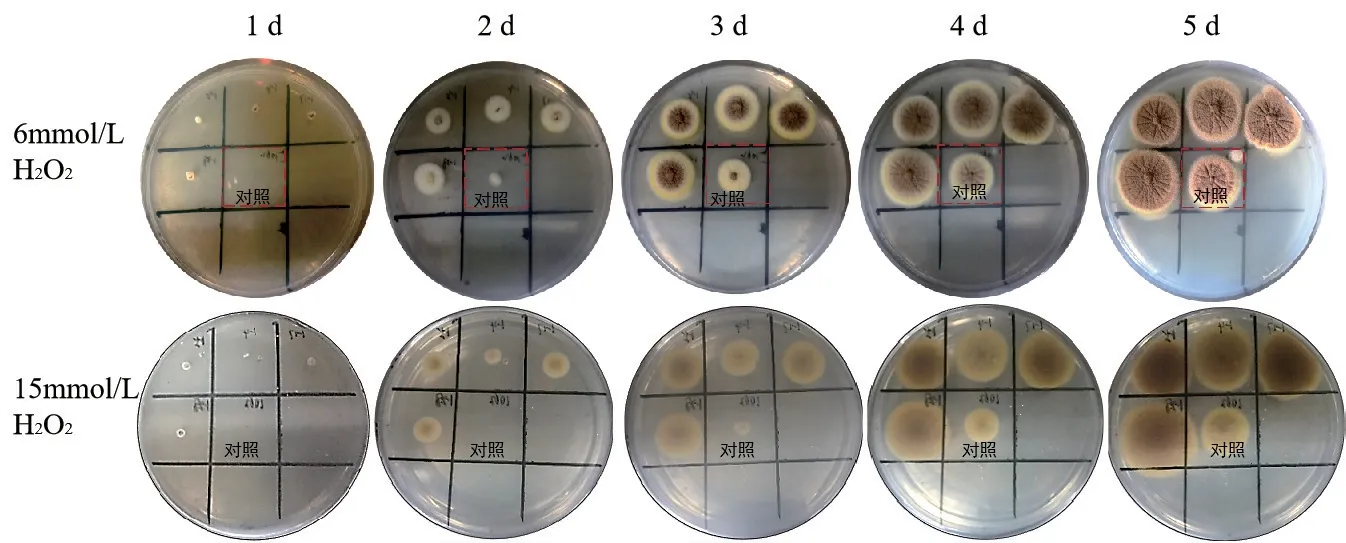
图3 对照组及OE spt7转化子在含有不同浓度H2O2 CM培养基的生长情况Fig. 3 Growths of control group and OE spt7 transformants in CM medium containing different concentrations of H2O2
2.4 OE spt7菌株高渗耐受性分析
本研究进一步验证OE spt7转化子对其他不良环境的耐受性,于是将转化子与对照组孢子点种在含有15% NaCl的CM培养基上进行9 d的观察实验,结果如图4所示。从整体来看,对照组与转化子都能在高盐板上萌发及生长,但是萌发都受到抑制,对照组受抑制较为明显。转化子在第2天即可看到孢子的萌发迹象,但对照组则是在第3天开始出现气生菌丝,随后较转化子均生长缓慢,菌体颜色偏灰白色;从第3-5天的生长情况观察,发现转化子的气生菌丝明显比对照组稀少,但在培养6 d后气生菌丝忽然增加,并且随着菌落的生长,气生菌丝也越来茂密;在菌体生长的7-9 d,转化子的生长明显比对照组快,且菌落颜色相对对照组更加嫩黄,菌体更加鲜活。说明过表达Spt7可以提高菌株对高渗不良环境的耐受能力。

图4 对照组及OE spt7转化子在含有15%NaCl的CM培养基生长情况Fig. 4 Growths of control group and OE spt7 transformants in CM medium containing 15% NaCl
2.5 OE spt7菌株高温耐受性分析
将对照组与OE spt7转化子点种在CM培养基上,置于39℃下培养,观察1-4 d菌落生长形态,结果如图5所示,对照组与转化子在39℃孢子均能萌发,较最适温度30℃相比生长缓慢,与对照组相比转化子孢子萌发更快、生长状态良好且菌落依然饱满,但是对照组在后期不仅生长相对缓慢且菌落干瘪、失水严重。

图5 对照组及OE spt7转化子在39℃高温下生长情况Fig. 5 Growths of control group and OE spt7 transformants at 39℃ of high temperature
2.6 过氧化物酶qRT-PCR结果
从表征观察发现过表达Spt7后,菌株的抗氧化能力提高,于是对转化子及对照组通过qRT-PCR分析关键性的过氧化物酶的转录水平,结果如图6所示,可以看出在含有H2O2的培养基中培养转化子与对照组,过表达Spt7使spt7的转录水平上调2.15倍;同时超氧化物歧化酶SOD转录水平相对对照组上调了3.8倍,谷胱甘肽过氧化物酶GPX以及过氧化氢酶-过氧化物酶CepB编码基因的转录也上调了1.89倍;但是对于过氧化氢酶CatR的转录下调了3.56倍。

图6 对照组及OE spt7转化子抗氧化物酶的转录水平Fig. 6 Transcript levels of antioxidant enzymes in the control and OE spt7 transformants
2.7 热休克蛋白qRT-PCR结果
因OE spt7转化子在高温下生状态良好,因此推测其内部热休克蛋白发挥作用。将其与对照组分别热激3 h与5 h后,qRT-PCR验证其热休克蛋白的转录水平。如图7-A所示,热激3 h后,OE spt7转化子Spt7的转录水平相对对照组上调了1.92倍,OE spt7转化子的热休克蛋白Hsp40、Hsp70、Hsp90相比对照组分别下调了0.9、0.1、0.5倍,但OE spt7转化子与对照组热休克蛋白转录水平并未呈现出显著差异性。为了进一步观察热休克蛋白的转录情况,作者将热激时间延长到5 h,较热激3 h结果相比,OE spt7转化子与对照组Spt7、Hsp40及Hsp70的转录水平没有差异性,但OE spt7转化子Hsp90转录水平较对照组上调了19倍(图7-B)。
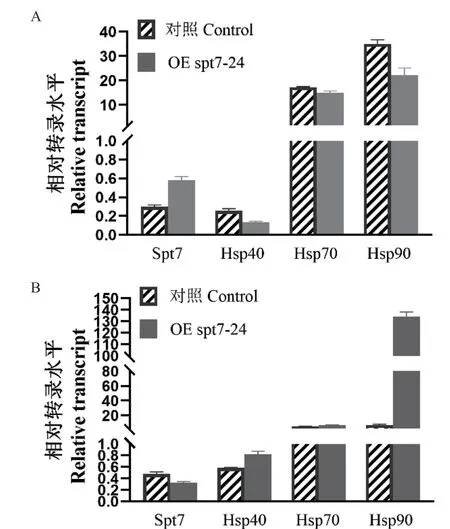
图7 对照组及OE spt7转化子在42℃热激条件下胞内热休克蛋白的转录水平Fig. 7 Transcript levels of intracellular heat shock proteins in the control and OE spt7 transformants under heat stress conditions at 42℃
3 讨论
3.1 Spt7同源序列分析结果及蛋白结构域分析
系统进化树分析发现,不同菌种中Spt7的氨基酸序列差别很大,黑曲霉与酿酒酵母的Spt7氨基酸序列比对后只有21.9%的相似性,说明在不同物种间,Spt7同源性较低。通过与酿酒酵母的Spt7蛋白结构比较,发现两菌种中的Spt7都含有溴结构域,只是结构域所在位点不同。而溴结构域本身是一种能识别乙酰化赖氨酸残基的蛋白结构域。有些学者认为溴结构域作为调节蛋白可以直接识别组蛋白中乙酰化的赖氨酸,从而被乙酰化的组蛋白募集。在转录调控中,启动子可以通过溴结构域蛋白判断许多的关键的调节因子是否存在,从而决定相关基因的表达或者沉默[22]。目前已经鉴定出大量含有溴结构域的调节蛋白。并且关于溴结构域的功能还未完全发现,而溴结构域作为Spt7蛋白结构的主要结构域,其在Spt7相关功能中可能起到主要作用。
3.2 过表达spt7对菌体表征的影响
通过与原始菌株的形态观察比较,从整体来看,菌体形态并无太大区别,但是在生长过程中,转化子与对照组在产生分生孢子前,转化子的菌丝更加茂密,进一步用显微镜观察菌丝形态,发现菌丝分枝增多。但是菌体产孢延迟说明过表达spt7对菌体生长繁殖十分有利,并且在产孢期,转化子的孢子数量明显提高是对照组的2-3倍,通过以上现象我们推测spt7可能是菌体生长繁殖的关键基因。研究发现Spt7基因的缺失导致酿酒酵母生长缓慢且Ty、INO1、MFA1等基因的转录受到抑制[10-12],且本课题组获得的一株缺失Spt7基因的高产柠檬酸黑曲霉菌落聚缩生长、不产分生孢子以及无法正常产酸,总之Spt7是酵母细胞、黑曲霉生长很重要的核蛋白,对 RNA 聚合酶转录的某些基因的表达有关键性的调控作用。
3.3 OE spt7菌体对不良环境的抗逆性分析
过氧化氢作为强氧化剂损耗细胞内抗氧化物质,使细胞抗氧化能力低下,进而引起细胞衰亡。过表达spt7转化子菌体在高浓度过氧化氢环境培养后,发现转化子的生长几乎不受过氧化氢的影响,推测Spt7参与了抗氧胁迫关键性基因的转录调控。有研究显示细胞在与逆境和活性氧做斗争的过程中,细胞进化出一套完整的应答调控机制,通过调节体内活性氧的代谢平衡,来保护DNA、脂质和蛋白质等免受氧化攻击[23]。胞内相应抗氧化酶表达量提高,抗自由基氧化能力增强。在好氧发酵过程氧胁迫是影响发酵菌种生物量和菌体存活的关键因素之一。而过表达spt7提高菌体的抗氧化能力,降低氧胁迫对菌体造成的损失,对菌体发酵及提高发酵产物产量提供了一个思路。
在15%NaCl的高渗透压的条件下培养OE spt7转化子与对照组,生长过程中可见对照组菌体变白,菌落较为干瘪且菌体直径变化不明显。相对对照组转化子菌丝依旧为淡黄色,说明菌体在高渗条件下依旧保持较高的活性。从分子层面分析,推测Spt7蛋白对相关Na+/K+-ATPase亚基基因[24]有所调节,从而提高了菌体对高渗环境的耐受性。
本研究中的黑曲霉1062最适生长温度是30℃,但在39℃条件下,OE spt7转化子较对照组孢子萌发更快、生长状态良好且菌落依然饱满,但是对照组孢子不仅萌发缓慢且在后期生长也滞后且菌落干瘪、失水严重。说明了过表达Spt7可以提高菌体的高温耐受性。
3.4 OE spt7菌体过氧化物酶转录水平分析
常见的抗氧化酶有过氧化氢酶(catalase,CAT)、超氧化物歧化酶Orgotein(superoxide dismutase,SOD)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px),为了验证该猜测,进一步对这些过氧化物酶做转录组分析,验证过表达Spt7对这些酶的影响。从实验结果来看,过表达Spt7对CAT的转录水平无明显影响,但是SOD、GPX、CpeB的转录水平明显上调,推测过表达spt7提高了细胞对氧自由基的氧化损伤的防御,因氧化损伤的根本原因是细胞内蛋白结构的破坏,推测Spt7对维持蛋白结构稳定性有着决定性的作用。接下来对高温耐受性的分析及细胞内热休克打败的转录水平情况分析也进一步证明了该猜测。
在大肠杆菌中有人提出了饥饿诱导交叉保护,即在大肠杆菌细胞生长过程中,因为缺乏必要营养物质而导致细胞生长停滞,细胞内产生过氧化氢酶和其他过氧化物酶使细胞对过氧化氢产生了较强抵抗力[25-28]。另外还有人认为在真核细胞中细胞衰老过程中各种功能逐渐下降是因为在正常生长代谢过程中产生的活性氧(ROS)引起的氧化损伤的累 积[29]。被氧化的蛋白质失去了完整的结构而丧失了催化活性[30],从而引起细胞的衰老与死亡。在耗氧细胞进化过程中产生了相应的抗氧化机制即抗氧化酶如氧化氢酶(CAT)、超氧化物歧化酶(SODs)和谷胱甘肽过氧化物酶(GPXs)。它们协同工作以保护细胞免受来自内源性代谢或外部微环境的过多活性氧物种(ROS)的伤害。它们分工明确,其中CAT将H2O2分解为H2O与O2[31],负责去除高浓度H2O2;而SOD将高活性的超氧阴离子(O2-)歧化为O2与低活性的H2O2[32];GPXs和PRDXs负责降解低浓度下的H2O2[33]。在实验中CAT的转录水平下调,作者推测是H2O2的浓度对于转化子来说过低,不足以CAT发挥作用,所以发挥主要作用的为SOD以及GPX。
3.5 OE spt7菌体热休克蛋白转录水平分析
以往研究表明,在植物细胞中,高温会加快细胞内活性氧(ROS)的积累,从而导致细胞衰老甚至死亡[34-36]。同时应激会导致细胞蛋白质平衡失调和细胞内蛋白质聚集[37-38]。热休克反应机制包括高温引起的热休克转录因子(heat shock factors HSFs)和热休克蛋白(heat shock proteins HSPs)的变化[39]。其中HSF是调节植物中HSP表达的重要转录因子。热休克蛋白具有分子伴侣的功能,可以稳定蛋白质,修复受损的蛋白质,并确保在热应激期间蛋白质的正确组装和折叠[40]。作者对转化子及对照组的部分热激蛋白进行转录水平的观察,有意思的是,在热激3 h条件下,较对照组相比转化子的Spt7转录水平略微上调,但Hsp40、Hsp70及Hsp90的转录水平没有显著性差异;在热激5 h条件下,仅有Hsp90的转录水平发生了差异性的变化。查文献得知当HSP处于应激状态下时,它们的合成速度会很明显的加快,通常能够在半小时内达到巅峰水平。因为此状态下热休克蛋白的合成增多,所以其他的蛋白会相应的合成速度降低,合成数量减少[41]。
从菌体表征看过表达Spt7对菌体的生长及对不良环境的耐受性均有很大的帮助。该蛋白可能对生物细胞内糖代谢、各类氨基酸代谢途径的关键酶基因具有调控作用,作为SAGA复合体的组成成分之一,Spt7可能参与SAGA的调控,在不同的环境中作为单独的调控因子对细胞内相关基因进行定向调控。对黑曲霉内Spt7的研究弥补丝状真菌领域Spt7相关研究的空缺。
4 结论
本文以黑曲霉1062为出发菌株过表达Spt7,OE spt7转化子较原始菌株菌丝生长更茂盛,菌丝分枝增多,且分枝变短,菌体产孢延迟但产孢增多。较原始菌株相比OE spt7转化子的过氧化氢耐受性、高温耐受性及高渗耐受性均明显增强。对不同环境下相关基因的转录情况观察发现,Spt7通过对抗氧化胁迫及高温调控关键性的基因进行转录调控从而提高菌株的不良环境的抗逆性。总之,过表达Spt7有利于菌体的生长及繁殖,在不良环境下,延长了菌体的时序寿命,增加了菌体对不良环境的耐受性。

