猪链球菌血清9型菌株分离鉴定及强毒株筛选
李倩倩,梁 巩,刘锦锦,金 清,龙云志,杨 柳,黄 英,余道兵,宋文博,黄 超,汤细彪
(武汉科前生物股份有限公司,湖北武汉 430000)
猪链球菌(Streptococcussuis,SS)是一种人兽共患病原体,在临床上,可引起猪脑膜炎、关节炎、败血症或急性死亡等,而且易与其他细菌和病毒性病原混合感染,造成养猪业的巨大经济损失[1]。该菌也可感染人,引起脑膜炎、感染性休克和死亡等,威胁着人类生命安全[2]。自20世纪50年代初,荷兰、英国、美国、加拿大、巴西、丹麦、日本、中国等国家先后报道了猪链球菌病[3-4]。2003年-2013年间,34个国家或地区报告了1 500多例人类感染病例[1]。2005年7月,中国四川资阳暴发了最大规模的猪链球菌感染人事件,造成204人感染,38人死亡[5-6]中国已有13个省市报道了猪链球菌病,并在华南、西南和华东地区出现大流行,严重威胁着我国的养猪业[7]。总之,猪链球菌给公共卫生带来威胁,需要相关科研人员的关注。
根据猪链球菌菌体荚膜多糖抗原性的区别,猪链球菌可分为33种血清型,分别为1型~31型、32型和1/2型,而血清33型和34型归类于Streptococcusorisratti,不属于猪链球菌[8]。本研究中主要采用Liu Z等[9]开发的4种多重PCR检测分型方法,是根据猪链球菌的不同血清型参考菌株CPS基因差异区域,设计特异性引物进行分型。该方法快速且具有成本低的优点,可用于分离株的分型。
近年来,随着集约化和规模化养猪的不断发展,给猪链球菌的发生和传播提供了良好的条件,促进了疾病的发生和流行。猪链球菌的防控原则主要是以预防为主,不仅要加强消毒、减少应激、加强饲养管理,而且要制定合理的免疫程序[10]。对于细菌引起的疾病通常采取抗菌药物治疗,但是抗菌药物的使用效果不佳,容易产生耐药性从而影响后续的治疗。因此,对于该病的防控最有利的措施就是疫苗[11]。迄今为止,人们对于猪链球菌2型的研究从未停止。虽然2型在猪链球菌所有血清型中分布最广,毒力最强,但是近年来调查研究显示猪链球菌9型的致病率和分离率有明显上升的趋势[12]。Zhang B等[13]对2013年-2017年我国猪场猪链球菌流行率的调查研究发现,我国猪链球菌主要为血清2型、9型、7型、3型、1型、5型,2型的分离率依然是最高。但值得关注的是,2型流行率从2013年的52.4%下降至2017年的33.6%。然而,随着时间推移,猪链球菌9型逐年持续增高,从12.1%升高至25.8%。然而市场上没有针对猪链球菌9型的商品化疫苗,所以本研究对分离鉴定的猪链球菌9型进行强毒株筛选及相关生物学特性研究,为后续疫苗的开发及疫病防控策略提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 玉米大蜡螟幼虫1 650只,体重0.2 g~0.3 g,购自武汉维物起源生物科技有限公司;SPF级4周龄、雌性Balb/c小鼠326只,购自北京维通利华实验动物技术有限公司。
1.1.2 菌株及临床病料 试验用菌种SS2 ZYS为2005年四川资阳分离的猪链球菌血清2型菌株;SS7 YZ为2005年8月从湖南永州某猪场送检的病料中分离的猪链球菌血清7型;该2株菌种均由武汉科前生物股份有限公司保存。试验用临床分离株由武汉科前生物股份有限公司诊断中心从送检的病料中分离、鉴定、保存。
1.1.3 主要试剂 Tryptic Soy Agar(TSA,CNL17-B0033)、Tryptic Soy Broth(TSB,CNL17-B0022)培养基,美国BD公司产品;Gibco新生胎牛血清(1999577),武汉维物起源生物科技有限公司产品;革兰氏染液(20180314),青岛海博生物技术有限公司产品;2×M5 HiPer pulsTaqHiFi PCR mix(MF002-puls-10)、M5 HiPure Next Ⅲ Gelred 第三代胶红核酸染料(MF380-01),北京聚合美生物科技有限公司产品;引物,武汉擎科生物技术有限公司产品。
1.1.4 主要仪器 东胜龙PCR仪(ETC811),苏州东胜兴业科学仪器有限公司产品;电泳仪(DYY-8C型),北京六一生物科技有限公司产品;高速台式离心机(H1850),湖南湘仪实验室仪器开发有限公司产品;DL-CJ-2ND Ⅰ洁净工作台,北京东联哈尔仪器制造有限公司产品;恒温振荡器(SHZ-8-2),国华(常州)仪器制造有限公司产品;凝胶成像系统(BG-GDSAUT0520),北京杰瑞恒达科技有限公司产品。
1.2 方法
1.2.1 SS2 ZYS和SS7 YZ复苏 将冻干保存的菌种取少量固体小块置于TSA平板(含100 mL/L新生牛血清)上,待其溶解后,用经酒精灯火焰灼烧后冷却的接种环蘸取菌液进行划线,37 ℃静置培养18 h~24 h。挑取单菌落进行划线、传代、纯化。纯化后的单菌落进行PCR鉴定。
1.2.2 猪链球菌分离 在超净工作台中无菌采集病料(心脏、肝脏、肾脏、肺脏、脾脏、淋巴结、关节液等)接种于TSA平板(含100 mL/L新生牛血清)上,37 ℃静置培养18 h~24 h。选取疑似链球菌形态的单菌落进行PCR鉴定、革兰氏染色、镜检,选取革兰氏染色阳性的、链状的单菌落继续在TSA平板上划线、传代。纯化2代~3代后菌株,用500 mL/L甘油保存菌液,置于-20℃保存,备用。
1.2.3 菌体PCR鉴定 按照参考文献[9],根据荚膜多糖合成基因设计猪链球菌血清型9分型引物(表1)。以猪链球菌DNA为模板进PCR扩增。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 40 s,72 ℃ 50 s,共35个循环;72 ℃10 min;16 ℃结束反应。PCR产物进行10 g/L琼脂糖凝胶电泳120 V电泳35 min,在凝胶成像系统下观察有无条带及条带大小。

表1 猪链球菌鉴定及血清型9型PCR引物序列
1.2.4 玉米大蜡螟模型筛选 选取825只体重0.2 g~0.3 g的玉米大蜡螟幼虫随机分为33组,29组分别注射猪链球菌血清9型临床分离株,2组分别攻SS2 ZYS和SS7 YZ,设置PBS和空白对照组,每组各25只;采用玉米大蜡螟最后尾足腹腔注射,注射剂量为25 μL,攻菌剂量为5.0×107CFU/mL。攻菌后置于37 ℃、体积分数为5%的CO2恒温培养箱中避光培养,持续观察5 d,每24 h记录玉米大蜡螟的死亡情况,玉米大蜡螟通体变黑,晃动平皿大蜡螟不动即认为其死亡。该筛选试验重复2次,选取死亡率较高的菌株进行Balb/c小鼠的筛选。
1.2.5 Balb/c小鼠筛选 选取286只4周龄、雌性Balb/c小鼠进行3轮猪链球菌血清型9型强毒株筛选,随机分为3组,分别猪链球菌血清9型临床分离株组、SS2 ZYS和SS7 YZ对照组、PBS对照组,每组10只~11只小鼠;第1、2轮筛选,采用腹腔注射,各菌株的攻菌量为5.0×109CFU/mL,注射剂量为200 μL。第3轮筛选,降低菌量,采用腹腔注射,各菌株的攻菌量为1.0×109CFU/mL左右,注射剂量为200 μL。攻菌后连续[14]观察5 d,记录小鼠的死亡情况。
1.2.6 毒力基因检测 根据参考文献[15],选择猪链球菌的主要毒力因子胞外蛋白因子(epf)、溶血素(sly)、溶菌酶释放蛋白(mrp)、纤连蛋白(fbps)、甘油醛-3-磷酸脱氢酶(gapdh)、毒力相关因子(orf2)、89k毒力岛、谷氨酸脱氢酶(gdh)作为鉴定基因,合成8对引物(表2)。以筛选后得到的1株强毒株的DNA作为模板进行PCR扩增,从而确定SS9-22的基因型。

表2 猪链球菌主要毒力基因PCR扩增引物
1.2.7 生长曲线测定 在无菌操作台中挑取TSA平板(含100 mL/L新生牛血清)上经过传代、纯化的单菌落,接种于10 mL TSB培养基(含 100 mL/L新生牛血清)中,37 ℃、200 r/min振荡培养5 h~8 h,作为种子液。将种子液按10 mL/L的比例接入30 mL TSB培养基(含100 mL/L新生牛血清)中,37 ℃、200 r/min振荡培养,每隔2 h取出200 μL菌液于96孔板中,测量OD600 nm值,每管重复3个孔,取平均值,绘制生长曲线。
1.2.8 Balb/c小鼠致病性试验 将SS9-22菌株种子菌液按10 mL/L的比例转接于60 mL TSB培养基(含100 mL/L新生牛血清)中,37 ℃、200 r/min振荡培养6 h,吸取100 μL菌液进行10倍倍比稀释,涂平板,从而计算细菌浓度。收集菌液,5 000 r/min离心10 min,弃上清,用原培养基的1/10倍体积的PBS重悬菌体。将40只Balb/c小鼠分为5组,每组8只SS9-22菌株设置4个浓度梯度,分别为1.8×109、1.8×108、1.8×107、1.8×106CFU/只进行腹腔注射攻毒,每只小鼠注射剂量为200 μL,同时设置PBS对照组。连续观察7 d,记录每组小鼠的死亡况。
2 结果
2.1 细菌分离培养
从发病猪的病料中分离出的猪链球菌在TSA平板(含100 mL/L新生牛血清)上生长良好,菌落呈现灰白半透明,针尖大小,光滑整齐,在强光下观察可见浅蓝色荧光。通过革兰氏染色发现,菌体在显微镜下呈现短杆状或短棒状,且多数由3个以上的菌体形成链状(图1),表明分离出的细菌为猪链球菌。
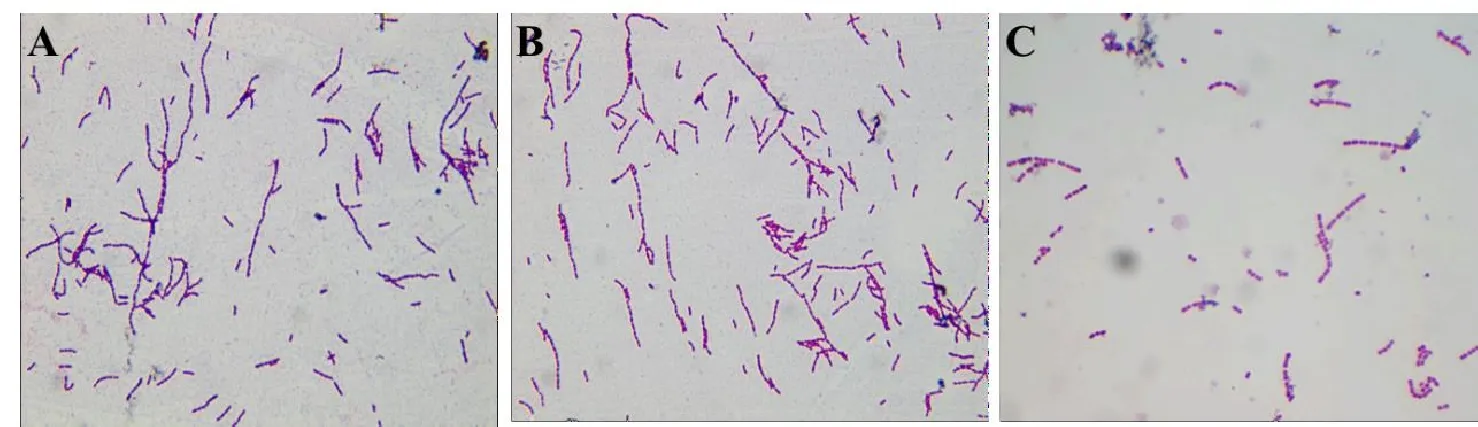
图1 部分临床分离菌株革兰染色镜检结果(1 000×)
2.2 PCR鉴定
将SS9型特异性引物扩增出的目的条带的菌株进行保存,用于后续试验。经PCR鉴定后获得了29株猪链球菌血清型9型菌株,分别命名为SS9-1~SS9-29(图2)。
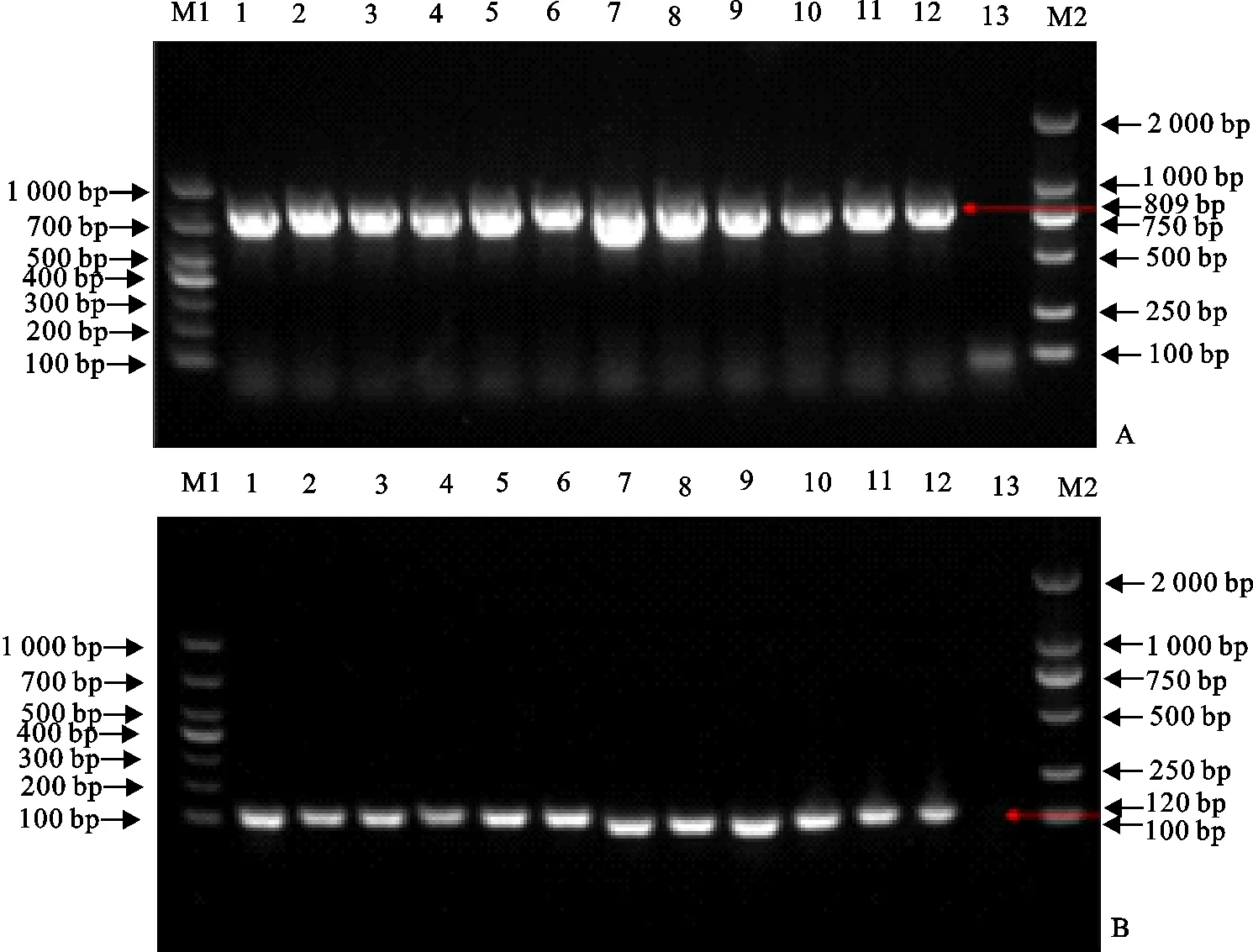
A.cps9J;B.thrA;M1.DNA 标准DL 1 000;1~12.临床分离菌株;13.ddH2O对照;M2.DNA 标准DL 2 000
2.3 玉米大蜡螟筛选
玉米大蜡螟的两次试验结果见表3。猪链球菌SS2 ZYS和SS7 YZ对照组的死亡率高达85%以上,PBS对照组死亡率在4%~10%左右,空白对照组死亡率为0,表明该玉米大蜡螟筛选具有一定的参考意义。通过分析2次筛选的死亡率,选取2次结果死亡率较高的13株进行后续Balb/c小鼠筛选,编号分别为SS9-1、SS9-4、SS9-6、SS9-7、SS9-9、SS9-15、SS9-18、SS9-20、SS9-22、SS9-23、SS9-24、SS9-26、SS9-27。

表3 猪链球菌血清型9型29株菌株在玉米大蜡螟上的2轮筛选结果
2.4 Balb/c小鼠筛选
小鼠攻毒筛选试验结果见表4,根据第1次筛选死亡时间及死亡率,发现13株中有8株的死亡率均为100%,5株的死亡率在63%~91%之间。而死亡率100%的8株中,6株在第1天小鼠全部死亡,其他2株在2 d后全部死亡。随即对这6株菌株进行第2轮筛选,根据攻菌量、死亡时间及死亡率发现,SS9-20、SS9-22、SS9-26的致病性较强。随后,进一步降低攻菌量,发现SS9-20、SS9-22相对强于SS9-26,死亡率为100%。
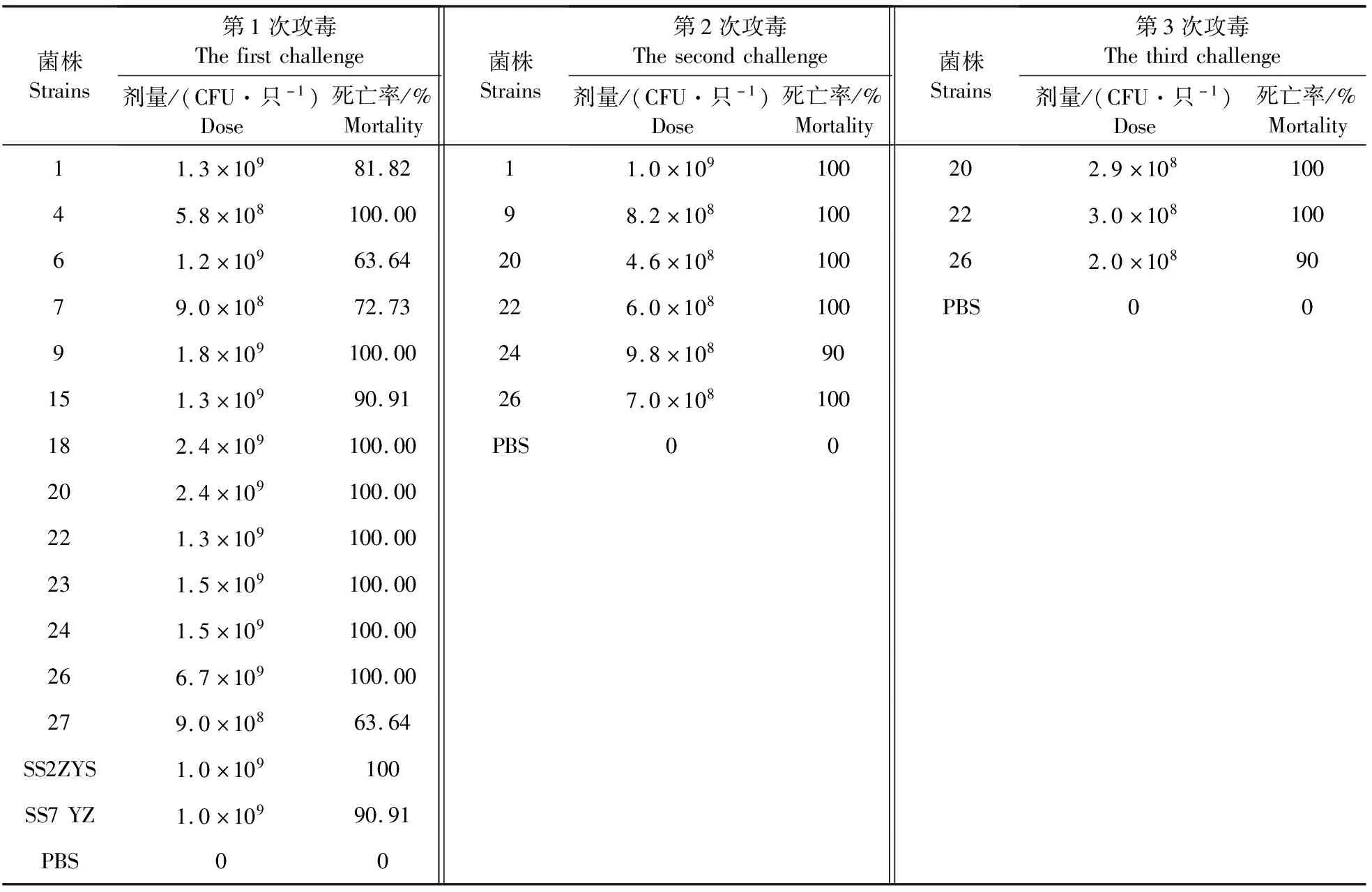
表4 猪链球菌血清型9型菌株在Balb/c小鼠的3轮筛选结果
2.5 毒力基因鉴定
对菌株SS9-22进行毒力基因扩增,结果表明该菌株的基因型为gapdh+/sly+/fbps+/orf2+/mrp﹣/89K﹣/gdh+/epf+(图3)。

M.DNA 标准DL 1 000;1.gapdh;2.sly;3.fbps;4.orf2;5.mrp;
2.6 生长曲线测定
根据不同时间液体培养物中猪链球菌的密度变化绘制生长曲线,1 h~4 h为迟缓期,4 h~6 h为对数生长期;6 h~14 h为稳定期(图4)。表明菌株SS9-22培养6 h~8 h液体培养基中细菌的浓度最大,可获得大量的细菌抗原。
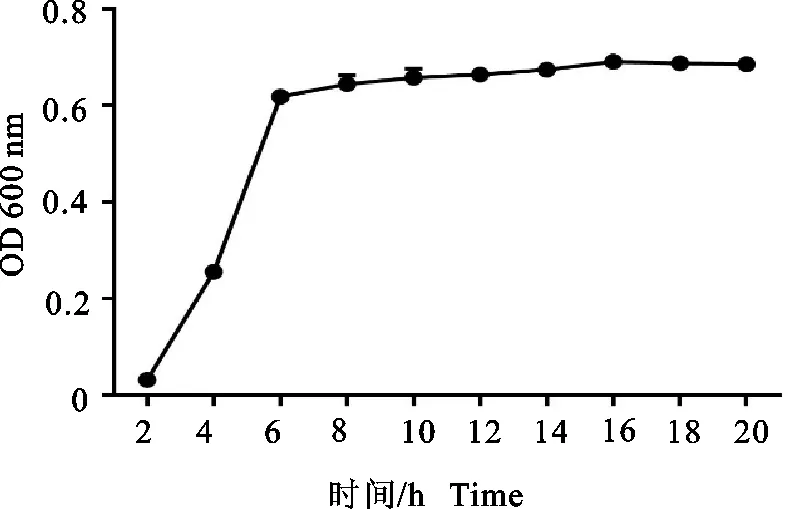
图4 SS9-22 菌株的生长曲线
2.7 Balb/c小鼠致病性试验
SS9-22菌株分别以1.8×109、1.8×108、1.8×107、1.8×106CFU/只的菌量对Balb/c小鼠进行攻毒试验。攻毒5 d后,每组小鼠的死亡情况见表5。根据改良寇氏法计算,SS9-22菌株对Balb/c小鼠的LD50为3.2×107CFU。
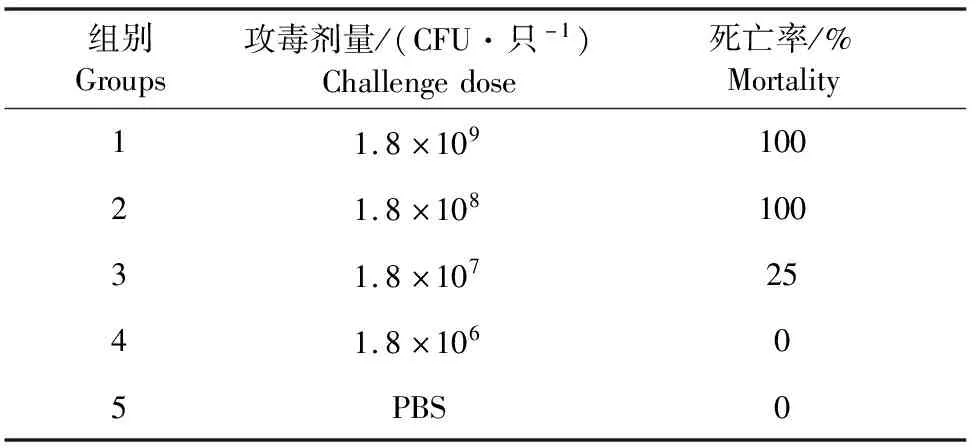
表5 猪链球菌SS9-22菌株的攻毒剂量及存活情况
3 讨论
本研究主要基于武汉科前生物股份有限公司的诊断中心平台,获得全国各地的发病猪的病料,对这些病料进行细菌分菌,分离了大量的猪链球菌。通过形态学观察、革兰氏染色、PCR鉴定的方式确定了29株猪链球菌血清9型,分别命名为SS9-1~SS9-29。
猪链球菌是一种常见病原菌,在环境中,猪链球菌无毒和强毒株均可猪群中分离,因此需要一种方便、可靠及标准化的动物模型来快速评估其毒力。众所周知,猪和小鼠已成功用于猪链球菌毒力的研究[16-17]。然而,与非哺乳动物感染模型相比,猪和小鼠在经济、物流和伦理方面存在劣势。玉米大蜡螟(Galleriamellonella)幼虫已成功用于人类和动物传染病的研究,Velikova N等[18]开发了该动物模型用于猪链球菌毒力的评估。该模型不受伦理立法的约束,且购买便宜、方便,在 37 ℃(自然宿主的体温)下可用大量样品进行试验。因此,为了从多株血清9型中筛选出强毒株,采用了玉米大蜡螟模型对29株猪链球菌血清9型菌株进行2轮初步筛选,确定了13株毒力较强的菌株。随后通过Balb/c小鼠模型进行了3次复筛,确定了2株毒力血清9型强菌株SS9-20、SS9-22。
目前,人们对猪链球菌的毒力基因的致病机制尚不清晰,但普遍认为其致病性强弱大多数与该菌株的毒力基因分布存在相关性[19]。调查发现,我国分离的猪链球菌血清2型菌株中大多数菌株的主要毒力基因表型为mrp+/epf+/sly+/fbps+,而9型猪链球菌的毒力基因分布尚不清楚[20]。本试验通过PCR的方法对SS9-22菌株进行了毒力基因的检测,发现该菌株的基因型为gapdh+/sly+/fbps+/orf2+/mrp﹣/89K﹣/gdh+/epf+,检测到了猪链球菌2型的epf致病性特征毒力基因。通过致病性试验发现,该菌株的LD50为3.2×107CFU,对小鼠具有很强的致病性。
为了进一步探究强毒株SS9-22的生长趋势,发现SS9-22在TSB(含100 mL/L新生牛血清)中培养时,2 h即可进入对数期,5 h~6 h到达平台期,与文献中SS2生长曲线相比,SS9进入对数生长期的时间比SS2要快。灭活疫苗制备需要获得大量的活菌,而该菌株的生长特性不仅提高了工作效率而且降低生产成本,可选用6 h菌液来进行生产,获得大量的抗原。
目前,已经商品化的猪链球菌疫苗主要有6种,分别为猪链球菌病蜂胶灭活疫苗、猪链球菌病灭活疫苗(猪链球菌2型+马链球菌兽疫亚种)、猪败血性链球菌病活疫苗、猪链球菌病-副猪嗜血杆菌病二联灭活疫苗、猪链球菌病灭活疫苗(猪链球菌2型+猪链球菌7型+马链球菌兽疫亚种)及猪链球菌灭活疫苗(2型,HA9801株)等[21]。近年流行病学调查发现,血清2型仍然具有较高的流行率,但血清9型的致病率和分离率有明显上升的趋势。由于猪链球菌不同血清型菌株之间的交叉保护性差,且市面上尚无针对血清9型的商品化疫苗,因此本研究中筛选血清9型强毒株及对强毒株进行相关生物学特性研究起着重要作用,为后续血清9型疫苗的研制提供了数据支持。

