过表达TBX2对胶质瘤细胞增殖和侵袭的影响
刘小江 管 诚 李 军 管义祥
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,病死率呈逐年增加趋势[1,2]。尽管在过去的几十年中,胶质瘤的诊治取得了重大进展,但其临床结局仍然不理想,中位生存期约为14个月[3]。目前,胶质瘤的标准治疗方法是手术辅助替莫唑胺治疗和放疗[4],但是5年总生存率不超过35%[5]。因此,研究者开始逐步开发分子靶向疗法、免疫疗法、基因疗法和新型药物递送技术。相比于其他肿瘤,目前仍缺乏对胶质瘤诊疗的有效分子靶标[6,7]。因此,探讨胶质瘤肿瘤诊断和治疗的分子靶标和其分子机制具有重要意义。
TBX2 是保守化转录因子T-box 家族的成员之一[8,9]。研究发现TBX2在多种恶性肿瘤中呈高表达,在肿瘤演变的过程中发挥作用[10~13]。本文探讨TBX2在胶质瘤中的表达,及其过表达对胶质瘤细胞恶性生物学行为的影响,从而为胶质瘤的诊治、预后评估等提供参考。
1 材料与方法
1.1 组织标本来源 收集2017 年7 月~2019 年6 月手术切除并经术后病理证实的胶质瘤样本以及对应的瘤旁组织(术前静脉注射荧光素钠,术中使用荧光显微镜观察肿瘤的颜色跟质地以判断肿瘤的边界,距肿瘤组织1 cm 以上认为是瘤旁组织)各53 例,其中男30 例,女23 例;年龄35~71 岁。WHO 分1~2 级24例,3~4 级29 例。所有病人术前均未行放疗或化疗。本研究已经我院伦理委员会审核通过。
1.2 细胞培养 胶质瘤细胞U251、U87、SHG-44(中国科学院细胞库)使用含10%胎牛血清(美国Invitrogen公司)的DMEM(美国Invitrogen 公司)培养,人正常星型胶质细胞(HA1800;中国科学院细胞库)使用RPMI 1640(美国Invitrogen 公司)培养,待细胞融合达到80%~90%时,进行传代以备后续实验使用。
1.3 细胞转染 构建过表达TBX2(TBX2-OE)及干扰TBX2(TBX2-sh)质粒,分别用空载体(negative control,NC)-OE 和NC-sh 作为对照。取对数生长期U251细胞,用LipofectamineTM 2000试剂盒(美国Invitrogen公司)进行转染,48 h后检测转染效率。
1.4 实时荧光定量PCR 检测mRAN 使用Trizol 试剂(上海通蔚生物有限公司)提取组织以及细胞总mRNA,严格按照逆转录试剂盒说明书(上海双赢生物科技有限公司)将mRNA 逆转录成cDNA。使用SYBR Green 荧光试剂盒(上海双赢生物科技有限公司)扩增目的基因,采用2-ΔΔCt法量化,以GAPDH为内参。引物序列:TBX2 正义链5′-CACTCGCTTGACCGAACCC-3′,反义链5′-CGCACTGTCTGTCTGCACCA- 3′;GAPDH 正 义 链5′- CTGCCCAGAACATCATCCCT-3′,反 义 链5′-TGAAGTCGCAGGAGACAACC-3′。
1.5 免疫印迹法检测蛋白表达 使用预冷磷酸盐缓冲液洗涤组织及细胞3 次,用RIPA 裂解液(上海碧云天生物技术有限公司)冰上裂解30 min,4 ℃、12 000 g 离心20 min 留取上层蛋白清液。使用BCA 试剂盒测定蛋白浓度。SDS-PAGE 电泳分离后,转移至PVDF 膜。使用封闭液室温封闭1 h。4 ℃条件下与一抗(上海碧云天生物技术有限公司)孵育过夜,用TBST洗涤PVDF膜3次,加入对应二抗(上海碧云天生物技术有限公司)在室温下孵育1 h。使用ECL发光试剂盒(上海碧云天生物技术有限公司)显像。β-actin用作内参,用Image J测定蛋白条带灰度。
1.6 细胞增殖的测定及细胞生长曲线的绘制 将稳定转染的U251细胞以1×104个/孔接种于96孔板,根据试剂盒说明,0、24、48、72、96和120 h进行WST-1分析(上海碧云天生物技术有限公司)。弃除培养基后使用PBS 冲洗细胞3 次,向各孔中加入含10 μL WST-1 及90 μl 正常培养基溶液的混合培养液,37 ℃孵育30 min,使用酶标仪测定450 nm 处吸光度,并绘制细胞生长曲线。
1.7 细胞侵袭的测定 将稳定转染的U251细胞以1×105个/孔接种于涂有基质胶的Transwell 聚碳酸酯滤膜上,加入200 μl无血清的培养基;下层小室加入含10%胎牛血清的正常培养基,将细胞放回培养箱继续培养48 h。在室温下,依次用3.7%甲醛固定细胞15 min,用含有0.1%结晶紫10%乙醇溶液染色30 min。除去多余染液,在光学显微镜下观察,400 倍视野下计数侵袭细胞数。
1.8 统计学分析 采用SPSS 19.0软件分析;定量资料以±s表示,采用t检验和单因素方差分析;以P<0.05表示差异有统计学意义。
2 结果
2.1 胶质瘤组织TBX2 表达变化 相比于瘤旁组织,胶质瘤组织TBX2 mRNA 和蛋白表达水平均明显增加(P<0.05);并且,高级别胶质瘤组织TBX2 mRNA和蛋白水平均显著高于低级别胶质瘤(P<0.05)。见图1。

图1 胶质瘤组织TBX2 mRNA和蛋白表达水平
2.2 胶质瘤细胞系TBX2的表达变化 相比于人正常星型胶质细胞系HA1800,胶质瘤细胞系U251、U87、SHG-44细胞TBX2 mRNA和蛋白表达水平均明显增高(P<0.05)。此外,U251 细胞TBX2 表达水平显著高于U87 和SHG-44 细胞(P<0.05),因此使用U251细胞进行后续实验。
2.3 细胞转染质粒的有效性验证 相比于NC-OE组,TBX2-OE 组U251 细胞TBX2 mRNA 和蛋白表达水平均显著增加(P<0.05)。与NC-sh组比较,TBX2-sh组U251细胞TBX2 mRNA和蛋白表达水平均显著降低(P<0.05)。
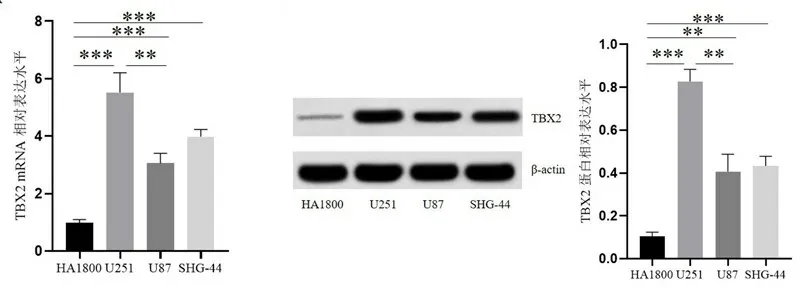
图2 胶质瘤细胞系TBX2 mRNA和蛋白表达水平
2.4 TBX2 表达水平与胶质瘤U251 细胞增殖及侵袭的关系 过表达TBX2 显著增加U251 细胞增殖和侵袭能力(P<0.05);低表达TBX2 显著抑制U251 细胞增殖和侵袭能力(P<0.05)。见图3

图3 细胞转染质粒的有效性验证
3 讨论

图4 TBX2表达与胶质瘤U251细胞增殖和侵袭的关系
本文结果显示胶质瘤组织TBX2 的表达水平显著增加,尤其是高级别胶质瘤。这提示TBX2可能与胶质瘤的发生发展相关。Pan 等[14]发现胶质母细胞瘤TBX2表达上调,明显降低E-钙粘蛋白的表达、增加波形蛋白的表达,增强细胞侵袭能力。本文结果显示TBX2 过表达明显促进胶质瘤细胞增殖及侵袭。目前,TBX2发挥促肿瘤作用的信号通路尚不清楚。Liu等[15]发现TBX2可通过ERK信号通路增强胃癌细胞的上皮间充质转化和侵袭能力。另外,TGFβ1信号通路可能与TBX2促进肿瘤细胞增殖和迁移有关[16]。
总之,胶质瘤TBX2 表达上调,过表达TBX2 可显著增强胶质瘤细胞的增殖、侵袭能力。

