电针激痛点对慢性肌筋膜疼痛综合征大鼠脊髓背角胶质细胞的影响*
王 列 马 帅 马铁明△ 马俊杰 胡 哲 林德龙
1辽宁中医药大学针灸推拿学院,沈阳 1108472辽宁省针灸养生康复重点实验室,沈阳 1108473沈阳市第七人民医院神经内科,沈阳 1100034 北京中医药大学第二临床医学院,北京 100105
肌筋膜激痛点(myofascial trigger points,MTrPs)为肌肉组织紧绷区域中异常的敏感小点[1]。在临床上,若MTrPs引发所在骨骼肌疼痛、抽搐反应以及远端牵涉痛等症状,可认为该MTrPs处于激活状态,由该MTrPs引发的系列症状称之为肌筋膜疼痛综合征(myofascial pain syndrome,MPS)[2]。当MTrPs处于激活状态一旦超过3个月,则使急性MPS转变成慢性MPS,此时患者不仅慢性疼痛症状明显,且易伴有焦虑、抑郁、睡眠障碍等问题。
目前,MTrPs形成机制尚不明确,但它是MPS发病的直接病因。临床多用肌松药或非甾体抗炎药来治疗MPS[2],其可改善肌肉局部挛缩,缓解疼痛症状,但不能从根本上灭活MTrPs。针灸技术能打破MTrPs局部能量危机,改善微循环,降低炎症因子水平,是有效的MTrPs灭活措施[3],但其作用机制的研究多停留在周围局部组织层面,尚缺乏脊髓及以上的机制研究。近年研究发现,脊髓背角中的星形胶质细胞和小胶质细胞在MTrPs活化与诱发牵涉痛及中枢敏化中起着重要作用[4]。本研究通过建立慢性MPS大鼠模型,观察电针激痛点治疗慢性MPS是否与调节脊髓背角星形胶质细胞胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和小胶质细胞特异表达补体受体-3的单克隆抗体(OX-42)表达有关,以探讨电针治疗慢性MPS的可能机制,为今后的深入研究奠定生物学基础。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠24只(SPF级,7周龄,体质量220 g~250 g,由辽宁长生生物技术有限公司提供,许可证号:SCXK(辽)2015-0001。大鼠在室温(25±1)℃、相对湿度(50%±3%)条件下自由摄食和饮水,适应性饲养1周。
1.2 实验试剂及仪器
兔抗鼠GFAP单克隆抗体(武汉华美生物工程有限公司);兔抗鼠OX-42单克隆抗体(GeneTex公司);PBS缓冲液、DAB显色剂素(北京博奥森生物技术有限公司)。
FT-200动物跑步机(成都泰盟软件有限公司);BL-420 S生物机能实验系统(成都泰盟软件有限公司);电针仪(汕头医用设备厂有限公司);华佗牌无菌针灸针0.35 mm×40 mm(苏州医疗用品厂有限公司);徕卡全自动免疫组化及原位杂交染色机(德国Leica);多功能酶标仪(德国伯托公司);自制打击装置。
1.3 模型复制及分组
将24只健康雄性SD大鼠随机分为正常组、模型组、电针组,每组8只。采用黄强民团队[5]提出的钝性打击结合离心运动方式进行造模。每周先进行一次钝性打击,第二天将打击后的大鼠放在倾斜角为16°的动物跑台上,离心运动90 min,速度逐渐增大至16 m/min,余下5天休息。重复干预8周后,恢复4周。模型复制满足以下3个条件即为成功:①出现局部肌紧张带或结节;②静息状态下出现自发电位;③针电极刺激紧张带处出现局部抽搐反应。
1.4 电针干预
造模成功后,电针组大鼠采用0.35 mm×40 mm毫针斜刺并贯穿激痛点结节,提插、捻转引发局部抽搐反应后,连接电针仪,施以频率2~20 Hz的疏密波,电流强度以大鼠左下肢出现轻微颤动为宜,留针15 min,1次/d,连续治疗7 d。正常组、模型组大鼠在相同时间和地点采取相同方式进行抓取和固定,但不采取任何治疗措施。
1.5 检测指标与方法
1.5.1 自发电活动频率检测 治疗结束后,用10%水合氯醛(3 mL/kg)进行腹腔麻醉,仰卧位固定后在左下肢股内侧肌部位寻找肌肉紧张带或结节,使用BL-420 S生物机能实验系统,电极针缓慢插入紧张带或结节处,每次移动电极针约1mm,当肌电图出现稳定的自发电活动时,记录发生的自发电活动频率,并予以标记。
1.5.2 动物取材 自发电位检测后,在标记处切取1 cm3肌肉组织,置于4%多聚甲醛固定。随后大鼠俯卧位,依次切开并剥离背部正中皮肤、筋膜和肌肉,打开椎管,取L4~6腰膨大段脊髓组织,浸泡于4%多聚甲醛中固定保存,供免疫组化检测使用。
1.5.3 苏木素-伊红染色(HE染色)观察激痛点周围肌肉组织病理变化 主要步骤:修材;4%多聚甲醛固定;梯度酒精法脱水;二甲苯透明;浸蜡包埋;石蜡机切片,厚度5μm;脱蜡;苏木精染色;透明、封固。400倍光镜下观察骨骼肌形态及病理变化。
1.5.4 免疫组化法检测大鼠脊髓背角GFAP、OX-42阳性细胞表达 主要步骤:脱蜡水化;滴加3%过氧化氢,室温下孵育20 min;滴加一抗(GFAP 1∶3000,OX-42 1∶1000);滴加二抗,37℃温箱孵育;DAB显色;苏木精复染;脱水、透明、中性树胶封片。光学显微镜下随机选取高倍视野4个,观察GFAP、OX-42在脊髓背角中的阳性细胞表达。
1.6 统计学分析
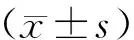
2 结果
2.1 各组大鼠自发电位及活动频率比较
肌电图结果显示:正常组在静息状态下无异常自发电位;与正常组比较,模型组出现一系列高频低幅的背景电位(箭头处)和振幅相对较高的峰电位(虚线箭头处),可持续超过30 s,但是不超过10 min;见图1A。与正常组比较,模型组自发电位活动频率明显增多(P<0.05);与模型组比较,电针组有2只大鼠异常自发电活动消失,其余均可见偶发的自发电活动,且频率明显降低,差异有统计学意义(P<0.05)。见图1B。
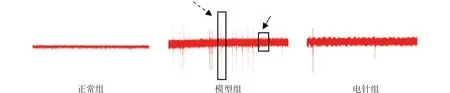
灵敏度200 μV/D;扫描速度250 ms/D图1A 各组大鼠左下肢股内侧肌肌电图

与正常组比较▲P<0.05;与模型组比较■P<0.05图1B 各组大鼠左下肢股内侧肌自发电位活动频率比较
2.2 各组大鼠左下肢股内侧肌病理形态学变化
正常组大鼠横切面肌细胞多呈规则多边形,大小均匀,排列紧密、整齐,每个细胞边缘可见多个细胞核,且细胞核位于肌膜下(图2A横切面箭头)。纵切面肌纤维排列紧密、规律,粗细均匀一致,细胞核大多分布于肌纤维膜下(图2B纵切面箭头)。
模型组大鼠横切面可见多个大小不等的增大、圆染的肌细胞,增大肌细胞的周围多出现相对较小的圆形或椭圆形肌细胞(图2C横切面箭头),并出现不同程度炎性细胞浸润与核内移现象(图2C横切面虚线箭头)。纵切面可见肌纤维粗细不等,排列紊乱,挛缩结节处出现大面积的粘连区域,并伴有大量炎性细胞浸润现象(图2D纵切面箭头)。
电针组大鼠横切面显示,肌细胞形态已基本接近于正常(图2E横切面箭头);纵切面显示,电针组肌纤维逐渐恢复,形态接近于正常组,但仍可见轻微萎缩、变性及炎性细胞浸润现象(图2F纵切面箭头)。
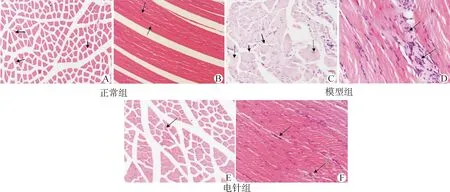
图2 各组大鼠左下肢股内侧肌病理形态学变化(×400倍)
2.3 各组大鼠脊髓背角GFAP阳性细胞表达
正常组大鼠脊髓背角中可见散在的浅棕褐色GFAP阳性神经细胞,突起细而小,胞体形态不清晰,模型组大鼠脊髓背角中GFAP阳性细胞明显密集,呈深棕褐色,表达增强,与正常组相比差异具有统计学意义(P<0.05);与模型组比较,电针组GFAP阳性细胞表达明显减少(P<0.05)),染色略浅。见图3A、图3B。
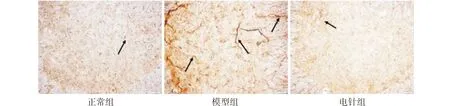
图3A 各组大鼠脊髓背角GFAP阳性细胞的表达(×100倍)

与正常组比较▲P<0.05;与模型组比较■P<0.05图3B 各组大鼠脊髓背角GFAP阳性细胞表达比较
2.4 各组大鼠脊髓背角OX-42阳性细胞表达
正常组大鼠在脊髓背角中可见少量OX-42阳性细胞;模型组阳性细胞数量密集,染色加深,胞体变大,突起缩短,从分支状变成变形虫样形态,与正常组相比,表达明显增强(P<0.05));电针组OX-42阳性细胞与模型组相比,表达下降(P<0.05)。见图4A、图4B。
3 讨论
MPS属中医学“筋痹”范畴,病位在筋,《灵枢·刺节真邪》云:“一经上实下虚而不通者,此必有横络盛加于大经之上,令之不通”,指出本病因“横络”卡压致经脉气血不通所致。“横络”现代医学解释为肌肉组织因长期劳损或外伤形成的条索、结节或粘连等结筋病灶点,这与MTrPs的病理特点极为相似[6]。中医采用“以痛为腧”的理论和“解结”之法来解除横络治疗筋痹。现代医学认为直接精准靶向性灭活MTrPs是治疗慢性MPS的关键。临床研究[7]证实,电针治疗慢性MPS疗效确切,镇痛效果良好,故本实验选用电针激痛点。

图4A 各组大鼠脊髓背角OX-42阳性细胞表达(×400倍)
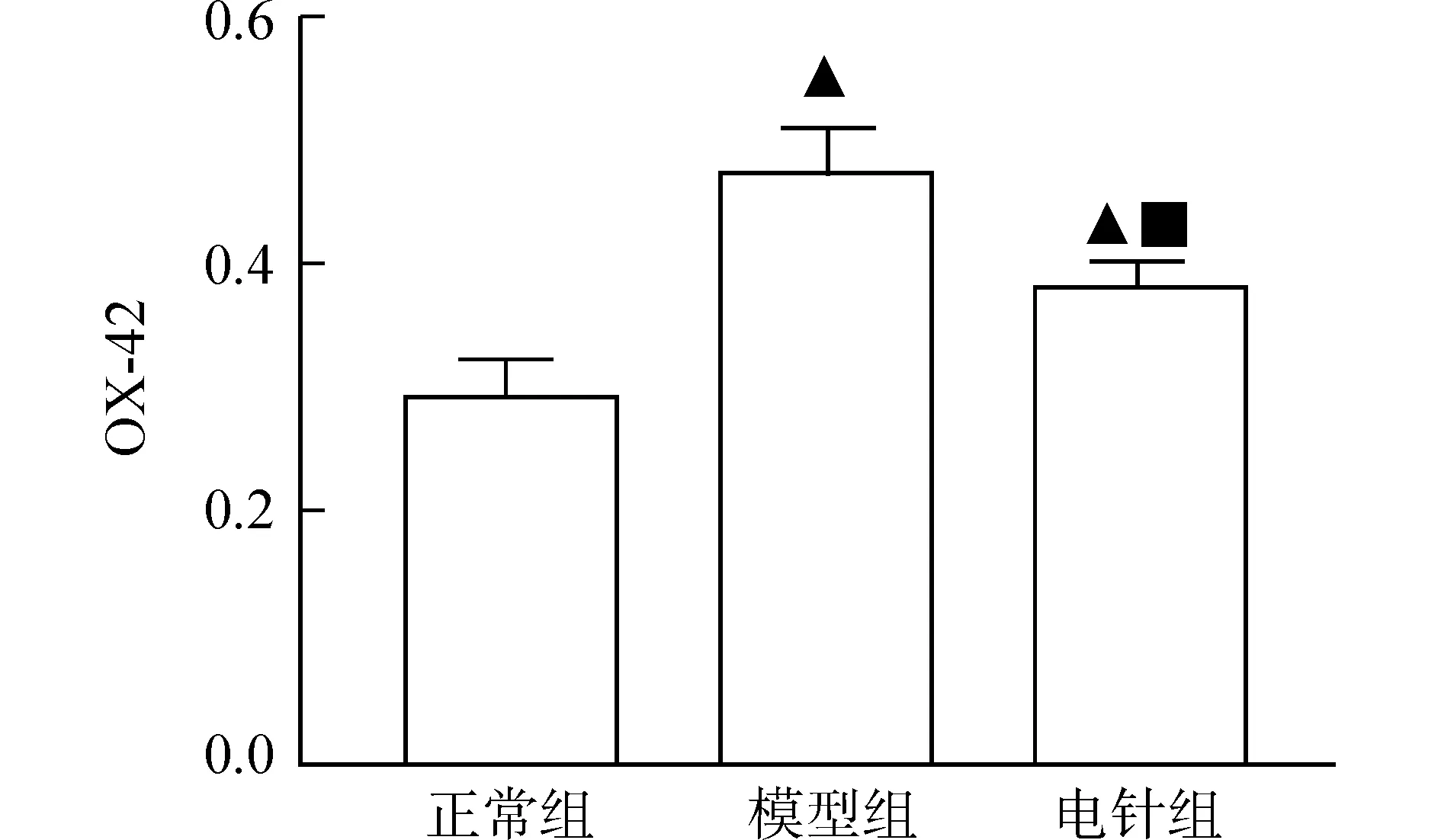
与正常组比较▲P<0.05;与模型组比较■P<0.05图4B 各组大鼠脊髓背角OX-42阳性细胞表达比较
MTrPs有隐性和活跃之分[1]。隐性MTrPs可被激活,不仅造成其所在肌肉组织局部疼痛,还引发远端牵涉痛[2]。牵涉痛发病机制与脊髓背角水平的中枢神经系统敏化密切相关[8]。神经胶质细胞(主要是星形胶质细胞和小胶质细胞)的激活是中枢敏化的重要机制之一[9]。GFAP和OX-42分别是星形胶质细胞和小胶质细胞常用的特异性标志蛋白,可反映星形胶质细胞和小胶质细胞的活性状态[4,9]。研究发现,当外周伤害性信号持续传向脊髓时,小胶质细胞能有效地感受伤害性刺激信号而被激活[10]。活化的小胶质细胞分泌NO、IL-1β等多种物质,并诱导星形胶质细胞活跃。上述2种神经胶质细胞活化后都能释放大量炎性因子及兴奋性氨基酸,通过MAPK途径参与慢性疼痛中枢敏化的发生发展过程[11]。神经病理性疼痛、CRPSⅠ型疼痛大鼠实验研究均证实,脊髓背角的GFAP和OX-42表达均显著增加,神经胶质细胞参与痛觉信息的整合与调控[12]。
本实验MTrPs激活部位在大鼠股内侧肌,主要由L4~6脊髓节段支配,故本实验以该节段为取材部位,观察该节段GFAP和OX-42蛋白表达变化。病理和自发电活动是MTrPs激活检测的客观指标[13]。本实验中模型组病理切片可见多个大小不等的增大、圆染的肌细胞,增大肌细胞的周围多出现相对较小的圆形或椭圆形肌细胞,肌电图仪记录到MPS大鼠出现自发电位,与前人研究[14]结果一致,说明MTrPs处于激活状态。经电针治疗后,MTrPs处肌组织接近正常组肌组织形态,自发电位频率降低,这说明电针能改善MPS大鼠肌组织形态,减少自发电活动,有效灭活MTrPs。与正常组比较,模型组大鼠L4~6脊髓GFAP和OX-42阳性表达明显增强,这提示星形胶质细胞和小胶质细胞大量活化,参与了MPS大鼠中枢敏化反应;经电针治疗后,MPS大鼠脊髓背角的GFAP和OX-42表达降低,说明电针MTrPs能抑制慢性MPS大鼠星形胶质细胞和小胶质细胞的活化。
综上得出:电针能有效灭活慢性MPS大鼠激痛点,其机制或与调节中枢敏化反应,抑制脊髓背角GFAP、OX-42阳性细胞过表达有关。

