水稻耐冷基因OsICE1 的克隆与转基因香菇菌丝体的创制
王红运,刘禹夫,于晓明,杨祥波,曲一格,张振宇,王晓航*
(1 吉林农业科技学院 农学院,吉林 吉林 132101;2 吉林省种子管理总站,长春 130000)
香菇隶属于真菌界 (Fungi)、 担子菌门(Basidiomycota),学名Lentinula edodes,是世界久负盛名的珍贵食用菌[1]。 香菇味道好,营养价值极高[2]。 同时还可作药用:有扶正补虚,健脾开胃,祛风透疹,化痰理气,解毒,抗癌等功效。别名又为香蕈。 目前香菇的研究多为香菇多糖对人体心血管的影响, 香菇中微量元素的分析等等, 还未有太多关于香菇分子生物学方面的研究[3]。 所以对香菇进行遗传转化研究尤为重要。本研究选用的为农杆菌介导法对香菇进行遗传转化,农杆菌介导法能在自然条件下趋化性的将TDNA 插入到植物基因组中,它转化率高,单拷贝比例高, 且转化子稳定。 是近年来常用的转化方法。 OsICE1 基因是水稻中的一种冷调控关键蛋白, 在多个文献中对于OsICE1 的抗冷性多有研究,具有比较稳定且作用明显的抗寒功能,在水稻受到低温时进行表达, 可以使水稻在一定程度上耐冷[4]。由此选用OsICE1 基因对香菇菌丝体进行遗传转化[5],使得到带有OsICE1 基因的香菇菌丝体, 为实现香菇在寒冷条件大面积种植提供了重要依据与材料。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 香菇菌株由周玉麟食用菌研究所购入; 大肠杆菌DH5α 感受态、 根癌农杆菌EHA105 感受态保存在吉林农业科技学院农学院实验室, 日本晴水稻种子,pCsV1300 质粒保存于吉林农业科技学院农学院实验室, 质粒图谱见图1。
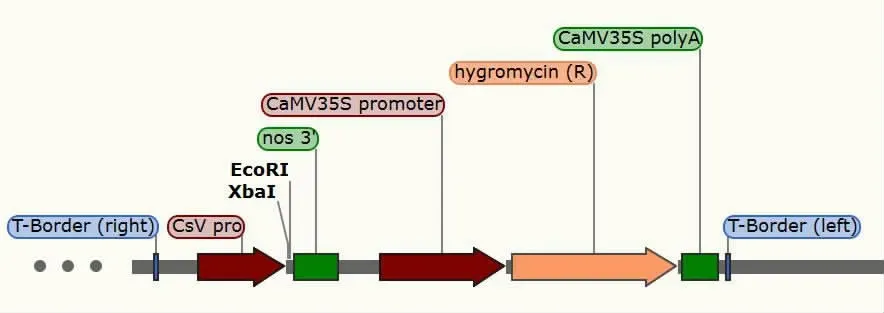
图1 pCsV1300 载体的T-DNA
1.1.2 主要试剂 质粒提取试剂盒由生工股份有限公司购入,PCR、反转录试剂盒均购于全式金公司。
1.2 构建抗寒基因OsICE1 的基因表达载体
1.2.1 水稻发芽 首先挑选饱满的日本晴水稻种子, 把其放入处理好的培养皿中, 用生汞进行消毒,消毒15 min,把消毒后的种子在纱布上进行冲洗,把冲洗后的种子重新放回培养皿中,把培养皿上下两层分别平铺已经用超纯水沾湿的滤纸,把消毒后的种子放在下层滤纸上, 再把上层带有沾湿滤纸的培养皿盖住, 放入25 ℃无光的条件下进行培养[6]。 注意时常观察滤纸上的水分,始终保持滤纸湿润, 培养5 d 出现水稻根和芽。
1.2.2 水稻RNA 提取 对1.2.1 中培养的水稻种子的芽进行RNA 提取: 选用1.2.1 中的水稻芽0.2 g,用Trizol 法进行提取。
1.2.3 反转录体系 纯化RNA 以去除基因组DNA[7], 操作按全式金公司的TransScript One-Step gRNA Removal and cDNA Synthesis SuperMix 说明书进行。 其体系见表1。

表1 反转录体系
条件为:PCR 42 ℃孵育30 min。 85 ℃加热5 s 失活TransScript RT/RI Enzyme Mix 和gDNA Remover。
1.2.4 OsICE1 目的基因的克隆 用primer 软件设计出的引物如下。
OsICE1 的引物序列:
OsICE1-clone-F: 5' ATGCTGCCGCGGTTTCA 3'OsICE1-clone-R: 5' CTAGATCATGGTATGGAAC CCG 3'
OsICE1-clone-XbaI-F:5' TGCTCTAGAATGCTGC CGCGGTTTCA 3'
OsICE1-clone-EcoRI-R: 5' CCGGAATTCCTAGAT CATGGTATGGAACCCG 3'
由吉林省库美生物科技有限公司合成。
PCR 扩增制备水稻全基因, 操作如下:PCR反应体系见表2。

表2 PCR 反应体系
PCR 反应条件为:94 ℃预变性2 min;94 ℃变性20 s,58 ℃退火32 s,72 ℃延伸45 s,循环30 次;72 ℃延伸5 min。 1%琼脂糖凝胶电泳。
PCR 扩增OsICE1 片段。 上一步扩增出来的水稻cDNA 全长作为模板, 用OsICE1-clone-XbaI-F,OsICE1-clone-EcoRI-R,引物,进行PCR扩增,反应条件同上面一样。
1.2.5 PCR 产物回收 将1.2.4 扩增出来的产物用Coolaber 公司的试剂盒对PCR 产物进行回收,获取所需要的目的基因片段。
1.2.6 双酶切 pCsV1300 质粒, 用EcoRI,XBaI进行酶切,反应体系见表3。

表3 酶切反应体系
在灭菌的0.2 mL 离心管中配制如下溶液(50 μL):
37 ℃反应15 min, 所得产物保存于-4 ℃冰箱备用。 电泳。
选1.2.5 中回收的目的基因OsICE1 片段,用EcoRI,XBaI 进行酶切,反应体系见表4。

表4 酶切反应体系
37 ℃反应15 min, 所得产物保存于-4 ℃冰箱备用。 电泳。
1.2.7 DNA 连接 将1.2.6 中的两次酶切产物作为模板,用DNA 连接酶进行连接,体系见表5。

表5 酶连接反应体系
在灭菌的0.2 mL 离心管中配制如下溶液(15 μL):
1.3 构建含有OsICE1 基因的DH5α
1.3.1 大肠杆菌的转化 连接产物转化E.coliDH5α。
1.3.2 转化子的筛选及鉴定 选取单菌落接种到含有AMP 的液体培养基中[8],进行培养,鉴定。
1.4 农杆菌转化培养
1.4.1 农杆菌的转化 农杆菌EHA105 (含质粒pCsV1300) 划线于含有 (20 mg/L Rif,50 mg/L Kan)的LB 平板上,28 ℃培养2 d;单菌落在液体培养基中以28 ℃,200 r/min 培养2 d,用打孔器从培养6 d 左右的PDA 平板取菌丝块[9],浸入农杆菌菌液中,侵染20 min。置于含有200 μmol/L AS 的共培养基上,25 ℃共培养2 d。 将培养后的菌丝块转接到筛选培养基中 (10 mg/L 潮霉素)筛选转化子, 培养2 周后取菌块周围新长出的菌丝进行复筛(12 mg/L 潮霉素培养基)。
1.4.2 抗寒性能试验测试 把复筛过的菌丝进行试管培养, 在黑暗、pH 为适宜的情况下, 分别在10 ℃、25 ℃的恒温培养箱进行培养, 分别在12 h、48 h、72 h 进行观察。
2 结果与分析
2.1 RNA 完整性分析
对发芽5 d 水稻进行冷胁迫(4 ℃)1 h,提取芽组织的RNA[10]。 结果如图2 显示,获得RNA 中28S 条带显著亮于18S,5S RNA 条带最弱, 说明提取的水稻RNA 具有较好的完整性。图2 的三条泳道均为发芽5 天后进行冷胁迫的水稻芽的RNA。

图2 发芽5 d 提取的水稻RNA
2.2 OsICE1 基因的获得
通过对水稻全基因组进行体外扩增[11],并用特定引物进行PCR 后得到OsICE1 基因目的片段,它克隆获得到2 个阳性,如图3,1、3 泳道为获得的阳性克隆,测序结果显示为1627bp。

图3 水稻芽中OsICE1 基因的克隆
2.3 pCsV1300-OsICE1 表达载体的构建
pCsV1300 经过XBaI 与EcoRI 酶切后是9755bp 片 段 长,OsICE1 基 因 为1627bp 片 段 长。如图4 所示, 可以清楚地看到在2 条泳道上的两条DNA 条带。
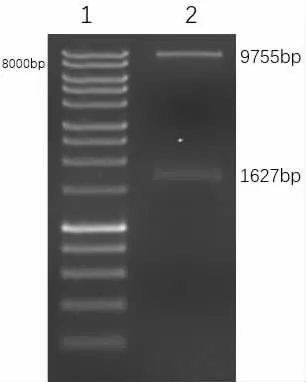
图4 pCsV1300-OsICE1 表达载体
2.4 转基因香菇菌丝的鉴定
从 转 基 因 香 菇 菌 丝 体 中 提 取DNA[12],用OsICE1-clone-F,OsICE1-clone-R 引物对提取出来的香菇DNA 进行体外扩增, 电泳图如图5 所示。图中第2 条泳道为阴性对照,第3、4 条泳道为用OsICE1-clone-F,OsICE1-clone-R 引 物PCR得到的产物,其大小在2000bp 左右。

图5 转基因香菇菌丝的鉴定
2.5 抗寒性试验的测试
香菇菌丝在25 ℃为最适生长温度, 试验主要做出了带有OsICE1 基因表达载体的香菇菌丝体与不带有OsICE1 基因表达载体的香菇菌丝体[13],把他们分别放入了10 ℃和最适温度25 ℃。 可以看出,在25 ℃的温度,其余条件都相同的情况下他们长势大致相同。 而在10 ℃的温度,其余条件都相同的情况下, 带有OsICE1 基因表达载体的香菇菌丝体长势要比不带有OsICE1 基因表达载体的香菇菌丝体长势强, 但是明显比25 ℃情况下的菌丝长势弱。 由此可见,带有OsICE1 基因的香菇菌丝体可以在一定程度上抗寒, 比正常的香菇菌丝体长势好。
3 结论
香菇是一种重要的食用菌, 温度是影响香菇菌丝生长的重要因素, 每年有大面积的香菇遭受到寒冷温度的威胁,导致其产量下降[14]。 OsICE1是水稻中的一种冷调控关键蛋白, 在水稻抗寒种质创制中具有重要作用。 通过对水稻耐冷基因OsICE1 的克隆, 构建了pCsV1300-OsICE1 表达载体。完成了对香菇菌丝体的转化。抗寒性试验的测试可以看出,在10 ℃的温度,其余条件都相同的情况下, 有OsICE1 基因的香菇菌丝体比不带有OsICE1 基因的香菇菌丝体长势好。 由此可见,水稻耐冷基因OsICE1 的克隆与转基因香菇菌丝体的创制的可行性[15]。
——一道江苏高考题的奥秘解读和拓展

