利司那肽联合甘精胰岛素对2型糖尿病患者代谢指标的临床获益
高艳超 王岩
[摘要] 目的 探讨利司那肽联合甘精胰岛素对2型糖尿病患者代谢指标临床获益情况。方法 选取2020年1—5月辽宁省朝阳市第二医院内分泌科住院的2型糖尿病患者72例,于午餐前1 h皮下注射利司那肽,晚21∶00皮下注射甘精胰岛素,记录患者基线、1周、12周时一般情况,分析同一患者基线与12周时空腹血糖、早餐后2 h血糖、午餐后2 h血糖、晚餐后2 h血糖、睡前血糖、体重、尿微量白蛋白/肌酐、血尿酸、糖化血红蛋白、总胆固醇、低密度胆固醇、血空腹C肽的变化,以及代谢指标降幅情况、低血糖发生情况。结果 患者基线分别与12周空腹血糖、早餐后2 h血糖、午餐后2 h血糖、晚餐后2 h血糖、睡前血糖、体重、糖化血红蛋白、低密度胆固醇对比,差异均有统计学意义(P<0.05)。3个月内无低血糖发生。结论 甘精胰岛素联合利司那肽治疗2型糖尿病患者,可确切降低患者的餐后血糖、减轻体重,减少胰岛素剂量,且无低血糖发生增加。
[关键词] 2型糖尿病;利司那肽;来得时;糖化血红蛋白
[中圖分类号] R587.1 [文献标识码] B [文章编号] 1673-9701(2022)10-0131-04
[Abstract] Objective To investigate the clinical benefit of risnatide combined with insulin glargine on metabolic indexes in patients with type 2 diabetes. Methods A total of 72 patients with diabetes mellitus in the Department of Endocrinology in Chaoyang Second Hospital in Liaoning Province from January to May 2020 were selected. They were treated with risenatide combined with insulin glargine. The changes of blood glucose on an empty stomach, after breakfast, lunch, 2 hours after dinner, and before bedtime, body weight, urine A/C, uric acid, HbA1C, total cholesterol, low-density cholesterol, fasting C-peptide, index reduction, hypoglycemia in the same patient at baseline and 12 weeks after treatment were analyzed. Results There were significant differences in fasting blood glucose, blood glucose 2 hours after breakfast, lunch and dinner, and blood glucose before going to bed, body weight, HbA1C, low-density cholesterol between baseline and 12 weeks after treatment (P<0.05). No hypoglycemia occurred within 3 months. Conclusion Insulin glargine combined with risnatide in the treatment of type 2 diabetic patients can accurately reduce postprandial blood glucose, weight loss, and reduce insulin dose without increasing hypoglycemia.
[Key words] Type 2 diabetes; Risenatide; Lantus; Glycated hemoglobin
我国糖尿病患者群体数量极为庞大,截至2018年,由滕卫平教授牵头覆盖全国31个省(直辖市、自治区)的全国糖尿病患病率调查研究证实我国糖尿病患病率已达12.75%,人群数量约占世界总糖尿病患者的1/4[1]。而且我国糖尿病患者因饮食结构以餐后高血糖为主,长期高血糖导致β细胞功能受损,由于β细胞功能受损明显[2],因此我国更多的糖尿病患者需要及时应用胰岛素降糖治疗。
然而,诸多调查研究证实,我国糖尿病患者接受胰岛素治疗的血糖控制并不达标,长期胰岛素治疗带来的低血糖、体重增加、注射次数多等问题始终困扰我国糖尿病患者的积极治疗,进一步导致病情加重及医保负担加重。
有多中心临床研究指出,新型(glucagon-like peptide 1 receptor agonist,GLP-1RA)利司那肽联合基础胰岛素治疗方式是2型糖尿病患者继胰岛素治疗后的另一种降糖方式。杨文英教授团队也证实对于基础胰岛素无法控制的2型糖尿病患者在基础胰岛素基础上联合利司那肽,能确切改善血糖,减轻体重,且无低血糖增加发生[3]。在此基础上,本研究探讨利司那肽联合甘精胰岛素对2型糖尿病患者临床获益情况,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1—5月辽宁省朝阳市第二医院内分泌科住院的2型糖尿病患者72例,均符合1999年WHO糖尿病诊断标准,其中男36例,女36例;年龄18~78岁,平均(46.50±18.87)岁;病程1~8年,平均(4.60±1.34)年;平均体质量指数(27.87±3.16)kg/m2。所有患者入院期间均进行糖尿病宣教,嘱其规律糖尿病进食,适当餐后运动,于午餐前1 h皮下注射利司那肽(入院时注射10 μg/d,1周后更换为20 μg/d),晚21:00皮下注射甘精胰岛素。纳入标准[3]:①未用任何降糖药物,或应用二甲双胍或其他口服降糖药物治疗不佳,或单用甘精胰岛素联合二甲双胍降糖不佳者;②接受医生制订的治疗方案者;③可进行规律血糖监测者;④自愿并签署知情同意书者。排除标准:①严重肝肾疾患、胃轻瘫、心功能不全者;②1型糖尿病者;③糖尿病酮症酸中毒及曾有过低血糖昏迷史、现患严重糖尿病并发症、既往胰腺炎患者[4-5]。患者充分知情用药及临床治疗方案,本研究经医院医学伦理委员会批准。
1.2 方法
1.2.1 检测观察指标 住院患者空腹抽血、留尿,测量身高、体重、计算体重指数(body mass index,BMI),化验血尿酸、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、甘油三酯、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、尿微量白蛋白/肌酐(urine trace albumin/creatinine,urine A/C)。监测三餐前血糖、三餐后2 h血糖、睡前血糖,化验基础C肽(fasting C peptide,FC-P)、基础胰岛素,进食100 g馒头后检测2 h C肽、2 h胰岛素。患者出院后12周内血糖监测采取4点:空腹血糖+三餐后2 h血糖。治疗12周时再次检测以上生化指标。
1.2.2强化治疗方案 在糖尿病饮食控制和运动治疗的基础上,胰岛素泵持续皮下注射(continue subcutaneous insulin injection,CSII)1 d胰岛素总量(U)=体重(kg)×(0.4~0.8)U/kg。所有患者均采用美敦力胰岛素泵712,胰岛素采用门冬胰岛素注射液(锐笔芯 国药准字S20153001,规格:300 iu×3 ml/支,诺和诺德,丹麦),置泵期间所有患者接受7次/d指尖外周血糖监测,血糖仪为三诺智能血糖仪(金准型),目标血糖值:70岁以下者空腹血糖(fasting plasma glucose,FPG)<6 mmol/L,2 h餐后血糖(2 hours postprandial glycemia,2 h PPG)6~8 mmol/L;70岁及以上者FPG 6~8 mmol/L,2 h PPG 8~10 mmol/L。将血糖<3.9 mmol/L定义为低血糖事件。血糖达标时间平均在4~5 d,同时记录低血糖发生次数及有无黎明现象。患者住院时间7~10 d。
1.3 观察指标
住院期间经短期胰岛素泵强化治疗5 d后更换甘精胰岛素联合利司那肽、二甲双胍治疗,观察患者经此方案治疗12周后血糖、血脂、血尿酸、C肽、糖化血红蛋白、尿A/C、体重的变化。安全性终点:记录低血糖发生情况(包括无症状低血糖、症状性低血糖、夜间低血糖以及重度低血糖发生)以及其他各种不良反应。
1.4 统计学方法
应用SPSS 19.0统计学软件进行数据分析。计量资料以均数±标准差(x±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基线与12周代谢指标变化比较
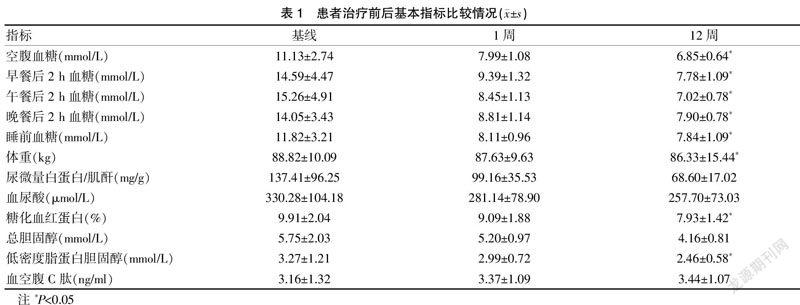
观察基线时至治疗12周基本指标变化情况,空腹血糖、早餐后2 h血糖、午餐后2 h血糖、晚餐后2 h血糖、睡前血糖、体重、糖化血红蛋白、低密度脂蛋白胆固醇较基线时比较均下降,差异有统计学意义(P<0.05)。其他代谢指标也有不同程度的下降。见表1。
2.2 患者血糖降幅情况
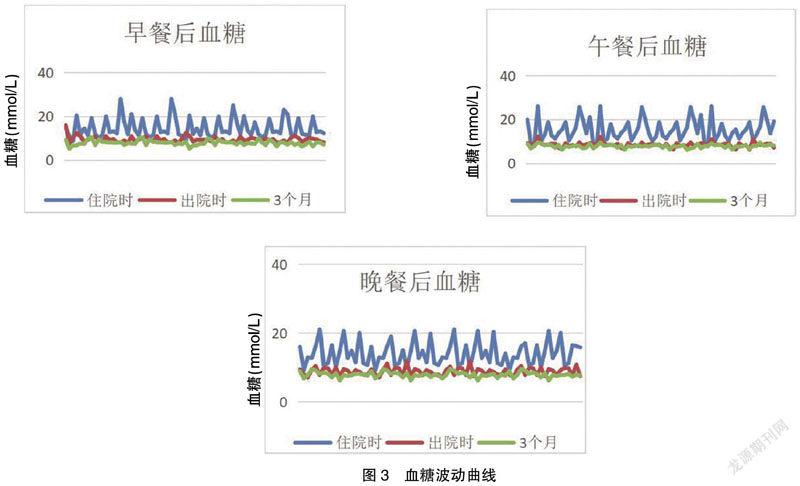
入组患者均于午餐前1 h内注射利司那肽(入院时注射10 μg/d,1周后更换为20 μg/d),晚21∶00皮下注射甘精胰岛素。患者空腹血糖降幅0~10.9 mmol/L,早餐后2 h血糖降幅0.6~11.7 mmol/L,午餐后2 h血糖降幅0.5~17.8 mmol/L,降幅最明顯,晚餐后2 h血糖降幅0.3~12.8 mmol/L,睡前血糖降幅0~12.2 mmol/L。血糖波动曲线见封三图3。
2.3 安全性
研究期间无低血糖发生,无导致治疗终止的治疗后出现不良事件,无死亡报告。
3 讨论
随着2型糖尿病患者糖尿病病程的发展,大部分人群需应用胰岛素治疗。然而,仅有少部分治疗人群血糖达标[6]。我国糖尿病患者对糖尿病的知晓、治疗均低,所以达标率整体偏低。我国糖尿病患病知晓率仅为36.5%,其中仅有32.2%的患者接受糖尿病治疗,在接受治疗的患者中,只有49.2%的糖尿病患者血糖达标[7]。因此选择何种方案治疗,既能使血糖达标,又能避免低血糖发生,并且使糖尿病相关微血管、大血管并发症指标好转,临床治疗迫在眉睫。
糖尿病治疗方案需要考虑患者的综合因素,包括年龄、体重、用药依从性、治疗方案的方便性、及时调整、糖尿病并发症等。因此需要应制订以患者为中心的个体化治疗方案[8]。
十世纪初,科学家发现并命名了“肠促胰素”,从此胃肠道的内分泌功能引起越来越多的关注。机体50%~70%的胰岛素分泌由肠促胰素介导,由于生理性GLP-1可被体内二肽基肽酶-4(dipeptidyl peptidase 4,DPP-4)快速降解,其血浆半衰期<2 min。新型降糖药GLP-1受体激动剂在生理性GLP-1或其类似物exendin-4基础上进行结构修饰,半衰期延长,使得循环中活性药物水平升高,结合GLP-1受体发挥降糖作用。
鉴于我国人群饮食结构情况,仅2~4 h处于空腹状态,约10~12 h处于餐后和吸收后状态,且北方人群体重指数部分偏大。因此,基础胰岛素联合一针GLP-1RA有助于改善患者基础血糖的同时,还可以改善餐后血糖、降低体重,且低血糖发生风险较小。
利司那肽作为一种新的短效GLP-1RA,是目前唯一指定可与胰岛素连用GLP-1RA。和人GLP-1的同源性为50%。特殊的修饰使其半衰期延长至3~4 h。其与GLP-1受体的亲和力是生理性GLP-1的4倍。因此,1次/d给药即可维持全天疗效[9]。并且利司那肽的主要机制不仅为延缓胃排空[10],也可通过增加胰岛素分泌和抑制餐后胰高血糖素水平,进一步降低PPG水平。既往研究发现,早餐前15 min注射利司那肽后,受试者的早、中、晚三餐PPG水平均有不同程度的降低,早餐后PPG的降幅最大。本研究结果提示,利司那肽均于午餐前1 h内注射,此72例患者空腹血糖降幅0~10.9 mmol/L,早餐后2 h血糖降幅0.6~11.7 mmol/L,午餐后2 h血糖降幅最明显,血糖降幅0.5~17.8 mmol/L,晚餐后2 h血糖降幅0.3~12.8 mmol/L。利司那肽联合来得时的安全性及有效性方面,72例患者治疗3个月内无低血糖发生,睡前血糖降幅0~12.2 mmol/L,糖化血红蛋白比较[(9.91±2.04)% vs. (7.93±1.42)%],较入院时降低0~5.1%,体重下降[(88.82±10.09)kg vs. (86.33±15.44)kg],降幅为0~18.0 kg,差异均有统计学意义(P<0.05)。同时,尿微量白蛋白/肌酐,总胆固醇、尿酸也有不同程度的降低。
GetGoal研究结果显示,利司那肽的优异疗效可能与与其促进胰岛素分泌有关,即使对于胰岛功能差的患者,仍能改善其胰岛功能,这一点在GetGoal-M和GetGoal-S研究[11-12]中得到了充分证明。本实验结果提示,患者血空腹C肽治疗3个月时[(3.44±1.07)ng/ml]较入院时[(3.16±1.32)ng/ml]有所提高,与该实验结论吻合。短效GLP-1受体激动剂利司那肽可降低PPG、FPG、HbA1c,同时可改善体重,其中降低PPG的效果更为显著,与Otowa-Suematsu 等[13-15]随机临床试验的结果一致。
基础胰岛素主要用于补充全天基础的胰岛素分泌,控制全天空腹血糖,利司那肽可降低餐后血糖。利司那肽对2型糖尿病患者治疗有促进强化作用,在与基础胰岛素联用时发挥协同互补作用,使空腹血糖和餐后血糖均得到良好控制;利司那肽1次/d,无需每日多次皮下注射,即可提供额外的血糖控制,且还能在一定程度上避免短效胰岛素相关的低血糖和体重增加的风险。所以,选择利司那肽与基础胰岛素联合使用是一种全新的给药方式,不但应用方便,降低血糖,且低血糖风险小、减轻体重、减少胰岛素用量,进一步延缓并发症发生发展。使得利司那肽在2型糖尿病个体化治疗中具有广阔的应用前景。
[参考文献]
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南:2017年版[J].中华糖尿病杂志,2018,10(1):4-67.
[2] Zou X,Zhou X,Ji L,et al. The characteristics of newly diagnosed adult early-onset diabetes: A population-based cross-sectional study[J].Sci Rep,2017,7:46 534.
[3] Yang W,Min K,Zhou Z,et al. Efficacy and safety of lixisenatide in a predominantly Asian population with type 2 diabetes insufficiently controlled with basal insulin:The GetGoal-L-C randomized trial[J].Diabetes Obes Metab,2018,20(2):335-343.
[4] ADA. Standards of medical care in diabetes-2017[J].Diabetes Care,2017,40(Suppl.1):S1-S2.
[5] Bethel MA,Patel RA,Merrill P,et al. Cardiovascular outcomes with glucagon-like peptide-1 receptor agonists in patients with type 2 diabetes:A meta-analysis[J].Lancet Diabetes Endocrinol,2018,6:105-113.
[6] Aschner P,Gagliardino JJ,Ilkova H,et al. Persistent poor glycaemic control in individuals with type 2 diabetes in developing countries:12 years of real-world evidence of the International Diabetes Management Practices Study(IDMPS)[J].Diabetologia,2020,63(4):711-721.
[7] Wang L,Gao P,Zhang M,et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J].JAMA,2017,17(24):2515-2523.
[8] American Diabetes Association. Pharmacological approaches to glycemic treatment: Standards of medical care in diabetes—2020[J].Diabetes Care,2020,43(Suppl 1):S98-S110.
[9] 母義明.利司那肽:一种独特的短效胰高糖素样肽-1受体激动剂[J].药品评价,2017,14(15):8-13.
[10] Frias JP,Dex T,Roberts M,et al. A review of the safety and adverse event profile of the fixed-ratio combination of insulin glargine and lixisenatide[J].Diabetes Ther,2019, 10(1):21-33.
[11] Yabe D,Ambos A,Cariou B,et al. Efficacy of lixisenatide in patients with type 2 diabetes: A post hoc analysis of patients with diverse β-cell function in the GetGoal-M and GetGoal-S trials[J].J Diabetes Complications,2016, 30(7):1385-1392.
[12] Bonadonna RC,Blonde L,Antsiferov M,et al. Lixisenatide as add-on treatment among patients with different β-cell function levels as assessed by HOMA-β index[J].Diabetes Metab Res Rev,2017,33(6):e2897.
[13] Otowa-Suematsu N,Sakaguchi K,Nakamura T,et al. Comprehensive evaluation of combination therapy with basal insulin and either lixisenatide or vildagliptin in Japanese patients with type 2 Diabetes: A randomized,open-label,parallel-group,multicenter study[J].Diabetes Ther,2018,9(5):2067-2079.
[14] Blonde L,Chava P,Dex T,et al. Predictors of outcomes in patients with type 2 diabetes in the lixisenatide GetGoal clinical trials[J].Diabetes Obes Metab,2017,19(2):275-283.
[15] T rujillo JM ,Goldman J. Lixisenatide,A once-daily prandial glucagon-like peptide-1 receptor agonist for the treatment of a dults with type 2 diabetes[J].Pharmacotherapy,2017,37:927-943.
(收稿日期:2021-05-03)

