基因VI型新城疫病毒荧光RT-PCR检测方法的建立与应用
王静静,于晓慧,克军宏,2,彭真奇,3,邢安琪,4,刘华雷
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.塔里木大学,新疆阿拉尔 843300;3.安徽农业大学,安徽合肥 230036;4.宁夏大学,宁夏银川 750021)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)强毒株感染引起的一种禽的急性、高度接触性传染病,是严重危害养禽业的重要疾病之一,给养禽业造成巨大经济损失。世界动物卫生组织(OIE)将其列为法定报告动物疫病,我国将其列为一类动物疫病。NDV 具有遗传多样性,根据病毒F基因差异可分为I 和II 两大类,I 类NDV 只有1 个基因型,均为弱毒株;II 类NDV 至少包括21 种基因型,其中既有弱毒株也有强毒株[1]。目前我国流行的强毒株主要为基因VI型和VII型,且病毒具有明显的宿主特异性[2-3]。20 世纪80 年代后,基因VI型NDV 传至世界各地,并一直在鸽群中流行和传播[4-5]。国家新城疫参考实验室监测数据显示,近年来我国鸽群NDV 强毒阳性率呈上升趋势[6],提示应对鸽群中基因VI型NDV 强毒株加以关注。
目前,我国ND 诊断主要依靠RT-PCR 结合测序。NDV 强毒鉴定可通过测定1 日龄雏鸡脑内接种致病指数(ICPI)或病毒F 蛋白裂解位点序列分析进行,通过病毒F 蛋白裂解位点碱性氨基酸数量判定病毒毒力。该方法检测周期较长,无法满足快速检测的需求。此外,多家实验室也建立了NDV强毒株荧光RT-PCR 检测方法[7-9],用于NDV 强毒株的快速筛查,但这些方法均无法区分病毒基因型,所以目前仍无专门针对基因VI型NDV 的快速检测方法。为了满足基因VI型NDV 的检测需求,本研究针对NDVF基因设计特异性引物和探针,建立了一种特异性强、敏感性高、快速有效的基因VI型NDV 检测方法,为开展鸽群ND 的早期诊断提供了重要支撑。
1 材料与方法
1.1 材料
1.1.1 病毒 I 类(基因1.1.2 亚型)、II 类(基因I型、II型、VI型、VII型)NDV、禽流感病毒(H5、H7、H9 亚型)、鸡传染性支气管炎病毒、鸡传染性喉气管炎病毒、鸡传染性法氏囊病病毒、禽腺病毒、减蛋综合征病毒、禽脑脊髓炎病毒等,均由中国动物卫生与流行病学中心禽病监测室保存。
1.1.2 临床样品 120 份鸽口咽/泄殖腔拭子,由中国动物卫生与流行病学中心禽病监测室保存。
1.1.3 试剂盒 High Pure Viral Nucleic Acid Kit核酸提取试剂盒,购自Roche 公司;PrimeScript One Step RT-PCR Kit Ver.2 RT-PCR 试剂盒,购自TaKaRa 公司;SuperScript III Platinum One-Step qRT-PCR Kit 荧光RT-PCR 试剂盒,购自Invitrogen公司。
1.1.4 cRNA 标准品 基因VI型NDV cRNA 标准品,由中国动物卫生与流行病学中心禽病监测室制备和保存。
1.1.5 鸡胚 9~11 日龄SPF 鸡胚,购自山东济南斯帕法斯家禽有限公司。
1.2 引物、探针设计和筛选
从GenBank 上下载NDVF基因序列,采用MEGA 6 进行序列比对分析,选取基因VI型NDV保守区域设计特异性引物和探针(表1)。引物和探针由宝生物工程(大连)有限公司合成。
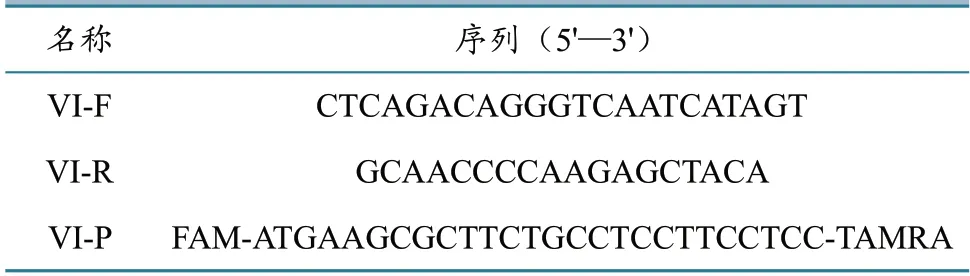
表1 荧光RT-PCR 引物和探针
1.3 病毒核酸提取
按照核酸提取试剂盒说明书操作,提取病毒核酸,立即用于实时荧光RT-PCR 或RT-PCR 扩增,或置-80 ℃保存备用。
1.4 反应体系建立与优化
以提取的基因VI型NDV RNA 为模板,按照实时荧光RT-PCR 试剂盒说明书配置反应体系,进行荧光RT-PCR 扩增,确定最佳引物和探针浓度以及退火温度和时间。
引物探针浓度优化:固定反应体系引物终浓度为0.5 μmol/L,探针浓度分别为0.20、0.25、0.30、0.35、0.40、0.45 和0.50 μmol/L。根据检测Ct 值确定最佳探针浓度。
退火温度优化:退火温度分别设置为58、59和60 ℃,通过比较Ct 值确定最佳退火温度。
退火时间优化:退火时间分别设置为30、40、50、60 和70 s,通过检测Ct 值确定最佳退火时间。
1.5 特异性试验
选择具有代表性的12株基因VI型NDV,以及I 类(基因1.1.2 亚型)、II 类(基因I型、II型、VII型)NDV、禽流感病毒(H5、H7、H9 亚型)、鸡传染性支气管炎病毒、鸡传染性喉气管炎病毒、鸡传染性法氏囊病病毒、禽腺病毒、减蛋综合征病毒、禽脑脊髓炎病毒,提取核酸进行荧光RT-PCR扩增,评价方法的特异性。
1.6 敏感性试验
将基因VI型NDV cRNA 标准品进行10 倍倍比稀释,取浓度为5×109~5×100copies/μL 的样品进行荧光RT-PCR 扩增,每个稀释度做3 个重复。
1.7 临床样品检测
用建立的荧光RT-PCR 方法对临床采集的120份鸽口咽/泄殖腔拭子样品进行检测,并与病毒分离方法(病毒繁殖、RT-PCR 扩增和序列分析)检测结果进行比较。
2 结果
2.1 反应体系建立和优化
以基因VI型NDV RNA 为模板进行荧光RT-PCR 扩增,优化反应体系和反应条件。确定的最终反应体系:2×Reaction Mix 10.0 μL,上下游引物(20 μmol/L)各0.5 μL,探针(10 μmol/L)0.5 μL,RTTaqMix 0.5 μL,模板RNA 2.0 μL,DEPC 水6.0 μL,总体积20.0 μL。反应条件:50 ℃30 min,95 ℃ 3 min,94 ℃ 15 s,60 ℃ 1 min,共45 次循环。每次循环在60 ℃时收集荧光信号。
2.2 特异性试验
用国内流行的5 种基因型NDV 和其他9 种常见禽病病毒核酸进行特异性试验。结果(图1)显示:只有12株基因VI型NDV 核酸经荧光RTPCR 扩增后出现特异性扩增曲线,基因1.1.2 亚型、基因I型、II型NDV 弱毒,基因VII型NDV 强毒,以及其他常见禽病病毒核酸经荧光RT-PCR 扩增后均无扩增曲线。
2.3 敏感性试验
以浓度为5×109~5×100copies/μL 的cRNA样品进行荧光RT-PCR 扩增,每个稀释度做3 个重复。结果(图2)显示,荧光RT-PCR 检测下限为5 copies/μL。
2.4 临床样品检测
用建立的荧光RT-PCR 方法对临床采集的120份鸽口咽/泄殖腔拭子样品进行检测,结果检出阳性样品17 份,检测结果与病毒分离方法完全一致,说明本研究建立的荧光RT-PCR 方法可信度高,可用于临床样品中基因VI型NDV 检测。
3 讨论
ND 是影响我国养禽业发展的主要疫病之一。目前我国流行的NDV 强毒株分属3 个基因型,即基因型VI型、VII型和XII型。其中,基因VII型和XII型NDV 分别在鸡群和鹅群中流行,基因VI型NDV 在鸽群中流行。基因VI型NDV 曾被称为鸽副黏病毒I型(pigeon paramyxovirus type 1,PPMV-1),是鸡源NDV 跨种传播至鸽后产生的变异株,也是导致全球第三次ND 大流行(20 世纪70 年代后期至80 年代)的主要流行毒株[10]。20 世纪80 年代我国首次分离到基因VI型NDV,随后该基因型毒株一直在我国鸽群中流行。国家新城疫参考实验室监测数据显示,近十年间鸽NDV强毒阳性率明显高于鸡和水禽,且近两年基因VI型NDV 流行强度明显升高。基因VI型NDV 在我国分布广泛[2,5,11],没有明显的地域性,已经成为我国当前流行最为广泛的强毒株,也是危害养鸽业健康发展的主要病原之一。因此,需要加强基因VI型NDV 的监测预警,建立快速灵敏特异的检测方法,为鸽ND 的早期诊断提供技术储备。
目前,ND 弱毒活疫苗的普遍使用和弱毒株的大量存在[12-13],给ND 确诊带来巨大挑战。由于NDV 只有一个血清型,单纯检测NDV 的血清学方法(血凝抑制试验)和强弱毒通用的RT-PCR 技术已无法满足快速确诊和早期诊断的需求。ND 确诊需要依靠病毒致病性评价。传统的毒力测定方法为生物学试验,即ICPI 测定,此方法检测周期长,且需要一定级别的生物安全实验室,不适合大规模推广应用。目前,病毒毒力鉴定常用常规RT-PCR技术结合序列分析,但测序所需时间较长,无法满足快速检测的需求。近年来,反转录环介导等温扩增(RT-LAMP)和荧光RT-PCR 等分子生物学技术也被用于NDV 检测[8,14-15],但现有方法主要是针对疫苗毒和基因VII型、IX型强毒株。本研究建立了一种基因VI型NDV 荧光RT-PCR 检测方法,可在2.5~3 h 内完成样品检测,具有操作简单、特异性强、敏感性高、准确性好等优点,适用于大批量临床样品检测。

