四川省规模场猪伪狂犬病定性风险评估
梁璐琪,周莉媛,邵靓,张毅,陈冬,刘俐君,李春
(1.四川省动物疫病预防控制中心,四川成都 610041;2.达州市动物疫病预防控制中心,四川达州 635000)
猪伪狂犬病(pseudorabies,PR)由疱疹病毒科、甲型疱疹病毒亚科的猪疱疹病毒1型(SHV-1)伪狂犬病病毒(pseudorabies virus,PRV)引起。感染PRV 后,2 周龄内小猪临床以颤栗、眼球震颤、共济失调、角弓反张、癫痫样痉挛等严重的神经紊乱和高热症状为主,病死率可高达100%;生长育肥阶段猪以打喷嚏、流鼻涕等鼻炎症状为主,可发展为肺炎等中重度呼吸系统症状[1]。鉴于该病既可水平传播,又可垂直传播,对养猪业造成严重危害,世界动物卫生组织(OIE)将其列为须通报动物疫病,我国按二类动物疫病对其进行防控。目前已有美国、加拿大、新西兰等多个国家,利用基因缺失技术区别野毒感染抗体与免疫抗体,成功净化了该病[1]。
我国引入Bartha-K61 疫苗株后基本控制了PR在全国的蔓延,但2011 年底北方部分地区再次暴发PR 疫情并波及全国[2],造成严重损失。根据中国动物疫病预防控制中心2020年的定点监测数据,我国PR 场阳性率为28.6%。陈艳红等[3]、程晶等[4]、张显浩等[5]、解伟涛等[6]从全国部分地区样品中检出的PRV 感染抗体阳性率为15.0%~37.9%,表明我国部分地区仍有较高的PR 发生风险。周莉媛等[7]采用ELISA,对四川省东西南北中的17个规模猪场1 388 份血清样品进行PRV 血清学检测,发现PRV-gE 抗体阳性率为15.63%,场阳性率为58.82%,哺乳仔猪、保育猪、育肥猪、经产母猪、种公猪、后备猪PRV-g E 抗体阳性率分别为30.12%、13.74%、21.71%、15.53%、1.67%、10.78%。目前,四川省在免疫基因缺失疫苗的基础上,种猪场以免疫、监测、淘汰阳性动物的方针进行PR 净化,商品猪场以免疫、监测、保证临床健康为方针防控PR。本研究采用OIE 风险分析框架,对四川省主要规模猪场进行PR 定性风险评估,以提高风险管控措施的针对性,从而为科学开展规模场PR 净化提供参考。
1 材料与方法
1.1 构建风险评估模型
在OIE 风险分析框架下,使用“情景树”法构建风险评估模型,描述PRV 释放到规模猪场并在场内定殖、扩散的所有可能途径。
1.2 问卷调查与PRV 免疫抗体检测
在四川省中部、东部等规模养殖化率占比高的平原地区,选择种猪场、扩繁猪场、商品代育肥猪场(简称商品猪场)等不同类型规模场,从基本情况、日常管理、生物安全等方面进行问卷调查。将调查回收的数据,用Excel 软件进行统计处理。在全省主要规模养殖企业开展PRV免疫抗体监测,按估计流行率的抽样方法,用公式(1)计算每个规模场的个体采样数量。
式中,α为检验水准,π为预估流行率,δ为容许的误差。
按公式(2)计算抗体水平的变异系数(CV)。
式中,σ为抗体标准差,μ为抗体平均值。
1.3 风险估算
参考法国食品环境职业健康与安全局(French Agency for Food,Environmental and Occupational Health and Safety,ANSES)动物健康专家委员会在OIE 风险评估框架下建立的定性风险评估方法[8],以纵横两个要素构建矩阵估算风险,并遵循以下原则:(1)矩阵中任意一个要素为忽略时,无论另一个要素的评分多高,矩阵的结果均为忽略;(2)矩阵的结果不高于两个要素中的最低评分。
用连续数字0~9 描述释放、暴露、不利事件发生的可能性与后果的严重程度(表1)。用数字范围来描述把握度,把握度高时为确切数值,不高时为数值范围(如评估某病的释放可能性时,把握度高时可取值6,不太高时可取值5~6,甚至可为4~7)。

表1 释放、暴露、不利事件发生可能性与后果严重程度的等级分类
用连续数字0~3,从群体健康、疫病传播和经济损失等三方面描述不利事件引起后果的严重程度。“0”代表预计无不良后果,“1”代表预计后果的严重程度低,“2”代表预计后果的严重程度中等,“3”代表预计后果的严重程度高(表2)。
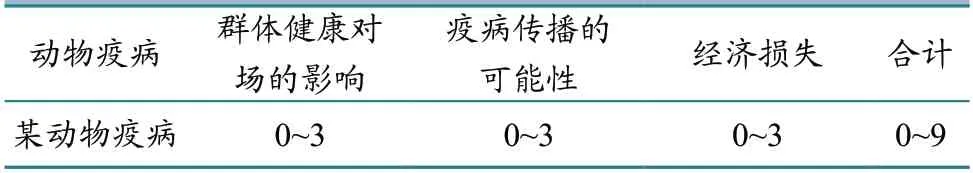
表2 后果评估参考数值
根据OIE《陆生动物卫生法典》[9],风险大小由不利事件发生的可能性与事件发生造成后果的严重程度共同决定,按公式(3)计算。
式中,R为风险大小,P为不利事件发生的可能性,由释放的可能性和暴露的可能性共同决定,C为不利事件所引起的后果。
后果的严重程度会改变不利事件发生可能性的权重(即风险的估算值),其遵循以下原则:(1)后果严重程度评分1~3 分的(即可忽略、极小、极低),在不利事件发生可能性的基础上,降低风险的估算值;(2)后果严重程度评分4~6 分的(即很低、低、不太高),不调整风险的估算值;(3)后果严重程度评分7~9 分的(即较高、高、非常高),在不利事件发生可能性的基础上,增高风险的估算值。
2 结果
2.1 风险评估模型
用情景树描述PRV 通过引种、后备猪入群、精液使用等7 条主要途径释放到各类型规模猪场,并在养殖场内定殖扩散、发病并造成损失的可能性,构建出四川省规模场PR 风险评估模型(图1)。
2.2 问卷与本底调查
2.2.1 问卷发放与回收 在成都、绵阳、广元、宜宾、达州、广安、眉山等地抽取16 个种猪场、34 个扩繁猪场、200 个商品猪场,共发放问卷250份,回收169 份,问卷总回收率为67.6%;有效问卷142 份,总有效率为56.8%。有效问卷中,种猪场占10%,扩繁猪场占22%,商品猪场占68%。
2.2.2 问卷调查 各类型规模场在引种、后备猪入群、精液使用、防鼠等方面采取的PR 风险控制措施占比情况见表3。种猪场在引种/后备猪入群、鼠害控制、饮水与人员控制,扩繁猪场在饮水与人员控制,商品猪场在人员控制方面,不仅制定了较为科学的风险控制措施且执行良好,但各类型规模猪场在其他方面均存在一定的管理漏洞。
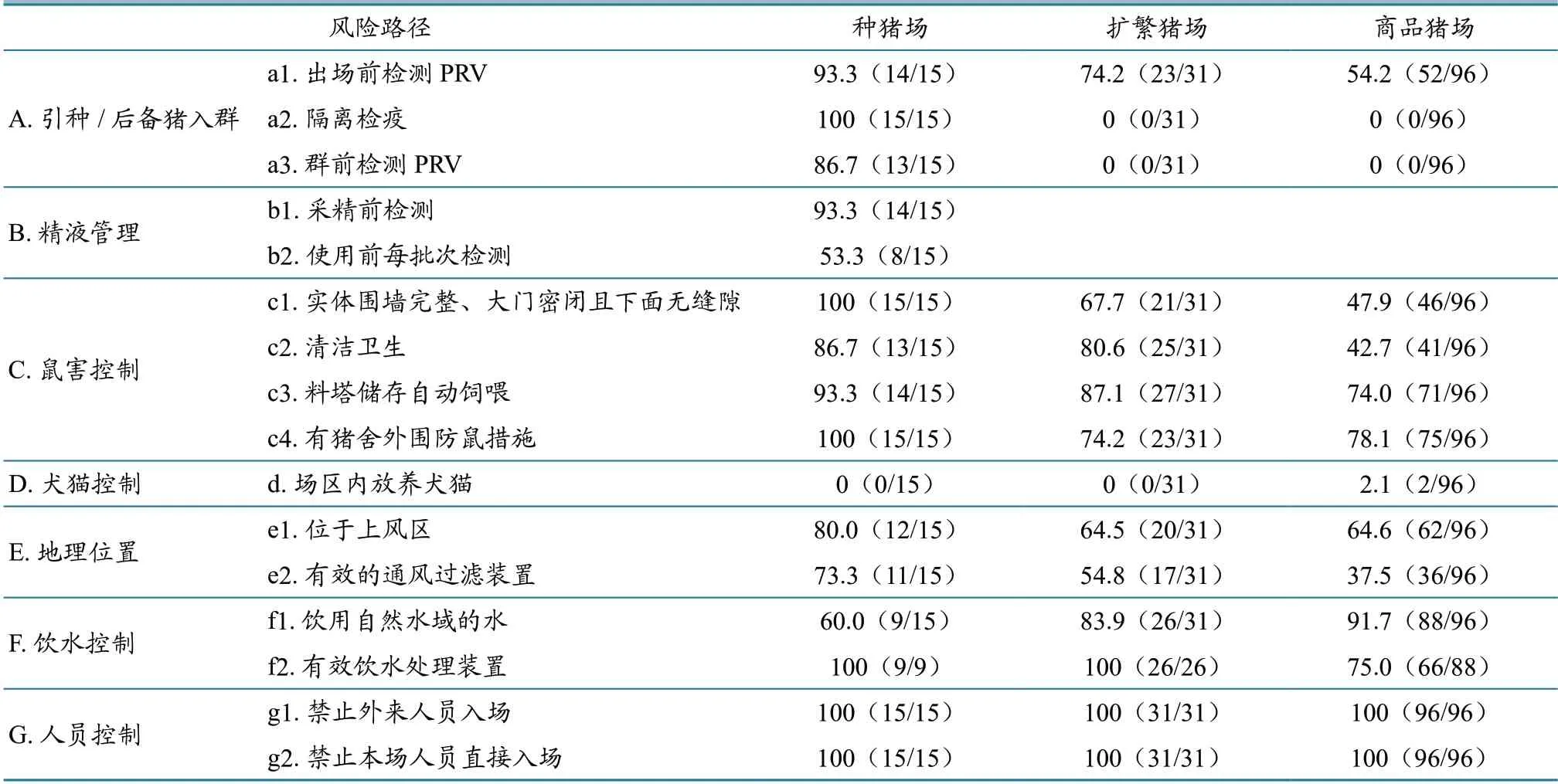
表3 各类型规模猪场PR 风险控制措施占比情况 %
2.2.3 本底调查 血清学监测的每场样本量计算参数α=0.05(即置信水平为95%),查表可得μα/2=1.96,π=0.85(即预估抗体合格率为85%),δ=0.1,计算得到每个场需采集的样本量n=49。19 家规模猪场共采集血清931 份。各场样本按ELISA 试剂盒说明书要求进行检测并判定阴阳性,按公式(2)计算各场免疫抗体的变异系数(表4)。
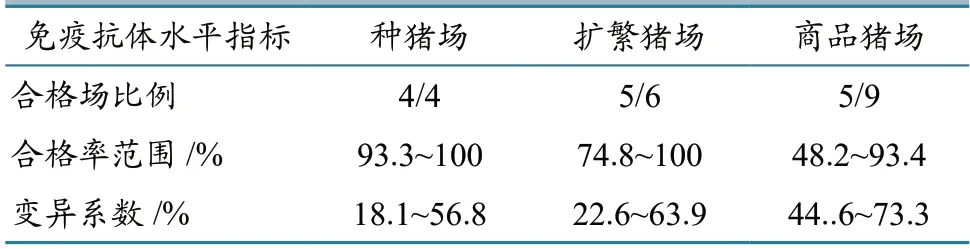
表4 各类型规模场PRV gB 抗体水平
2.3 风险估算
2.3.1 构建矩阵 根据1.3 中的原则构建的释放与暴露可能性矩阵(即不利事件发生的可能性)见图2,发生的可能性与后果的严重程度矩阵(即风险估算)见图3。
2.3.2 规模场PR 释放风险 根据问卷调查获得的各规模场风险控制情况,结合等级分类(表1),估算出PRV、感染动物、病毒污染物等风险客体通过各风险路径释放到猪场内的可能性。其中扩繁猪场、商品猪场通过引种/后备猪入群引入PR 的可能性较高,把握度较高(释放可能性等级分别为6~7 和7~8);商品猪场总体上对鼠害的控制较差,通过老鼠传入场内的可能性较高,把握度较高(释放可能性等级为6~7);部分扩繁猪场、商品猪场位于下风区且无有效通风过滤装置,通过气溶胶传入场内的可能性较高,其中扩繁猪场把握度一般,商品猪场把握度较高(释放可能性等级分别为5~7和6~7);部分商品猪场饮用水来自自然水域且无有效水处理装置,通过饮水传入场内的可能性较高,把握度较高(释放可能性等级为6~7)。各风险路径的释放评估结果详见表5。
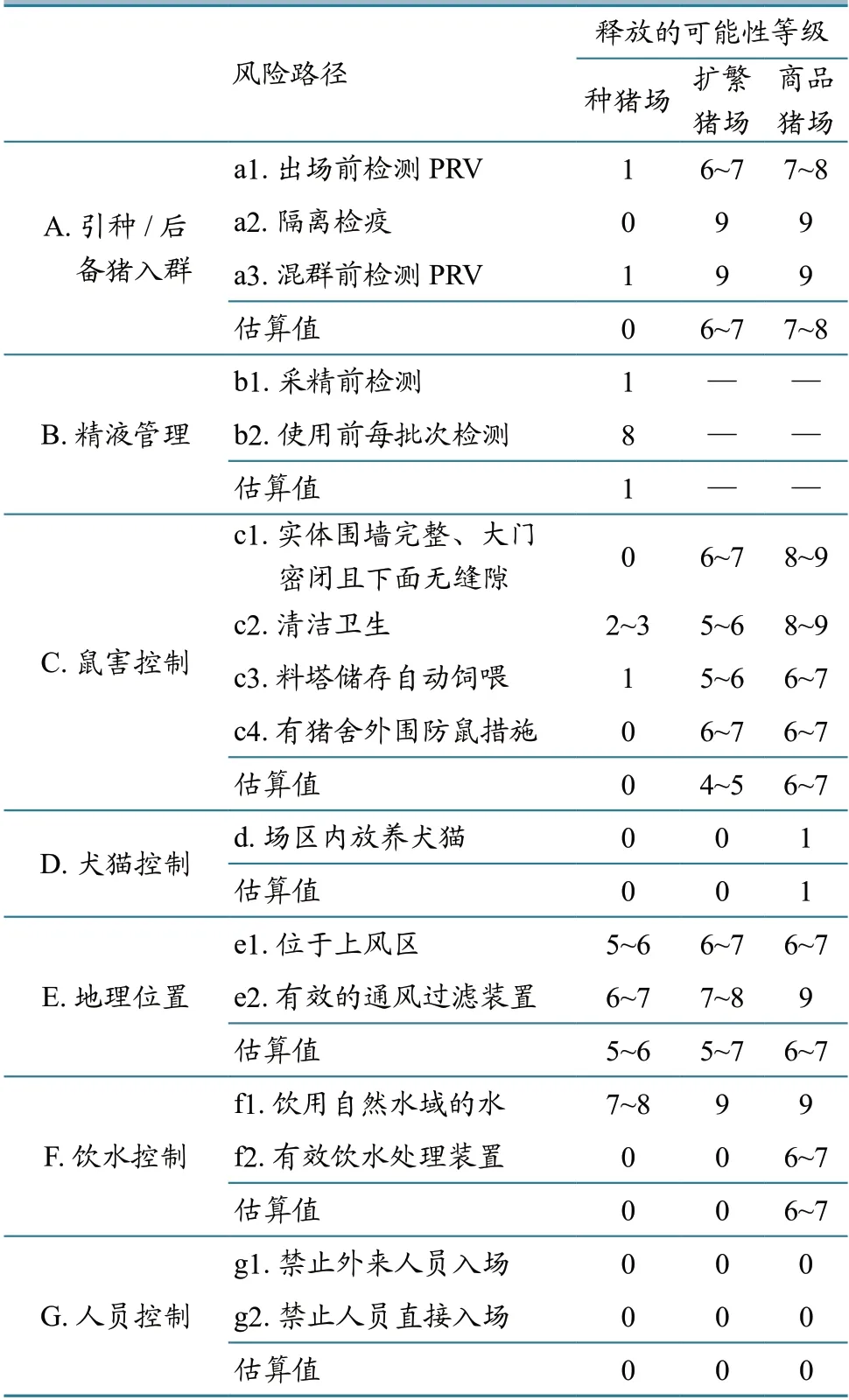
表5 各类型规模场PR 释放风险评估结果
2.3.3 规模场PR 暴露风险 本次评估将整个猪群作为风险主体,各风险路径的暴露均类似,其风险主要取决于猪群PRV 免疫抗体水平[10-11]。四川省部分动物疫病防控专家通过定期疫情会商,建议在考虑免疫抗体水平基础上,将抗体水平的整齐程度也纳入免疫抗体对猪群保护力的评估。其中,扩繁猪场和商品猪场的猪群暴露于PRV 的可能性较高,各猪群免疫抗体水平参差不齐,因而把握度较差(暴露可能性等级分别为0~6 和4~9)。各类型规模场暴露风险评估结果详见表6。
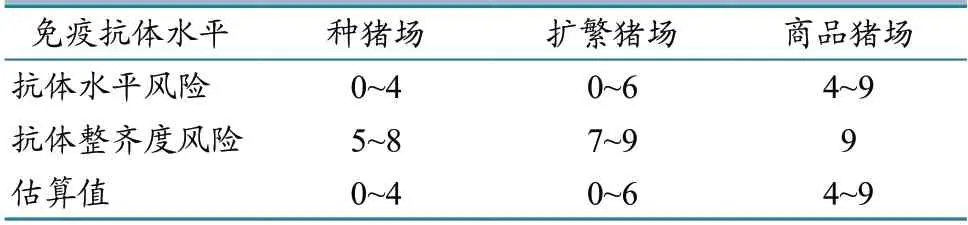
表6 各类型规模场PR 暴露风险评估结果
2.3.4 规模场PR 后果评估 PR 在临床上主要表现为母猪流产、产死胎,公猪不育,新生仔猪大量死亡,育肥猪呼吸困难、生长停滞等。PRV 会破坏机体免疫系统,干扰其他病原免疫抗体产生,容易继发其他传染病[12]。猪是PRV 的主要储存宿主,带毒猪、流产胎儿以及带毒鼠类均为PR 的重要传染源[13]。除怀孕母猪可垂直传播PRV 给胎儿外,猪感染后可终身带毒,在应激、免疫力下降等多种因素的诱发下可向外排毒,并通过气溶胶[14]、分泌物(如唾液、鼻液、尿液、阴道分泌物)污染场内的空气、垫料、饲料、饮水、圈舍、工作人员和器具而传播,也可通过乳汁和精液传播[15]。种猪场和扩繁猪场暴发PR,不仅对生产指标影响巨大,同时因种猪价值高,淘汰阳性种猪也会造成巨大经济损失;商品猪场暴发该病后,由于猪生长迟缓,饲料报酬率降低,开展净化又需要淘汰阳性动物,亦可造成不小的经济损失。综上,评估规模猪场发生PR 后果的严重程度为不太高—非常高,把握度一般(严重程度等级为6~9),详见表7。

表7 规模场PR 后果评估结果
2.3.5 规模场PR 风险估算 综合规模场PR 释放与暴露的可能性(即PR 发生的可能性)、后果评估结果,代入矩阵,得到规模场发生PR 的定性风险估算结果。其中:商品猪场引种的风险非常高,把握度低(风险估算值EL—VH);种猪场精液管理的风险较高,把握度低(风险估算值N—QH);扩繁猪场和商品猪场鼠害控制的风险分别为高和非常高,把握度均为低(风险估算值分别为N—H 和EL—VH);商品猪场犬猫控制的风险较高,把握度低(风险估算值M—QH);3 种类型规模场地理位置的风险分别为较高、高和非常高,把握度均为低(风险估算值分别为N—QH、N—H和EL—VH);商品猪场饮水控制的风险非常高,把握度为低(风险估算值EL—VH)。详情见表8。
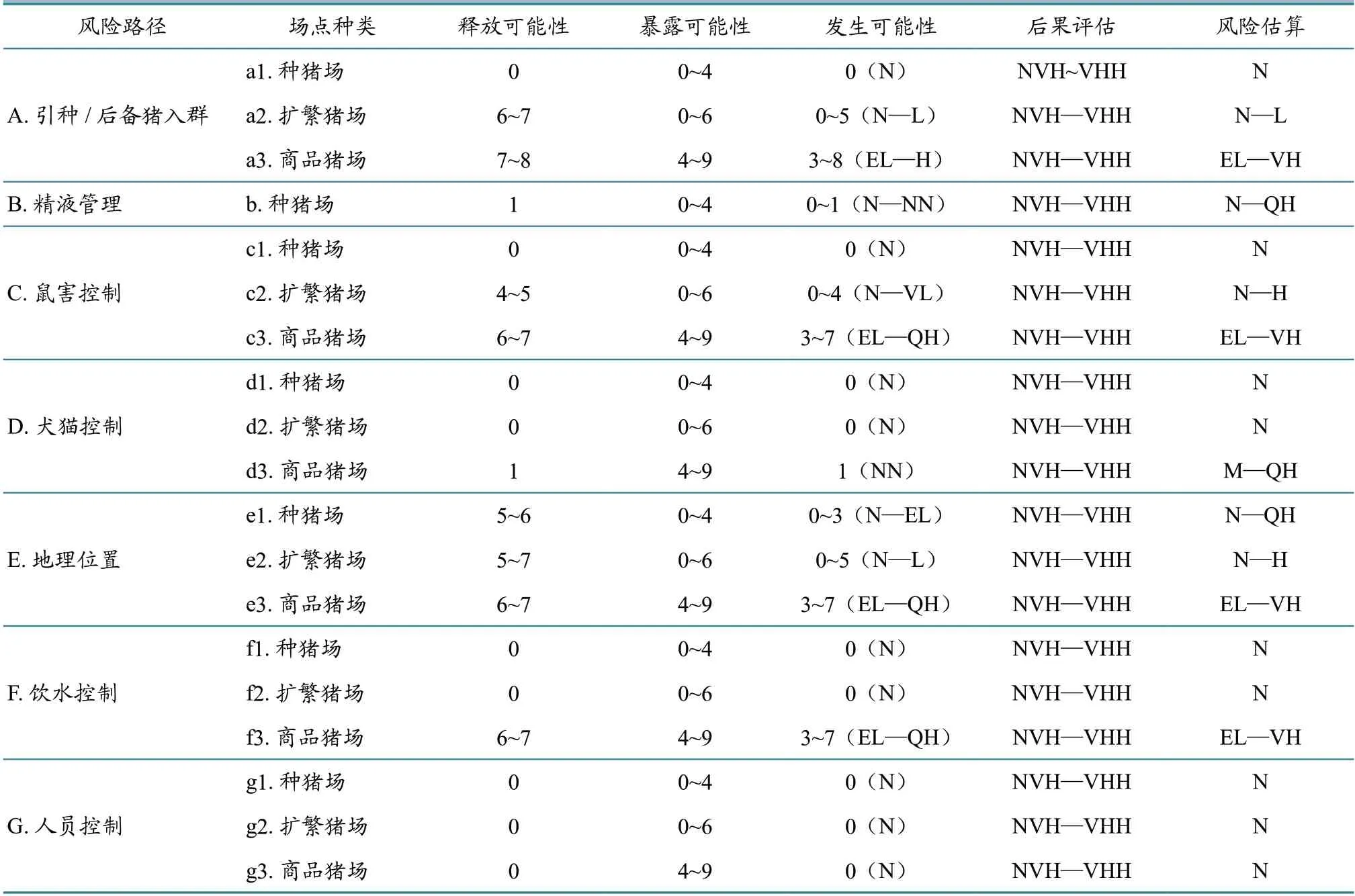
表8 各类型规模场PR 定性风险评估结果
3 讨论
由于拟调查商品猪场数量多且过于分散,故进行线上问卷调查。考虑到线上调查问卷数据的有效性难以保证,在方案设计时假定该部分问卷的有效率为50%,即实际问卷量比设计问卷量翻1 倍。从问卷后得到的数据来看,尽管商品猪场问卷有效率仅为48%,但是各类型规模场的有效问卷数量仍大致满足设计的比例,即种猪场:扩繁猪场:商品猪场=1:2:7。
商品猪场入群多采用“整进整出”或者分批次“整进整出”,虽便于空栏期消毒,但无法有效实施隔离观察,等同于直接混群。因此多数商品猪场的PRV 携带情况直接取决于上游猪场;种猪场在使用精液的过程中,虽然重视供精公猪的PRV检测,但多数忽略不同批次精液使用前的检测,容易出现供精公猪在两次常规检测之间感染对精液造成污染等意外情况,精液一旦被污染就会造成更大面积猪群的感染;多数扩繁猪场和商品猪场大门的密封性不佳,老鼠可通过大门进入场区,且26%被调查的扩繁猪场和22%的商品猪场猪舍外围无有效防鼠措施(如碎石防鼠带)。若周围暴发疫情,极易传入病毒;部分规模场内无空气过滤装置且靠近屠宰厂,极易暴露在可通过气溶胶传播的病原中,一旦猪群的免疫抗体水平出现波动,猪群返阳的风险就会增高;大多数商品猪场饮用水来自自然水域且无有效的处理装置,若周围暴发疫情,特别是在雨季,大雨冲刷暴露出不规范的掩埋点,导致大量病原污染自然水域。因此,应加大引种、精液使用前的检测频次,场内加强鼠害控制,并根据实际情况加装空气过滤装置和饮水处理装置,进一步降低各类型规模场的PR 发生风险。在本次定性风险评估中,造成风险估算的把握度普遍偏低的原因,不仅是基础数据的缺乏,也有不同类型规模场之间、同类型不同场之间具体情况的差异性。
与2016 年杨涛等[16]评估PRV 通过人员、运载工具、物料等途经传入猪场的高风险结论相比,由于自非洲猪瘟传入我国以来各场均加强了对人、车、物、料的生物安全管理,本次评估发现病毒通过上述途径释放到生产区的风险大大降低。因此,在各类型规模猪场开展PR净化的条件已较为成熟。鉴于PR 的垂直传播特性,建议优先在原种猪场等代次高的种猪场开展净化工作,建立PR 阴性种猪群,在“金字塔”型的生猪繁育体系中逐级放大疫病净化成果,这对实现以PR 为代表的生猪主要动物疫病净化具有重要意义。

