N,P-CDs用于Al3+和pH的检测及在细胞成像中的应用
闫娅楠 ,刘洋 ,刘竞 ,冯宁坤 ,宋胜梅 *,董川 *
(1.山西大学 化学化工学院,山西 太原 030006;2.山西大学 环境科学研究所,山西 太原 030006)
0 引言
目前,测定铝含量的方法有很多种,包括电感耦合等离子体光谱法[8]、高效液相色谱法[9]和电化学法[10]等。尽管这些方法在检测Al3+方面得到了广泛的应用,但是高昂的仪器设备和烦琐的前处理过程限制其方法的进一步推广[11-13]。因此渴望寻找一种更简便的方法来检测Al3+铝离子。pH值的测量方法,包括核磁共振(NMR)[14],微电极[15],吸收光谱法和荧光法[16]。其中,荧光测定法因其响应速度快、灵敏度高、无创性和实时监测而具有非凡的竞争优势[17]。荧光成像与激光共聚焦扫描显微镜(LSCM)相结合可以为监测活细胞的pH的变化提供高时空分辨率[18]。
碳点(carbon dots,CDs)[19]因其具有良好的光学性质[20]、生物相容性[21]和较低的生物毒性[22]等,已广泛应用于各种离子的检测、光学传感、荧光pH探针等领域[23-25],是构建荧光传感方法中重要的碳纳米材料之一。例如,Li等[26]通过水热法合成了CDs,间接检测Al3+的存在。Fu等[27]通过电化学合成CDs用于检测水溶液中的Al3+。因此,开发制备简单、可直接检测Al3+的CDs备受关注。在pH的检测中,Guo等[28]通过一步水热法制备的CDs用于检测pH变化从1.00到3.00。Li等合成的CDs用于检测pH在5.00~10.00的变化。
目前,大部分的碳点在检测pH时主要集中在中性、极酸和极碱的体系中,而用于pH在4.00~6.00范围内检测的CDs少有报道,检测Al3+的方法多为间接检测。本文针对目前Al3+和pH检测中存在的问题,以对苯二胺为碳源,磷酸、乙二胺为磷和氮源,以微波法制备了N,P-CDs。该N,P-CDs可直接用于检测Al3+,选择性好,其线性范围为73.0 μmol/L~ 120.0 μmol/L,检测限为 21.03 μmol/L(S/N=3)。所制备N,P-CDs可在pH=4.00~6.00范围内灵敏地测定pH值,丰富了目前CDs用于检测pH值的方法,同时该N,P-CDs可以用于LSCM进行HeLa细胞内pH(4.00~6.00)的成像。
1 实验部分
1.1 试剂与仪器
试剂:对苯二胺、磷酸(H3PO4)和乙二胺购自美国西格玛奥德里奇贸易有限公司,硫酸铝、氯化钠、乙酸、硼酸、醋酸及香豆素307购自阿拉丁试剂有限公司。
主要仪器:Cary Eclipse荧光光谱仪(美国Varian公司)、Lambda 950型UV-Vis吸收光谱仪(英国兰特里森特珀金埃尔默公司)、Tensor II型傅里叶红外光谱仪(FTIR)(德国Bruker公司)、FLS920瞬态-稳态荧光光谱仪(英国Edinburgh公司)、FV1000型激光扫描共聚焦荧光显微镜(LSCM)(日本Olympus公司),Vario EL CUBE型元素分析仪(德国Elementar公司)、JEM-1011型透射电镜(TEM)(日本电子光学公司,JEOL)、AXIS ULTRA DLD型X-射线光电子能谱(XPS)(日本Kratos公司)、SunRise酶标仪(奥地利Tecan Austria GmbH公司)。
1.2 N,P-CDs的制备
在50 mL烧杯中分别加入0.108 1 g对苯二胺、195 μL磷酸、960 μL乙二胺。反应混合物在酸碱中和放热的作用下迅速反应。将其放入微波炉(1 000 W)中加热3 min 20 s,冷却后加入5 mL超纯水,超声使其溶解。将产物用滤纸和微滤膜(0.22 μmol·L-1)过滤除去大分子颗粒。之后置于烧杯中通过500 Da~ 1 000 Da的透析袋透析4 h,每2 h换一次二次水。最后将其冷冻干燥备用。
1.3 N,P-CDs荧光量子产率
以香豆素307(量子产率为0.56)为参比测定荧光量子产率。分别配制不同浓度的N,P-CDs溶液和香豆素307溶液,使用Lambda 950 UV-Vis吸收分光光度计测定各溶液在413 nm处的吸光度(保持吸光度值小于0.1,防止自吸效应[29]。使用Varian Cary Eclipse荧光计记录当激发波长为413 nm时的荧光光谱面积(选取418 nm~700 nm波长范围内荧光曲线下的面积积分)。然后绘制荧光积分面积与吸光度之间的曲线图,以(1)式计算荧光量子产率:
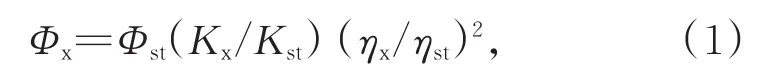
Φ、η和K分别表示量子产率、溶液的折射率和五点法的斜率;x和st分别表示样品和标准。
[37]人民网:《学汉语,原来含金量这么大》,http://www.hanban.edu.cn/article/2016-05/17/content_642047.htm,2016年5月17日。
1.4 N,P-CDs对Al3+的测定
为了确定N,P-CDs的选择性,适量金属离子盐溶解于10 mL超纯水得到16种0.1 mol/L的金属离子溶液。配制10 mg/mL的N,P-CDs溶液,加水得到略大于5 mg/mL的N,P-CDs,再加入微量0.1 mol/L的 HCl,以pH计测量,得到pH=4.5(保持Al3+不水解)的5 mg/mL的N,P-CDs工作溶液。
在N,P-CDs的选择性测定时,将金属离子(20 μL,0.1 mol/L)加入到2 mL N,P-CDs的工作溶液中,测量其荧光强度。为了评估其他金属离子对Al3+测定的干扰,通过将待测试离子(100 μL,0.1 mol/L)与2 mL的N,P-CDs工作溶液混合,进行荧光测量;随后,再加入一定量的Al3+(20 μL,0.1 mol/L)溶液,再测量荧光强度。测定Al3+时,先测量2 mL N,P-CDs工作溶液的荧光强度,然后将合适体积的0.1 mol/L Al3+加入工作溶液中,测量其荧光强度。
以荧光光谱仪记录激发波长为413 nm时,513 nm处发射波长的荧光强度,激发和发射狭缝均为10 nm,所有试验重复3次(没有特殊说明的荧光实验均采用此荧光条件)。
1.5 细胞毒性及成像实验
细胞毒性:将HeLa细胞接种到96孔板上,并在37℃、体积分数为5.0% CO2中培养24 h后,弃去上层液,给药孔中加入含不同浓度N,P-CDs(0、0.78、1.56、3.12、6.25、12.5和 25 mg/mL)的溶液。孵育一段时间后,将孔板内的培养基换成MTT新鲜培养基(5 mg/mL),继续培养。最后,吸去上层液,加入二甲基亚砜,将所得混合物室温震荡10 min后,以酶标仪测量混合物的光密度(OD)[30]。
细胞成像:成像前,细胞先用10 mmol/L PBS(pH=7.40)冲洗3次;再在1 mL高K+缓冲溶液(120 mmol/L KCl、30 mmol/L NaCl、1 mmol/L CaCl2、0.5 mmol/L Mg2SO4、1 mmol/L NaH2PO4、20 mmol/L NaOAC、5 mmol/L葡萄糖和20 mmol/L HEPES(4-羟乙基哌嗪乙磺酸))和5 μg/mL的尼日利亚霉素存在下,将细胞与碳点孵育10 min,在不同pH值(4.00、4.30、4.70、5.00、5.30、5.70、6.00)下,在LSCM上进行细胞内pH荧光成像[28]。
1.6 实际样品检测
取实验室自来水作为实际样品进行检测。首先将自来水进行过滤,然后将自来水和5 mg/mL的N,P-CDs工作溶液等体积混合,以0.1 mol/L的HCl通过pH计调节pH=4.5;取2 mL溶液加入1 cm比色皿中,再加入不同体积的Al3+标准溶液,测量荧光强度;根据工作曲线计算Al3+的含量,并计算加标回收率。
2 结果与讨论
2.1 N,P-CDs的表征
元素分析数据结果表明N,P-CDs主要包括C、H、O、N和P五种元素,其质量分数分别为28.35%、6.76%、31.51%(计算值)、20.05%和13.33%,经计算N,P-CDs组成的经验式为C7H20O6N4P。以XPS对合成的N,P-CDs进行了表征。N,P-CDs的XPS总谱(图1(a))共分为五个峰,分别为131.3、191.5、283.4、397.7和528.6 eV,对应于P2p,P2s,C1s,N1s和O1s,确证了元素分析的结果。图1(b)中高分辨O1s谱分裂为四个峰,结合能分别为 529.02、529.64、530.22和 530.88 eV,对应于O-C-O、P=O、C-OH/C-O-C和P-O中的氧。图1(c)中的高分辨C1s谱分裂为五个峰,结合能分别为 284.29、284.87、285.52、286.10和 287.32 eV,对应于C=C、C-C/C-P、C-OH/C-O-C、C=N/C-P和C=O中的碳。高分辨的N1s(图1(d))分别在397.85、398.35、399.0和399.83 eV处分解成四个峰,分别与C-N-C、N-(C)3、吡啶N和吡咯N相关[28]。图1(e)显示的是P2p谱的分峰,分别是位于133.37 eV的P2p3/2和133.83 eV的PC。N,P-CDs表面的官能团以FTIR表征如图1(f)。2 855 cm-1为C-H伸缩振动峰,2 500 cm-1~2 760 cm-1为P-OH的弯曲振动,C=N拉伸以及-CH3的弯曲振动分别对应1 569 cm-1和1 477 cm-1处。P-O-H、P-O-C和氢键型P=O分别在 960 cm-1、1 076 cm-1和 1 367 cm-1处[31]。这些实验数据证明N和P被成功掺杂进所制备的CDs中。

图1 (a)N,P-CDs的XPS总谱和高分辨(b)O1s谱;(c)C1s谱;(d)N1s谱和(e)P2p谱;(f)FTIR谱Fig.1 (a)XPS survey and high resolution spectrum of N,P-CDs(b)O1s,(c)C1s,(d)N1s,(e)P2p and(f)FTIR spectrum of N,P-CDs
所制备N,P-CDs的形貌和粒径如图2所示。图2(a)表明纳米颗粒呈球形或准球形,分散比较均匀,没有明显的团聚,图2(b)表明粒径分布范围为1 nm~2 nm,粒径分布较窄,平均粒径为1.35 nm。高分辨图谱没有取到明显的晶格条纹,说明所制备CDs为无定型,无明显的晶格结构。
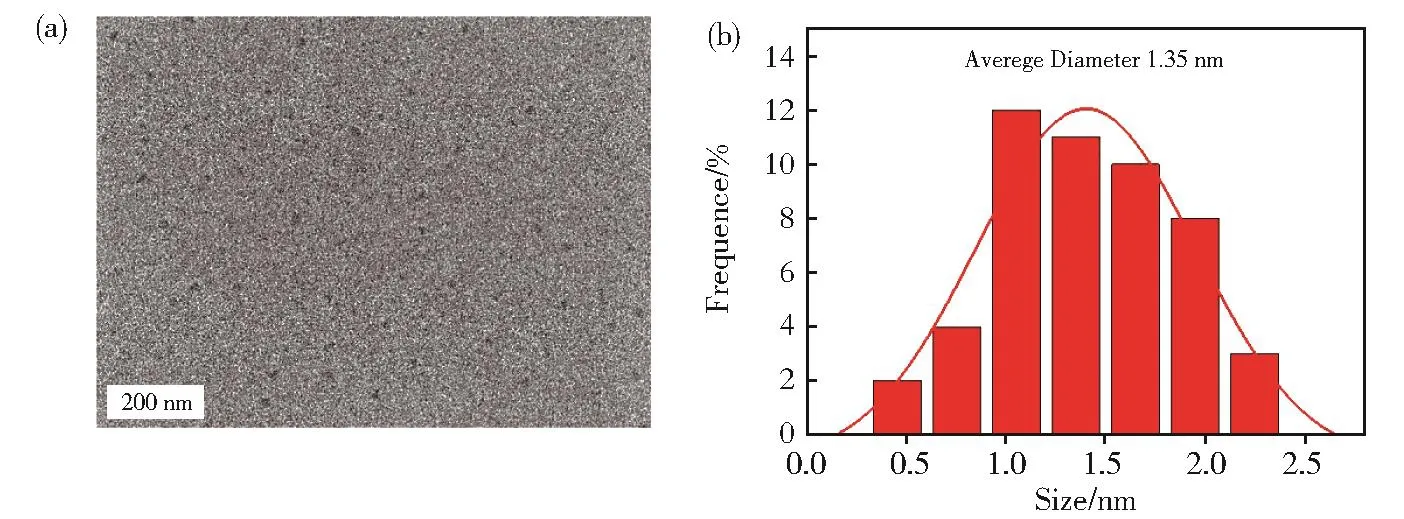
图2 (a)N,P-CDs的TEM和(b)粒径分布图Fig.2 (a)TEM image and(b)the diameter distribution of N,P-CDs
2.2 N,P-CDs的光学性质
N,P-CDs的UV-Vis吸收光谱图(图3(a),蓝线)有分别位于240 nm和300 nm的两个吸收峰,分别对应于苯环结构的sp2杂化区域的π→π*跃迁和C=O键的n→π*跃迁,此外,在400 nm处有弱的宽吸收带,可归因于能量较低的官能团的电子跃迁。图3(a)中左边和右边的插图分别为自然光和365 nm激发下N,P-CDs溶液的颜色。图3(a)中的红线和黑线表明N,P-CDs的最大激发和发射波长分别为413 nm和513 nm,图3(b)为N,P-CDs在340 nm~440 nm激发波长下的荧光发射光谱,当激发波长从340 nm变化到440 nm(间隔10 nm)时,发射波长变化不显著。以香豆素307为标准,通过(1)式计算得N,P-CDs的相对量子产率为2.6%。
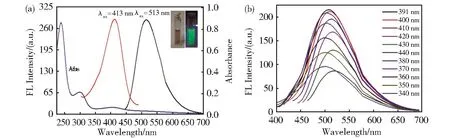
图3 (a)N,P-CDs的紫外可见吸收(蓝线)和荧光(红线激发,黑线发射)光谱;(b)不同激发波长下N,P-CDs的荧光发射光谱。图a中插图是自然光(左)和365 nm紫外灯(右)照射下N,P-CDs溶液的颜色Fig.3 (a)UV-Vis absorption(blue line)and fluorescence spectra(red line and black line are excitation and emission spectrum,respectively.)of N,P-CDs.(b)Fluorescence spectra of N,P-CDs at different excitation wavelengths
进一步考察了N,P-CDs的荧光稳定性。图4(a)表明当KCl溶液的体积浓度在0~ 4 mol/L范围内时,N,P-CDs在513 nm处的荧光强度变化较小,说明即使在较高的离子强度下,其荧光强度依然稳定,因此所合成的N,P-CDs可用于生物体中。氙灯照射160 min后,N,P-CDs的荧光强度几乎恒定(图4(b)),说明N,P-CDs溶液的抗光漂白能力强。不同pH对N,P-CDs的荧光强度的影响如图4(c),当溶液的pH值从1.00→8.00时,N,P-CDs的荧光强度随pH的增大而增强;当pH值从8.00→13.00时,荧光强度随pH的增大而减弱;在pH值4.00~6.00区间内荧光强度发生突变。因此,进一步考察了pH在1.00~8.00区间内对N,P-CDs荧光强度的影响。图4(d)为不同pH下的荧光滴定曲线,以Boltzmann函数模拟得到图4(e)所示的拟合曲线,得N,P-CDs的pKa=4.91,说明表面含有弱酸性官能团,这与FTIR谱上有以NH3+形式存在的氮一致。从N 1s XPS光谱中,氮原子也以吡啶N和吡咯N的形式存在。N,P-CDs的pH敏感性可归因于其表面吡咯N、吡啶N和NH2的部分质子化及去质子化。另外,可逆性是pH荧光探针的一个重要标准。使用浓盐酸和氢氧化钠调节N,P-CDs的pH在1.00~7.00之间波动来考察它的可逆性,如图4(f)所示。结果表明,此过程完全是可逆的。说明,N,P-CDs对pH的响应具有高度可逆性。
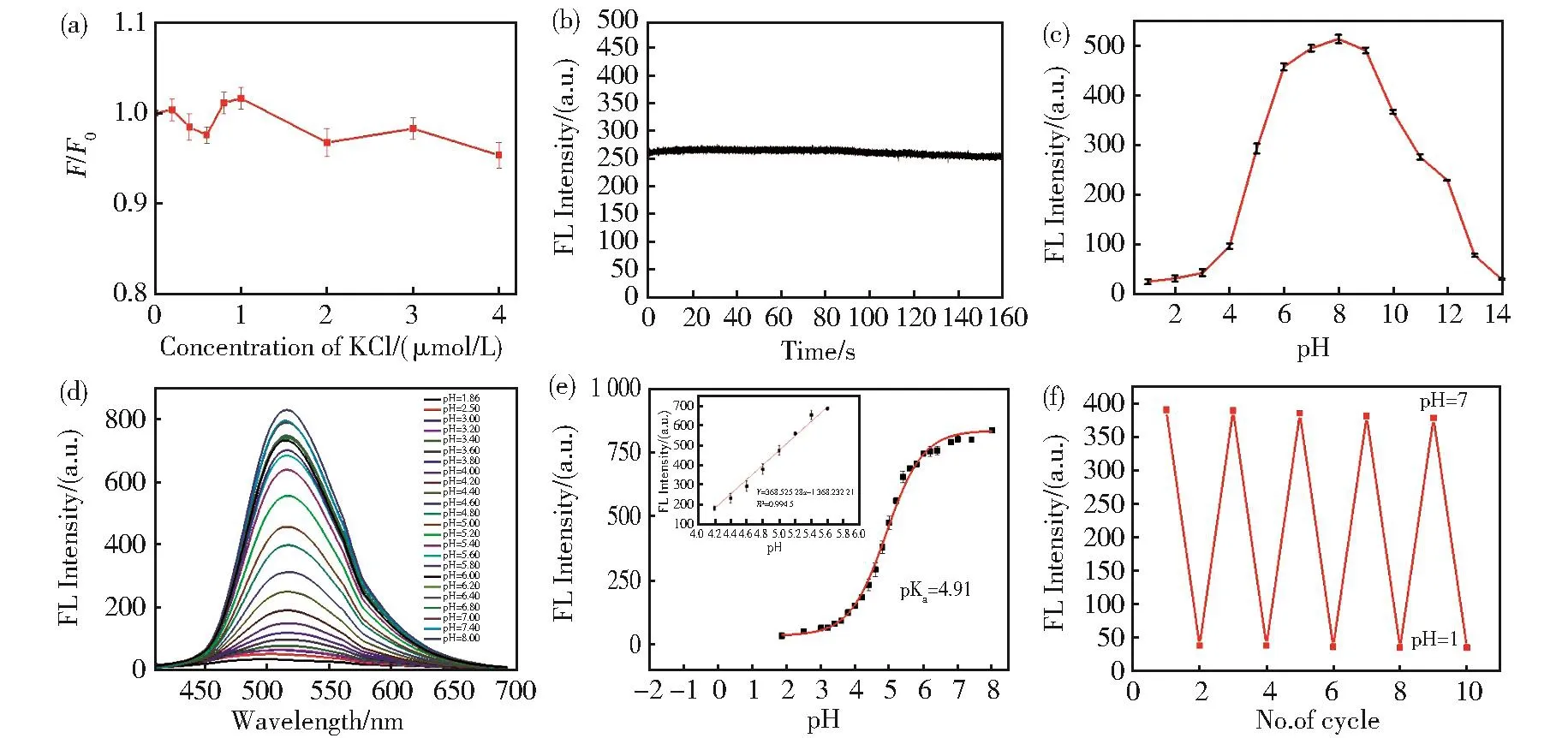
图4 (a)不同浓度KCl溶液对N,P-CDs荧光强度的影响;(b)N,P-CDs的光稳定性测试;(c)pH对N,P-CDs荧光强度的影响;(d)不同pH条件下N,P-CDs的荧光图谱;(e)513 nm处的pH依赖性荧光强度的Sigmoidal/Boltzmann拟合。插图显示了N,P-CDs在pH(4.00~ 6.00)的线性关系;(f)N,P-CDs在pH=1.00~ 7.00之间荧光可逆变化Fig.4 (a)Effect of different concentrations of KCl on the fluorescence intensity of N,P-CDs.(b)Photostability of N,P-CDs excited at Xenon arc lamp for 160 min.(c)Effect of pH on the fluorescence intensity of N,P-CDs.(d)Fluorescence spectra of N,P-CDs in various pH value.(e)Sigmoidal/Boltzmann fitting of pH-dependent fluorescence intensity at 513nm.The inset displays the linear plot of N,P-CD against pH(4.00-6.00).(f)Fluorescence reversible response against pH varied repeatedly between 1.00 and 7.00
2.3 荧光方法检测Al3+
图5(a)表明大部分金属离子对N,P-CDs的荧光强度没有明显影响,而Al3+对N,P-CDs的荧光猝灭程度较大,即所制备的N,P-CDs对Al3+有良好的选择性。另外,考察了其他金属离子存在时该N,PCDs抗干扰的能力(图5(b)),当溶液中存在Al3+浓度10倍的其他金属离子时,显示对Al3+检测并没有明显的干扰,说明N,P-CDs能够选择性识别Al3+而不受常见金属离子的干扰。图5(c)描述了在不同浓度的Al3+存在下N,P-CDs荧光强度的变化。同时在 73 μmol/L~ 120 μmol/L范围内Al3+的浓度与F/F0有良好的线性关系,检出限为21.03 μmol/L(S/N=3)。如图5(d)所示。不同参考文献中的CDs的制备方法及对Al3+的检测对比如表1。由表可见,我们制备CDs的方法用时较短,方法简便,节省能源;且所制备CDs可以直接响应Al3+,不需用间接的方法测定。参考文献中间接方法测定Al3+时,在确定可准确检测Al3+的最低浓度时是有困难的,需要多次试验,反复测定以后才能准确确定,不如直接测定方法快捷。

图5 (a)5 mg/mL N,P-CDs中加入20 μL,0.1 mol/L不同金属离子后的荧光强度;(b)N,P-CDs检测Al3+的抗干扰测试(黑条表示在N,P-CDs溶液中添加了金属离子(100 μL,0.1 mol/L)。红条表示随后将Al3+(20 μL,0.1 mol/L)添加到N,P-CDs溶液中);(c)5 mg/mL N,P-CDs在不同浓度Al3+存在时的荧光发射光谱;(d)F/F0与Al3+浓度的关系Fig.5 (a)Fluorescence intensity of 5 mg/mL N,P-CDs in the presence of different metal ions(20 μL,0.1 mol/L).(b)N,P-CDs detection Al3+ anti-interference test(The black bars represent the addition of other metal ions(100 μL,0.1 mol/L)to N,P-CDs solution.The red bars represent the subsequent addition of Al3+(20 μL,0.1 mol/L)to N,P-CDs solution).(c)Fluorescence emission spectra of N,P-CDs upon addition of various concentrations of Al3+.(d)The relationship between F/F0 and Al3+concentration
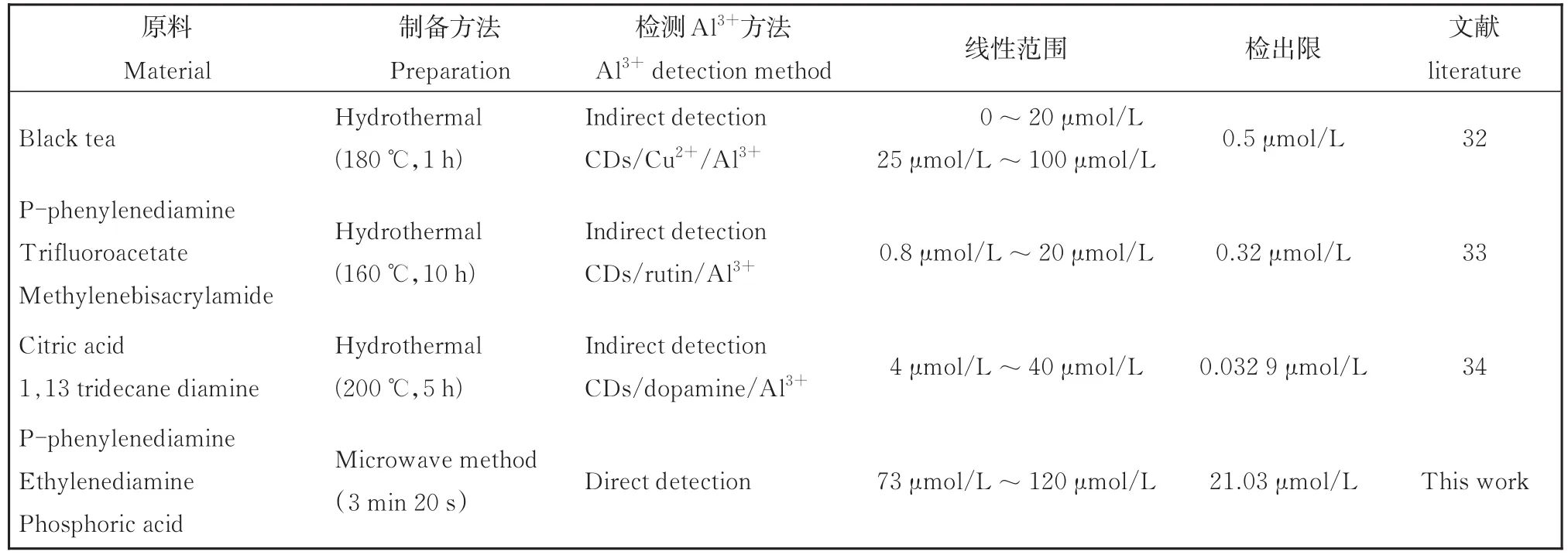
表1 不同方法制备的CDs用于检测的比较Table 1 Comparison of CDs prepared by different methods for the detection of Al3+
为了阐明Al3+猝灭N,P-CDs的荧光的机理,分别测定了N,P-CDs和N,P-CDs中加入120 μmol/L Al3+后的荧光寿命(图6(a)),计算出N,P-CDs和N,P-CDs/Al3+平均寿命分别为3.51 ns和3.81 ns,显示Al3+加入后N,P-CDs的荧光寿命基本没有发生明显的变化,说明Al3+以静态猝灭的方式猝灭了N,P-CDs的荧光。紫外滴定光谱如图6(b)所示,随着不同浓度的Al3+的加入,在498 nm左右出现了新的吸收峰,可能Al3+与N,P-CDs形成了复合物。比较N,P-CDs(图2(f))与N,P-CDs中加入Al3+的FTIR图6(c)可明显看出,加入Al3+后N,P-CDs的峰位置和峰强度均发生了变化,表明荧光猝灭可能是由于Al3+与N,P-CDs表面的基团发生了配位,这与静态猝灭的结果一致。

图6 (a)5 mg/mL N,P-CDs和在120 μmol/LAl3+存在时N,P-CDs的荧光寿命;(b)不同浓度Al3+存在时N,P-CDs的UV-Vis吸收光谱图;(c)加入Al3+后N,P-CDs的FTIR图Fig.6 (a)Fluorescence lifetime of 5 mg/mL N,P-CDs and N,P-CDs in the presence of 120 μmol/LAl3+.(b)UV-Vis absorption spectra of the N,P-CDs and in the presence of different concentrations of Al3+.(c)FTIR spectra of N,P-CDs and N,P-CDs in the presence of Al3+
2.4 实际样品中Al3+的测定
以所建立新的分析方法对实际水样中Al3+含量进行了加标回收率实验(表2)。误差分析基于95% 置信度的t分布(t0.05,5=2.57)函数的双边检验。在实际样品中没有检测到Al3+的存在。从表2得出,在自来水中检测到的Al3+浓度与加入的浓度基本一致,回收率在95.0%~102.5%之间,相对标准偏差在1.40%~2.30%之间。此方法可以用于实际样品中Al3+的检测。
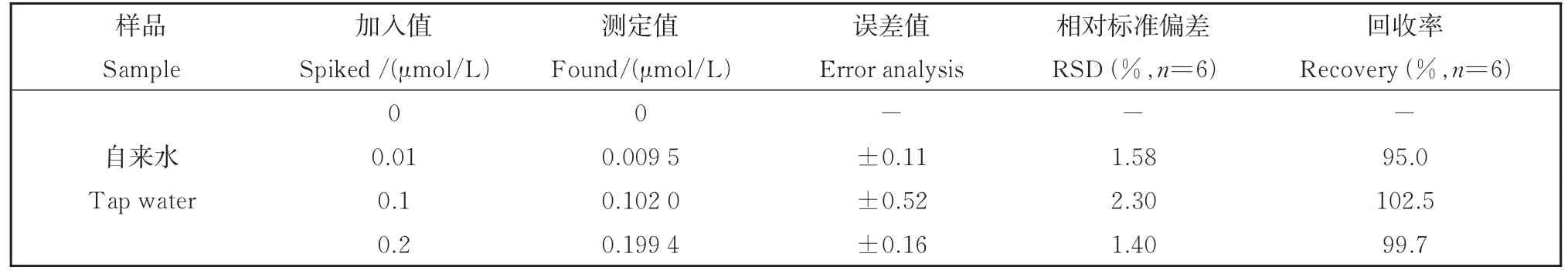
表2 自来水中Al3+的测定Table 2 Determination of Al3+ in tap water samples
2.5 N,P-CDs的细胞毒性及细胞成像
选用HeLa细胞作为模型细胞,以MTT法测定N,P-CDs的细胞毒性(图7)。不同浓度N,P-CDs与细胞孵育24 h后,即使N,P-CDs的浓度达到12.5 mg/mL时,HeLa细胞的成活率仍然比较高,基本都在90%以上,表明N,P-CDs对细胞表现出较低的毒性,表明细胞成像的可行性。
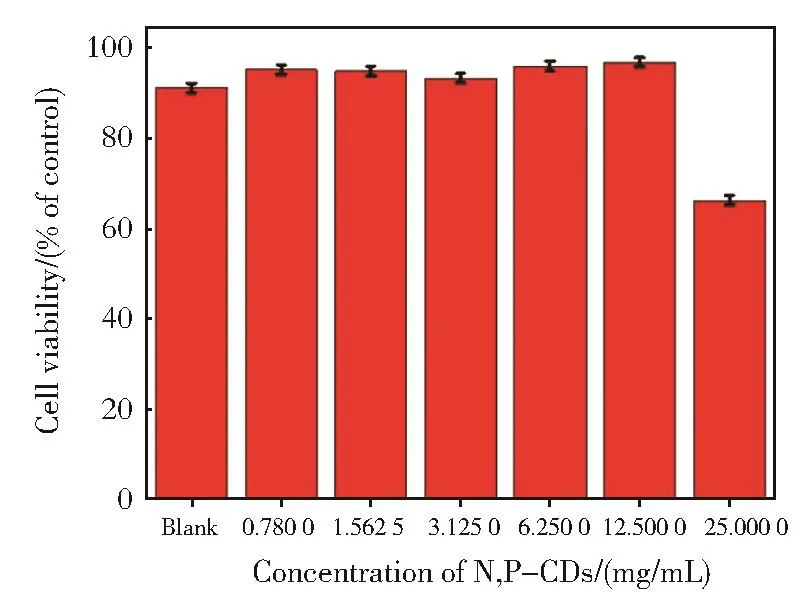
图7 不同浓度的N,P-CDs对HeLa细胞的毒性测定Fig.7 Cell viability(%)of HeLa cells after 24 h treatment with different concentration of N,P-CDs calculated from MTT assay
图8为不同 pH(4.00、4.30、4.70、5.00、5.30、5.70、6.00和7.40)下5 mg/mL的N,P-CDs标记的HeLa细胞的荧光成像结果。由图可见,N,PCDs可进入HeLa细胞质,发出绿色荧光且细胞仍保持良好的形态,表明了N,P-CDs的良好生物相容性。随着pH由4.00增加到7.00,荧光强度逐渐增强,并在pH=7.00时荧光达到最强。因此,N,P-CDs具有在活细胞内检测pH的潜在应用价值。

图8 HeLa细胞与N,P-CDs孵育后的LCSM图。第一列为明场图;第二列暗场图;第三列为叠加场图(pH=4.00,4.30,4.70,5.00,5.30,5.70,6.00和7.00)Fig.8 Fluorescence imaging of HeLa cells treated with N,PCDs.(a)bright field,(b)dark field,(c)overlay images of(a,b)(pH=4.00,4.30,4.70,5.00,5.30,5.70,6.00 and 7.00)
3 结论
本文以对苯二胺、磷酸、乙二胺为原料以微波法合成了N,P-CDs,基于荧光静态猝灭的机理,构建了一种绿色荧光纳米探针识别Al3+的检测方法。该探针在 Al3+浓度 73.0 μmol/L ~ 120.0 μmol/L的范围内具有良好的线性关系。同时该碳点在pH 4.00~6.00范围内可灵敏地检测pH值。MTT分析结果表明,N,P-CDs具有很好的生物相容性和低的生物毒性,可应用于细胞成像,为环境和生物传感应用提供了一种新方法。

