分子伴侣4-苯基丁酸通过抑制内质网应激减轻寄生疫霉菌对植物的侵染
魏玉树,唐雅伶,王小雪,高贤贤,单卫星,强晓玉
(西北农林科技大学 农学院,陕西杨凌 712100)
蛋白质是参与生命体代谢、信号转导和生长发育的重要大分子,而蛋白质的合成和正确的折叠修饰对其发挥功能至关重要。内质网作为重要的细胞器,主要用于蛋白折叠和翻译后修饰。真核生物中普遍存在一个负责监测蛋白质折叠水平的系统,即内质网质量监控系统(Endoplasmic reticulum quality control, ERQC)。通常,ERQC可通过定位于内质网的分子伴侣蛋白、寡聚糖转移酶亚基等关键因子来维持蛋白折叠加工的稳定秩序,以保证内质网功能的正常发挥。然而在外界环境胁迫压力下,细胞会产生大量分泌蛋白进入内质网,使得ERQC难以维持平衡,非折叠蛋白在内质网的积累则引发内质网应激(ER stress)。而内质网应激效应(Unfolded Protein Response,UPR)作为真核细胞中保守的适应性机制,能够通过位于内质网膜的感应因子识别内质网应激并激活不同的信号级联通路,增强 ERQC 相关蛋白合成、减弱蛋白翻译速率、加快内质网相关蛋白的分泌与降解,从而修复内质网的正常功能并维持细胞稳定[1-3]。研究表明,健康的内质网功能和UPR在植物抵御病原菌入侵以及增强植物逆境适应性方面发挥着关键作用[4-11]。
寄生疫霉菌(Phytophthoraparasitica)是一类典型的土传植物病原菌,该病原菌的侵染可引发烟草黑胫病、柑橘根腐病和流胶病等多种植物病害。寄生疫霉菌的侵染循环与致病疫霉菌和大豆疫霉菌相似,既能产生无性游动孢子也能产生厚壁的有性卵孢子。由于寄生疫霉菌的寄主范围比较广泛,且寄生疫霉菌遗传转化体系成熟,因此,寄生疫霉菌被作为一种重要模式卵菌。寄生疫霉菌具有典型的半活体营养生长特征,在其侵染寄主植物初期的活性营养生长阶段,植物的免疫响应尤为活跃。Qiang等[12]及郑晴[13]借助寄生疫霉菌与模式植物拟南芥亲和互作的研究体系,揭示寄生疫霉菌在早期活体营养侵染阶段可促使植物细胞的内质网超微结构发生异常,并伴随着内质网应激信号的诱导激活,说明植物响应寄生疫霉菌早期侵染时,内质网的正常功能受到干扰,并且产生了内质网应激现象。然而,内质网应激的发生对寄生疫霉菌侵染寄主植物的影响机制尚不清楚。
4-苯基丁酸(4-phenylbutyric acid, 4-PBA)是一种具有分子伴侣作用的短链芳香族脂肪酸,它可以修复或逆转蛋白质分子的错误移位和错误折叠,并帮助其建立正常的空间结构,从而达到缓解内质网应激的作用[14]。因此,4-PBA也通常被定义为内质网应激修复剂。目前,4-PBA在医学和药物研发等领域已有广泛的报道与应用。例如,4-PBA通过抑制内质网应激,能够减轻动物的神经元损失,从而为预防治疗阿尔茨海默病等神经变性疾病提供了理论依据[15]。有研究表明,4-PBA可通过抑制PERK/Bip介导的内质网应激信号通路,进而缓解由内质网应激引起的骨关节炎(OA)大鼠的关节损伤[16]。然而,4-PBA在病原微生物引发寄主植物产生的内质网应激中的作用尚不明确,尤其是在植物抵御病原微生物侵染的过程中是否发挥功能鲜有报道。本研究中,笔者对寄生疫霉菌侵染的拟南芥植株进行4-PBA处理,发现低浓度4-PBA在不影响植物正常生长的同时,不仅能够缓解由病菌侵染而诱导产生的植物内质网应激,而且可有效减轻寄生疫霉菌在植物体内的定殖生物量,从而缓解植物的感病表型。这为深入揭示内质网应激对植物与微生物互作的影响机制提供理论基础,并为开发新型药物靶点应用于作物疫霉属卵菌病害的绿色综合防控提供了新思路。
1 材料与方法
1.1 植物材料,病原菌接种及4-PBA处理
植物材料:拟南芥野生型Col-0种子,寄生疫霉菌(带绿色荧光蛋白GFP的转化菌株,1121)由西北农林科技大学单卫星实验室保存。
培养基:5%固体CA培养基(胡萝卜汁25 mL、CaCO30.05 g、β-谷甾醇10 mg、琼脂3.75 g, 加水定容至500 mL,121 ℃湿热灭菌 30 min)。盐溶液(5 mmol/L KNO3、0.02 mmol/L FeSO4、4 mmol/L MgSO4、10 mmol/L CaNO3、0.02 mmol/L EDTA-Na2)。
拟南芥皿内种植:用灭菌水清洗种子表面杂质,用75%乙醇处理种子1 min,立即用灭菌水清洗种子表面乙醇,再用1%次氯酸钠处理10 min,用灭菌ddH2O冲洗种子4次,最后将种子置于灭菌滤纸上吹干,于4 ℃冰箱中黑暗放置3 d后,在超净工作台中用移液枪点于培养基上,在23 ℃植物培养箱(光照12 h,黑暗12 h)中培养,用于生长敏感性分析的幼苗于10 d后处理,用于接菌处理的幼苗于2周后处理。
基质种植的拟南芥:将种子点在基质上(腐殖土∶蛭石=2∶1),封上保鲜膜。转移到 23 ℃恒温培养室中,10 d后去除保鲜膜,生长4周后备用。
拟南芥皿内接菌:将实验室保存的寄生疫霉菌株(1121)挑到5%固体CA培养基上,于23 ℃培养箱培养3~4 d。将固培好的寄生疫霉菌用牙签分割成小片,倒入5%CA液体培养基中,培养3~4 d。在超净台中倒掉液体CA,浸没在盐溶液中,盐培5~7 d,可用于接菌。将盐培好的寄生疫霉菌倒掉盐溶液,加入超纯水,清洗2次,之后加入适量dH2O,放入4 ℃冰箱中30 min。之后,将盐培的寄生疫霉菌放入23 ℃培养箱中,刺激30 min。于显微镜下观察游动孢子情况,用血球计数板配置成浓度为 100 个/μL的孢子悬浮液。
皿内游动孢子蘸根接菌:取生长10 d的拟南芥从培养基中轻轻拔出,将根部置于孢子悬浮液中浸泡 15 s,将多余的液滴去除,放置于不含糖的1/2MS培养基中,以水处理为对照,封口后将培养基放于培养箱中。12 h后观察表型。每个处理3次重复。
4-PBA处理:将4-PBA稀释至1 μmol/L ,按照蘸根接菌的方法,用4-PBA处理拟南芥皿内接种寄生疫霉游动孢子12 h后的根部,12 h后在荧光显微镜下用紫外线或者蓝光观察并测量其鲜质量和收样。同时,用1 μmol/L 4-PBA溶液和相应的对照溶液喷洒处理培养6周的拟南芥活体植株, 并于处理后3 d、5 d和10 d对植株的生长表型进行观察。每个处理3次重复。
1.2 取样称量及 RNA提取
收取蘸取无菌水5 d苗龄的拟南芥野生型Col-0的根部样品(Mock),接种寄生疫霉菌的拟南芥根部12 h样品(P.p),接种寄生疫霉菌12 h后4-PBA处理的拟南芥根部样品(P.p+Mock)。将收取好的样品在天平上称取各样品鲜质量,之后于液氮中研磨至粉末状,采用TRIZOL(invitrogen)试剂说明书的方法提取拟南芥根样的总RNA,并用核酸蛋白微量检测仪(Nanodrop)检测RNA的纯度。参考TaKara公司反转录试剂盒(Prime Script TM RT regent kit,货号 RR047A)说明书进行:根据测定好的RNA浓度,计算出反转录所需的RNA量;并反转录得到cDNA。
1.3 定量反转录PCR检测分析
利用在线软件(http://sg.idtdna.com/p rimer quest/ Home/Index)设计AtBIP3的qRT-PCR特异性检测引物,以编码拟南芥泛素缀合酶的基因(Ubiq uitin-carrier enzymes 9,AtUBC9)为内参基因,检测寄生疫霉菌定殖量的寄生疫霉菌WS014(PPTG_09948)为检测基因(表1)。qRT-PCR检测采用LightCycler 480实时荧光定量PCR仪(LightCycler 480, Roche), 使用SYBR GreenI染料(Roche, 德国)。qRT-PCR体系(20 μL),ddH2O 7.4 μL,上下游引物(10 μmol/L)各0.8 μL,模板1 μL(终浓度为10 ng/μL)。qRT-PCR程序:95 ℃预变性 10 min;95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸45 s,40个循环。基因相对表达量的计算采用2-ΔΔCt法。每个处理3次重复。
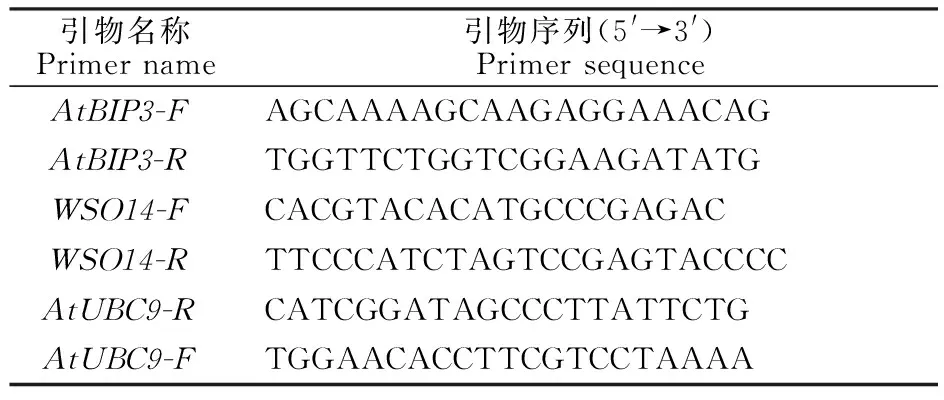
表1 qRT-PCR所用引物序列Table 1 Primers used in qRT-PCR
2 结果与分析
2.1 4-PBA可缓解由寄生疫霉菌侵染而诱导产生的植物内质网应激
相比对照植株,接种寄生疫霉菌的植株鲜质量下降约60%(图1-A),说明植物在病菌侵染时呈现明显的生长受阻表型;而寄生疫霉菌和4-PBA共处理的植株鲜质量下降约40%(图1-A),说明4-PBA在一定程度上可缓解病菌侵染引发的植物生长受阻表型。

A.10 d苗龄的拟南芥野生型Col-0植株分别进行寄生疫霉菌游动孢子蘸根接种和对照处理,接菌12 h之后又进行1 μmol/L 4-PBA和对照处理,对植株的鲜质量在处理后12 h进行测量和分析。结果代表3次生物学重复试验的均值±标准误。每组选取20棵左右的植株进行分析。使用t检验进行差异显著性验证(“*”代表P-value<0.05,有显著差异,“**”代表P-value<0.01,有极显著差异)B.qRT-PCR分析UPR标记基因 BiP3的表达水平。两周苗龄的拟南芥Col-0根部进行寄生疫霉菌游动孢子接菌和对照处理,并于接菌3 h后进行1 μmol/L 4-PBA和对照处理,并于处理12 h收取根样,提取总RNA。结果代表3次生物学重复试验的均值±标准误。使用t检验进行差异显著性验证(“*”代表P-value<0.05,有显著差异,“**”代表P-value<0.01,有极显著差异)A.Ten-day-old Col-0 seedlings were dip-inoculated by P.parasitica zoospores or treated with mock solution and thereafter followed with the treatment of 1 μmol/L 4-PBA at 12 hpi. Plant biomass was determined at 12 h post treatment. Data presentthree independent experiments±SE. For each experiment, 20 plants were analyzed per treatment. Asterisks indicate significance at P<0.05(*) and P<0.01(**) analyzed by student’s t-testB.The expression levels of UPR marker gene BIP3 were evaluated by qRT-PCR. Two-week-old A.thaliana Col-0 plant roots were dip-inoculated by P.parasitica zoospores or treated with mock solution and followed with the treatment of 1 μmol/L 4-PBA at 3 hpi. Total RNA was extracted from 4-PBA/mock treated roots at 12 h. Data presentthree independent experiments±SE.Asterisks indicates significant differences at P<0.05(*) and P<0.01(**) analyzed by student’s t-test图1 4-PBA可缓解寄生疫霉菌侵染引起的植物生长受阻及内质网应激信号的诱导激活拟南芥野生型Col-0植株鲜质量的测量Fig.1 4-PBA attenuates plant growth retardation and ER stress response induced upon infection with P.parasitica fresh mass analysis on A.thaliana Col-0 seedlings
qRT-PCR结果表明,编码蛋白折叠伴侣的BiP3表达水平被寄生疫霉菌显著诱导上调(图1B)[8],而4-PBA在一定程度上减弱BiP3被寄生疫霉菌诱导表达的水平(图1-B)。4-PBA可缓解寄生疫霉菌侵染而诱导产生的植物内质网应激。
2.2 4-PBA显著减轻寄生疫霉菌对植物组织的侵染程度
接种寄生疫霉菌的拟南芥植株根部明显被菌丝覆盖,相比而言,处理4-PBA后明显减少菌丝在寄主植物根部上的扩展(图2-A)。

A.10 d苗龄的拟南芥Col-0植株根部首先进行寄生疫霉菌游动孢子接菌,并于接菌6 h后分别进行1 μmol/L 4-PBA和对照处理。处理后的植株放置于1/2 MS培养基生长3 d后病菌的侵染及拟南芥植株的生长状态观察B.分别选取不同处理中20棵幼苗进行叶片褪绿黄化统计分析。结果代表3次生物学重复试验的均值±标准误。使用t检验进行差异显著性验证(“**”代表P-value<0.01,有极显著差异)A.Ten-day-old Col-0 roots were dip-inoculated by P.parasitica zoospores and followed with the treatment of 1 μmol/L 4-PBA and mock solution at 6 hpi. After treatment of 4-PBA/mock solution, seedlings were grown on 1/2MS medium for 3 d and followed with the observation of P.parasitica infection and plant growth phenotypeB.Twenty seedlings from different treatments were used to analyze the ratio of leaf chlorosis. Data present three independent experiments±SE. For each experiment, 20 plants were analyzed per treatment. Asterisks indicates significance at P<0.01(**) analyzed by student’s t-test图2 4-PBA显著减轻寄生疫霉菌对植物组织的侵染Fig.2 4-PBA attenuates colonization of P.parasitica on plant tissue
通过进一步统计和分析拟南芥幼苗叶片的褪绿黄化率可发现,相比寄生疫霉菌侵染引起的植株褪绿黄化,处理4-PBA能够明显抑制植株萎黄死亡的表型(图2-A),并显著降低由寄生疫霉菌侵染导致的植株萎黄死亡率(图2-B)。由此说明,内质网应激的发生能够影响植物与疫霉菌的亲和互作,4-PBA可能通过缓解由寄生疫霉菌侵染引发的植物内质网应激,进而减轻病菌对植物组织的侵染程度。
2.3 4-PBA可抑制寄生疫霉菌在植物体内的扩展和定殖
相比寄生疫霉菌在根组织细胞内形成吸器并产生大量的菌丝体(图3-B),4-PBA的处理使得根部细胞中寄生疫霉菌吸器的形成以及菌丝的扩展被明显抑制(图3-A),揭示了4-PBA能够影响寄生疫霉菌在植物体内的定殖和扩展。

10 d苗龄的拟南芥Col-0植株根部首先进行寄生疫霉菌游动孢子接菌,并于接菌6 h后分别进行1 μmol/L 4-PBA和对照处理。 A-D.处理12 h后在荧光显微镜下观察不同处理下病菌的侵染情况。标尺=50 μm。E.处理12 h后的根样用于提取总RNA,利用寄生疫霉菌管家基因WS014引物和拟南芥UBC9引物进行qRT-PCR,定量分析寄生疫霉菌的生物量。数据表示4-PBA处理相比于对照处理下,寄生疫霉菌的相对生物量。结果代表3次生物学重复试验的均值±标准误。使用t检验进行差异显著性验证(“**”代表P-value<0.01,有极显著差异)Ten-day-old Col-0 roots were dip-inoculated by P.parasitica zoospores and followed with the treatment of 1 μmol/L 4-PBA and mock solution at 6 hpi. A-D.After 12h post 4-PBA treatment, the colonization of P.parasitica were observed under epifluorescence microscope. Bar=50 μm.E.After 12h post 4-PBA treatment, the roots were harvested for total RNA extraction. Using the primers of P.parasiticaWS014 and A.thaliana UBC9, qRT-PCR was employed to quantitate the biomass of P.parasitica. The ordinate indicates biomass of P.parasitica in 4-PBA treated seedlings relative to that in mock treatment seedlings. Data presentthree independent experiments±SE. Asterisks indicates significance at P<0.01(**) analyzed by student’s t-test图3 4-PBA能够减轻寄生疫霉菌在拟南芥根部的扩展和定殖Fig.3 4-PBA alleviates colonization of P.parasitica on A.thaliana roots
通过实时定量PCR分析了不同处理下寄生疫霉菌定殖于植物根组织中的生物量。与荧光显微镜观察结果相一致,可见相比寄生疫霉菌和对照溶液共处理的根部组织,寄生疫霉菌和4-PBA共处理的根部呈现出显著减少的寄生疫霉菌生物量(图3-E),说明4-PBA能够抑制寄生疫霉菌在植物根部组织中的定殖生物量。
2.4 4-PBA不影响植物正常的生长表型
与对照相比,浓度分别为0.1 μmol/L、0.5 μmol/L和1 μmol/L的 4-PBA处理后1 d、3 d和5 d的拟南芥幼苗呈现出正常的生长表型(图4-A),并且植株鲜质量并无明显差异(图4-B)。

A-B.生长于1/2MS培养基2周的拟南芥Col-0根部分别进行0.1 μmol/L 、0.5 μmol/L和1 μmol/L 4-PBA处理和对照处理,并于处理后1 d、3 d和5 d对幼苗的生长表型进行了观察和记录;对植株的鲜质量在处理后1 d、3 d和5 d后分别进行了测量和分析。结果代表3次生物学重复试验的均值±标准误。每组试验中选取20棵左右的植株进行分析。使用t检验进行差异显著性验证(“N.S”代表无显著差异)。C.6周苗龄的拟南芥Col-0活体植株喷施1 μmol/L 4-PBA和对照溶液,并于处理后3 d、5 d和10 d后进行生长表型观察和记录A-B.Two-week-old A.thaliana Col-0 roots were treated with 0.1 μmol/L ,0.5 μmol/L and 1 μmol/L 4-PBA as well as respective mock solution. The growth phenotype of seedlings was observed and recorded at 1d, 3d and 5d post treatment and the seedlings’ fresh mass was measured and analyzed at indicated time points. Data present three independent experiments±SE. Twenty seedlings were analyzed in each group of experiment. N.S. indicates no significance analyzed by student’s t-test.C.Six-week-old A.thaliana Col-0 plants were spray-treated with 1 μmol/L 4-PBA and mock solution. The plant growth phenotype were observed and recorded at 3 d, 5 d and 10 d post treatment图4 4-PBA不影响植物正常的生长表型Fig.4 4-PBA does not affect the plant growth phenotype
此外,还用1 μmol/L 4-PBA溶液和相应的对照溶液喷洒处理6周大的拟南芥活体植株,并于处理后3 d、5 d和10 d对植株的生长表型进行观察,结果发现:和对照处理相比,1 μmol/L的4-PBA处理的拟南芥植株生长表型并没有明显变化(图4-C)。上述结果表明,适当浓度的4-PBA并不会影响植物正常的生长表型。
3 讨 论
内质网是真核细胞中最为重要的细胞器之一,是蛋白质合成与折叠以及翻译后修饰、脂类和固醇合成、维持Ca2+动态平衡的关键功能位点。在哺乳动物研究中发现,当内质网功能处于紊乱状态时,会诱发内质网应激,产生一系列细胞反应,参与多种神经退行性疾病的发生与发展[17]。相比而言,尽管植物的内质网应激及UPR信号机制仍有待深入研究,已有研究揭示了内质网在植物对病原菌的免疫应答中具有中心调节作用,当其正常功能被干扰或破坏时,会促进病菌入侵寄主细胞[4,12,18]。因此,提高内质网功能的稳定性并探索内质网应激的发生机制对于增强作物逆境适应性,并推进绿色可持续农业生产具有重要的科学意义。
最近的研究发现,拟南芥在响应寄生疫霉菌早期侵染时,其内质网应激信号通路被诱导激活[12]。本研究结果显示,相比于对照处理中拟南芥植株的健康生长表型,寄生疫霉菌侵染24 h的拟南芥Col-0植株呈现出明显的生长受阻表型(图1-A),该生长敏感表型进一步证实寄生疫霉菌的侵染能够引发植物细胞内质网应激的产生。由此可推测:病菌诱导植物细胞产生的内质网应激可能有助于病菌对寄主植物的成功侵染。
分子伴侣4-PBA是一种短链芳香族脂肪酸,在哺乳动物研究中发现,4-PBA能够有效缓解衣霉素和毒胡萝卜素等应激化学诱导剂引发动物细胞产生的内质网应激[19]。同时,研究证明4-PBA可减轻原代背根神经结神经元高糖血症诱导的氧化应激和细胞凋亡,但并不改变细胞活力和钠通道的表达[5]。然而,内质网应激修复剂4-PBA对植物抵御病原菌侵染的影响及其在植物与微生物互作中的功能研究鲜有报道。本研究结果表明,4-PBA不仅能够缓解由寄生疫霉菌侵染引发的植株生长受阻的表型(图1-A),还明显减弱寄生疫霉菌早期侵染引起的内质网应激信号标记基因AtBiP3的诱导表达水平(图1-B),揭示分子伴侣4-PBA对于寄生疫霉菌侵染而诱导产生的植物内质网应激具有一定程度的修复和缓解作用。
而4-PBA能够显著减轻寄生疫霉菌对植物组织的侵染以及植株的萎黄死亡率(图2-A, 2-B),揭示内质网应激的发生可能是促进病菌侵染的关键因素。最近的研究也证实内质网应激感应因子bZIP60和bZIP28缺失的拟南芥突变体对寄生疫霉菌呈现感病表型[12]。因此,推测4-PBA可能通过缓解病菌引发的内质网应激,维持ERQC的稳定,从而促使植物的免疫系统得到恢复,以更有效地抵御病菌的入侵。同时,4-PBA能够抑制寄生疫霉菌在植物体内的扩展和定殖(图3),该结果揭示4-PBA对抑制寄生疫霉菌的定殖和扩展也具有重要作用。
值得注意的是:适当浓度的4-PBA对拟南芥幼苗的生长及鲜质量并无显著影响(图4-A,4-B),并且对活体植株的正常生长也无明显影响(图4-C),这说明4-PBA对植物的生长并无化学药剂的负效应,也证明其在作物抗病以及绿色可持续农业生产中具有良好的潜在应用价值。
综上所述,本研究证实内质网应激修复剂4-PBA在不影响植物正常生长的同时,不仅能够缓解寄生疫霉菌诱导产生的植物细胞内质网应激,还对寄生疫霉菌在植物体内的扩展和定殖具有抑制作用。因此,4-PBA作为一种内质网应激修复剂,有望作为一种新型的药物靶点应用于作物疫霉属卵菌病害的绿色综合防控,同时也为探索绿色和可持续发展的抗病新途径提供了新思路。

