羊肚菌霉菌性枯萎病病原真菌的分离鉴定及其生物学特性
付 博,王家哲,李英梅,张淑莲,郝 哲,张 锋
(1.陕西省生物农业研究所,西安 710043;2.陕西省酶工程技术研究中心,西安 710600;3.榆林市农垦服务中心,陕西榆林 719000)
羊肚菌(Morchellaspp.)是世界范围内广泛分布的珍稀、名贵食药用真菌,为子囊菌门(Ascomycota)、盘菌纲(Pezizomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella),其属模式种是Morchellaesculenta(L.) Pers.[1]。为进一步保护羊肚菌的自然生态和种质资源,近年来中国人工栽培羊肚菌发展迅速,全国羊肚菌栽培面积至2019年已超过8 000 hm2[2-4]。随着羊肚菌栽培规模的逐步扩大,羊肚菌霉菌性枯萎病在四川、湖北、陕西等主要栽培地普遍发生,该病原菌主要侵染子囊果,温度高于25 ℃和相对湿度高于90%条件下病害迅速扩展,可引起患病部位的枯萎、腐烂和子实体畸形,成为近年来严重影响羊肚菌产业发展的真菌性病害,由于该病害发生范围广、传播速度快、缺乏有效防治手段,每年有近70%的种植户无法获得稳定收益[5-7]。
目前,关于羊肚菌霉菌性枯萎病的病原菌有一定的争议,有报道显示该病原菌为长孢卵单隔孢霉(Diploosporalongispora)[7],也有报道称其病原菌为Paecilomycespenicillatus[8],早期NCBI数据库的部分学者将D.longispora定名为拟青霉属的种,但是两种菌体的分生孢子有显著差异,长孢卵单隔孢霉的分生孢子有横隔,而拟青霉属的分生孢子没有横隔,在进行序列BLAST比对时较难区分,必须结合菌体细胞形态观察[9-10]。
本文对陕西省发生的羊肚菌霉菌性枯萎病的病原真菌进行分离鉴定,以明确其种类和分类地位,并进一步研究病原菌的生物学特性,为该病害的研究与防治提供理论依据。
1 材料与方法
1.1 供试病样及羊肚菌品种
羊肚菌霉菌性枯萎病样,采集于陕西省榆林市马合农场食用菌产业科技示范园。供试羊肚菌品种为‘六妹羊肚菌’(M.sextelata)。
1.2 主要试剂和仪器
PCR所用Buffer、TaqMix等购自北京鼎国生物技术公司;DL2000 DNA Marker、Ezup柱式真菌基因组DNA提取试剂盒购自生工生物工程(上海)股份有限公司。离心机Centrifuge5415D、Centrifuge5810R、PCR仪、微量可调移液器均购自Eppendorf公司;显微镜为奥林巴斯BX21;凝胶成像系统购自SYNGENE公司,电泳仪购自Bio-RAD公司,培养箱、水浴锅等均为国产仪器。
1.3 病原菌的分离和纯化
用解剖针挑取羊肚菌病灶处白色菌丝,置于PDA培养基进行分离(含终浓度为30 mg/L的链霉素),单孢纯化法对病原菌进行纯化,培养温度25 ℃。获得的纯培养物置于PDA斜面4 ℃保藏[11]。
1.4 致病性测定
将分离纯化的病原真菌接种于PDA固体培养基,25 ℃、培养14 d至产孢,制备孢子悬液 (1.0×105CFU/mL)。用75%酒精对羊肚菌表面进行消毒,无菌手术刀在菌盖上切约5 mm的伤口,并在伤口处滴加200 μL的孢子悬液,以滴加无菌水为空白对照,设置15个重复,接种病原菌后用塑料杯罩住羊肚菌进行保湿,每天观察并记录发病情况,待菌盖上出现病症后,按照上述“1.3”的分离纯化方法再次分离纯化病原物。
1.5 病原菌的形态学鉴定
将分离纯化的病原分离物,在PDA培养基上25 ℃,培养14 d,观察菌落形态。待病原菌产生分生孢子后,溶于无菌水并置于显微镜观察分子孢子形态。
1.6 病原菌的分子生物学鉴定
挑取待测病原菌的菌丝,采用Ezup柱式真菌基因组DNA提取试剂盒提取病原真菌的基因组DNA,-20 ℃储存备用。采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[12]扩增病原菌的rDNA ITS序列。PCR反应体积50 μL:TaqPCR Master Mix 25 μL,模板DNA 1 μL,正、反向引物各2 μL,ddH2O 20 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 40 s,60 ℃ 50 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。8 g/L琼脂糖凝胶电泳检测PCR产物,送北京擎科生物科技有限公司进行测序,测序结果提交NCBI(https://www.ncbi.nlm.nih.gov/)进行BLAST序列比对,采用MEGA 6.0软件的自举法(Bootstrap)进行1 000次重复检验,邻接法(Neighbor-joining,NJ)构建系统进化树。
1.7 病原菌的生物学特性
1.7.1 不同温度对菌丝体生长的影响 打孔器(直径5 mm)打取在PDA平板上生长的病原真菌Y1菌饼,将菌饼放置于新鲜的PDA平板中央,分别置于不同的培养温度:10 ℃、15 ℃、 20 ℃、25 ℃、28 ℃、30 ℃、35 ℃,每个处理3次重复,每隔24 h记录菌落直径,分析温度对病原菌菌丝体生长的影响。
1.7.2 不同pH对菌丝体生长的影响 PDA平板培养、25 ℃条件下,分别设置培养基的pH为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,参照 “1.7.1”的处理方法,每隔24 h记录菌落直径,分析pH对病原菌Y1菌丝体生长的影响。
1.7.3 不同碳源对菌丝体生长的影响 25 ℃、pH 6.5条件下,以察氏培养基为基础培养基,分别添加不同碳源:乳糖、蔗糖、葡萄糖、甘露醇、麦芽糖,参照“1.7.1”的处理方法,每隔24 h记录菌落直径,分析碳源对病原菌Y1菌丝体生长的 影响。
2 结果与分析
2.1 病原菌的分离与致病性检测
羊肚菌霉菌性枯萎病主要发生在羊肚菌子囊果的菌盖上,病斑表面有白色绒毛状菌丝,最终引起患病部位的枯萎、腐烂和子实体畸形(图1-A)。从采集点患病羊肚菌中共分离出6株真菌,编号为Y1~Y6,用于致病性测定。
将分离物在羊肚菌子囊果菌盖上进行回接,检测其致病性,塑料大棚内空气温度20 ℃,相对湿度60%左右。结果显示,Y1、Y2、Y3、Y 6四株真菌在回接第3天出现相同病症即肉眼可见的白色病斑,而后病斑逐渐扩大(图1-B、1-C、1-D),与田间病原菌为害的症状相同,回接患病率100%,无菌水回接的空白对照伤口处未见为害症状(图1-E)。从病患处再次挑取白色菌丝进行分离培养、纯化,获得的二次分离物与回接菌株的菌落形态一致,证实菌株Y1、Y2、Y3、Y6是羊肚菌霉菌性枯萎病的病原真菌。

A.羊肚菌田间患病症状; B-D.致病菌孢子创伤侵染后第3、4和6天的发病症状; E.无菌水对照创伤侵染后第6天的症状A.Naturally infected morel in the field; B-D.Symptoms observed in 3, 4 and 6 days after wound-inoculation of healthy morels with fungal suspensions;E.Symptoms observed 6 days after wound-inoculation with sterile water图1 羊肚菌霉菌性枯萎病的田间症状及病原菌致病性检测Fig.1 Pileus rot disease of Morchella importuna and pathogenicity detection of isolate
2.2 病原菌的形态学鉴定
4株病原真菌的菌体形态一致,PDA平板 25 ℃培养6 d后菌落直径达30 mm左右,菌体生长较慢(图2-A、2-B)。菌落呈白色绒毛状、较致密,微凸起,不分泌色素。显微镜(40×)观察分生孢子无色透明、长棒状、有1个分隔,大小(3~5)μm×(19~25)μm(图2-C);菌丝为透明、有分隔、直径约2~4 μm(图2-D),与文献[7]描述的一致,初步鉴定为孢卵单隔孢霉(D.longispora)。
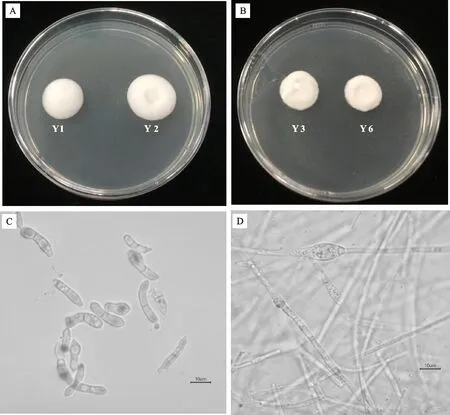
A、B.病原菌在PDA培养基25 ℃生长6 d的菌落形态 ;C.分生孢子;D.厚垣孢子和菌丝A,B.Colony of pathogenic isolate grown on PDA at 25 ℃ for 6 days;C.Conidia;D.Chamydospores and hyphae图2 病原菌的菌落、菌丝和孢子形态Fig.2 Morphological characteristics of colonies, hyphae and conidia of isolate
2.3 病原菌的分子生物学鉴定
菌株Y1、Y2、Y3和Y6的PCR扩增ITS序列大小分别为550 bp、545 bp、552 bp和556 bp,将序列提交至GenBank(登录号分别为MW922714、MW922715、MW922716、MW922 717),BLAST序列比对结果显示,菌株Y1的ITS序列与D.longispora(KX223838)序列相似性分别为99.42%,菌株Y2、Y3和Y6与D.longispora(MH882725)序列相似性均为 99.8%。基于ITS序列构建系统发育树,结果显示(图3),菌株Y1、Y2、Y3和Y6与D.longispora和P.penicillatus在自举值99%水平上聚在同一个进化分支。在NCBI网站上长孢卵单隔孢霉和拟青霉属的ITS序列非常相似,因此要结合菌体形态特征进行综合分析,长孢卵单隔孢霉的分生孢子有横隔,而拟青霉属的分生孢子没有横隔,因此将菌株Y1、Y2、Y3和Y6鉴定为D.longispora[13]。

比例尺表示遗传距离。 节点上主要谱系的1 000次重复的bootrap值以百分比表示The scale bar indicates genetic distance.Bootsrap values in 1 000 replicates for major lineages at the nodes are shown as percentages图3 基于菌株Y1、Y2、Y3和Y6的rDNA ITS序列构建系统发育树Fig.3 Neighbor-joining pgylogenetic tree based on rDNA ITS sequences of Y1, Y2, Y3 and Y6 strain
2.4 病原菌的生物学特性
2.4.1 不同温度对菌体生长的影响 病原菌Y1在15~25 ℃内可正常生长,但不同温度对菌株生长具有显著影响,在培养温度25 ℃时,尽管生长速率较慢,菌体长势最好;当温度为10 ℃或高于28 ℃时,菌体生长受限,温度为30 ℃时菌体停止生长(图4)。
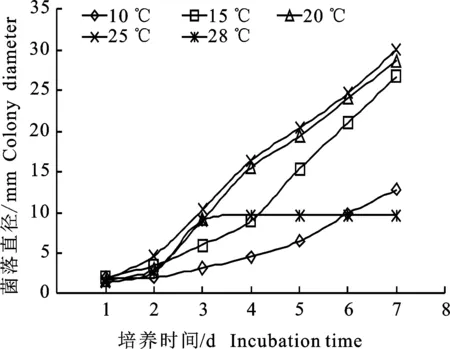
图4 不同温度对菌株Y1的生长Fig.4 Growth of strain Y1 under treatment of different temperatures
2.4.2 不同pH对菌体生长的影响 不同pH培养条件下病原菌Y1生长情况具有显著性差异,菌株在偏酸性条件下生长较好,当培养基pH小于6.5时,培养至第7天和第10 天,菌落直径分别大于36.17 mm和40.17 mm,菌株的长势较好,因此在培养该病原菌时,培养基pH可设置为5.5~6.5。此外,还发现该病原菌在碱性培养条件下具有一定的耐受能力,当pH 9时仍能生长(表1)。
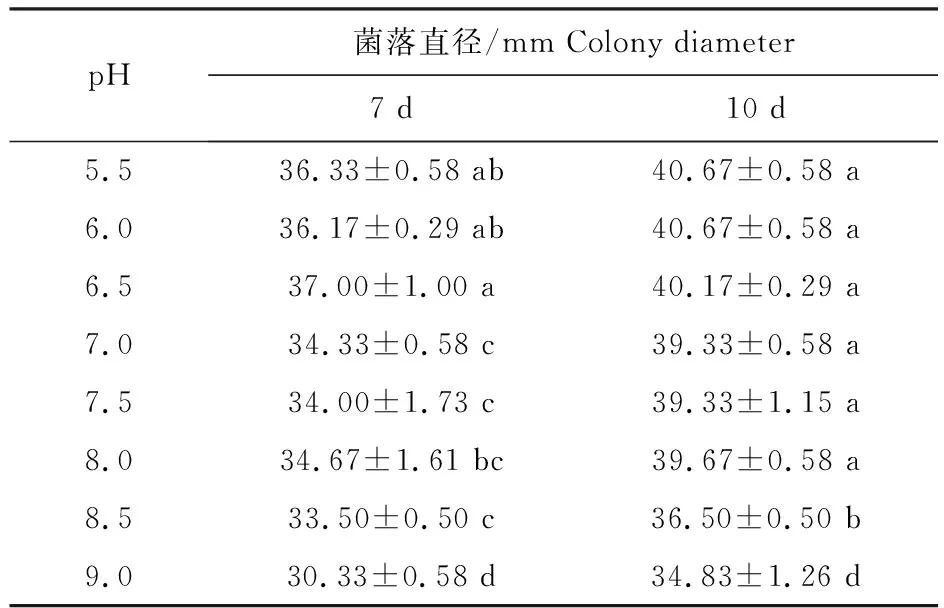
表1 不同pH培养条件下菌体Y1生长Table 1 Growth of strain Y1 under different pH
2.4.3 不同碳源对菌体生长的影响 不同碳源培养条件下病原菌Y1生长情况具有显著性差异,以蔗糖为碳源时菌体生长最快,生长速度为2.89 mm/d;其次为乳糖作为碳源,菌体生长速度为2.63 mm/d;麦芽糖为碳源时,菌体生长最慢2.30 mm/d,因此在菌株培养时应添加蔗糖为主要碳源(图5)。
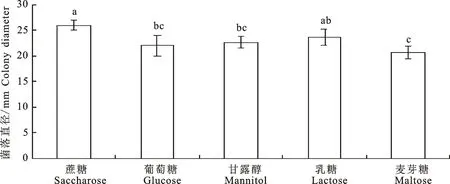
不同小写字母代表Duncan’s分析结果,不同处理间的差异显著(P<0.05)Different lowercase letters in the figure indicate significant differences at the level of P<0.05 after Duncan’s multiple range method test图5 不同碳源下菌株Y1的生长Fig.5 Growth of strain Y1 under different carbon sources
3 讨论与结论
目前,有报道羊肚菌霉菌性枯萎病的病原菌为长孢卵单隔孢霉(D.longispora)[7],另有研究显示羊肚菌白霉病与霉菌性枯萎病非常相似,其病原菌为拟青霉属真菌(P.penicillatus)[8,14],此后又报道了田间症状非常相似的羊肚菌白腐病,该病原菌被鉴定为曲霉属真菌(Aspergillussp.)[15]。尽管这几种病害的田间症状极为相似,但是分离鉴定的病原菌却不同,这为明确羊肚菌子实体菌盖上的真菌病原带来一定困难。
采用分子生物学手段,基于18Sr DNA、ITS、β-微管蛋白(TUB)、延伸因子(TEF)等保守区域进行PCR扩增,可用于真菌的分类鉴定[16-17],但是由于D.longispora和P.penicillatus两种菌株的ITS序列非常相似,必须结合菌体形态特征加以区分。
目前关于P.Penicillatus的系统分类存在争议,早期认为拟青霉属半知菌亚门、丝孢科或丛梗孢科,后来《真菌鉴定手册》把拟青霉属归为真子囊亚纲曲霉科,拟青霉属主要是基于产孢结构特征进行分类鉴定,其中最主要的一个判定依据是其具有分生孢子梗、瓶梗着生于营养菌丝或分生孢子梗上、分生孢子无横隔[18-19]。这一产孢特征与D.longispora明显不同。
有关双孢菌属Diploospora的相关研究并不多,最早在羊皮纸上发现了D.rosea并将其定义为该属的模式种,在后续的研究中又发现了与其菌丝和孢子形态非常相似的菌种D.longispora,D.indica,D.fungicola,D.coprophila,D.zinnia,其分生孢子呈柱形或纺锤形,可呈链状排列,大部分分生孢子含有1~3个横隔。尽管ITS序列极为相似,但D.longispora与P.penicillatus的产孢过程和孢子形态显著区别,可以作为区分两种菌的主要依据[9,20-21]。
本研究分离得到了羊肚菌菌盖上的4株病原真菌,经ITS序列比对和菌体形态分析,最终确定是引起羊肚菌霉菌性枯萎病的D.longispora,与 He等[7]的研究结果一致。研究病原菌的生物学特性不仅有助于了解病原菌的生长偏好,还能为揭示病原菌的发生规律提供理论参考。本研究显示,D.longispora的最适生长温度为25 ℃;菌株在偏酸性条件下生长较好,pH 5.5~6.5为最佳,并在碱性条件下具有一定的耐受能力;最佳利用碳源为蔗糖。
羊肚菌具有极高的营养保健和药用价值,近年来人工栽培规模逐渐扩大,产业发展迅速,随之而发生的病虫害也逐渐加重,明确病原菌及其发生规律对于羊肚菌的健康栽培至关重要[22]。本研究结果明确了羊肚菌霉菌性枯萎病的病原菌是D.longispora,对其生物学特性进行分析,为今后开展病害的发生规律研究、制定有效防治方案具有重要的指导意义。

