1-MCP结合低温通过调控脆性、叶绿素降解缓解叶类蔬菜采后衰老
李雪瑞,李 宏,冯艳芳,普红梅,杨 芳,金鹏程,王海丹,于丽娟
(1.云南省农业科学院 农产品加工研究所,昆明 650205;2.云南农业大学 热带作物学院,云南普洱 665000)
叶菜是以菜叶和叶柄为食用部分的蔬菜,含有富碳水化合物、维生素和无机盐等营养成分,是种植面积最广、品种最多、消费量最大的一类蔬菜。但因该类蔬菜具有叶表面积大、含水量高、组织脆嫩等特点,采后水分蒸发快,易受机械损伤,呼吸作用旺盛,细胞膜被破坏,影响了其采后电导率、MDA值的变化,同时组织的伤愈合产生萎蔫、软化[1],影响叶菜的脆度及其β-GAL酶活性,通过影响脱镁叶绿素酶(PPH)酶含量、叶绿素酶(CLH)酶含量影响叶绿素的降解[2],导致叶菜褐变、黄化,这3个问题使得叶菜成为生鲜农产品中最难保鲜的一类产品[3]。因此,采取有针对性的采后贮藏保鲜技术对降低采后损失和提高质量都具有重要意义。
生菜(lettuce)即叶用莴苣,菊科,莴苣属,1~2 a生草本,绿叶菜类蔬菜,以叶球或叶片供食用,宜生食,故称生菜。生菜营养丰富,是一种低热量、高营养的蔬菜。生菜采收后,由于旺盛的呼吸作用和蒸腾作用,易失水、萎蔫、褐变,同时由于生菜极富脆性且含水量高,在收获、运输及存储过程中,易受损伤,更加速其品质的下降[4]。对于生菜保鲜的研究一直以来都很多,余江涛等人对生菜保鲜方法进行了综述,有物理保鲜方法(真空预冷保鲜、包装膜及气调保鲜、低温保鲜、热处理、光照、辐照、高压保鲜),化学保鲜(消毒剂清洗、化学保鲜剂),生物保鲜(生物杀菌剂、天然提取物)等[5],叶类蔬菜保鲜也大体都是这些技术[6-7]。姜文利等[8]研究了低温加湿保鲜对生菜贮藏品质的影响,有研究者研究了不同包装材料对生菜采后生理及保鲜效果的影响[9-10]。瓢儿菜由芸薹进化而来,被称为“维他命”菜,常吃可以预防便秘,增强人体防病抗病的能力,但在贮藏销售过程中易受温度、微生物等影响发生黄化萎蔫、腐烂,是采后损失较严重的叶菜之一[11]。谢晶等[12]建立了以时间、温度和品质指标值为变量的瓢儿菜货架期预测方程,拟定不同的品质终点值能得到对应的货架期,测定了在 5、10、15和20 ℃ 4个温度下贮藏的瓢儿菜的还原型抗坏血酸、叶绿素、颜色参数 L*(亮度)、b*(黄度)、△E(色差)和感官评价,具体的保鲜方法研究较少。高建晓等[13]研究了6-苄氨基嘌呤处理对瓢儿菜贮藏品质的影响。曾顺德等[14]研究了4 ℃冷藏下普通PE袋、4孔OPP自粘袋、微孔气调保鲜袋对瓢儿菜保鲜效果的影响。但保鲜方法对叶菜的作用机制还不得而知。
温度是果蔬贮藏保鲜中极为关键的一个因素。适宜的低温可以抑制采后病原菌的繁殖和生长[15]。果蔬低温贮藏技术是通过降低温度来抑制果蔬呼吸,延缓生命活动,达到保鲜的效果[16]。同时,乙烯是促进成熟的重要激素,而1-甲基环丙烯(1-MCP,1-Methylcyclopropene)可以阻断乙烯的合成,降低其呼吸速率,达到缓解成熟与衰老的效果,从而延长其产品保鲜期与货架期[17]。目前,有关1-MCP应用于果蔬保鲜的研究报道日益增多。研究表明,1-MCP处理常与低温、气调及其他保鲜剂等联合使用,在果蔬贮藏过程中取得了明显的效果[17-18]。前人研究结果表明:1-MCP能保持叶类蔬菜较高的叶绿素和Vc含量,延缓衰老进程[19]。因此,本试验在研究叶类蔬菜保鲜效果的基础上,探究低温(4 ℃)条件下,不同浓度1-MCP处理对叶类蔬菜采后品质的影响及酶活变化,为进一步利用采后处理技术延长叶类蔬菜贮藏期提供理论依据。
1 材料与方法
1.1 材料与仪器
原材料:生菜(意大利生菜)和瓢儿菜(瓢儿菜),2种带根活体叶类蔬菜,购于云南省农业科学院农产品加工研究所农产品展示平台;剔除有机械损伤、病虫害的个体,选择大小一致的个体常温放置;定期取样测定相关指标。
试剂:1-MCP (1-甲基环丙烯)(≥4.0%,上海麦克林生化科技有限公司);2-硫代巴比妥酸(上海展云化工有限公司);丙酮(分析纯,四川西陇科学有限公司)。
仪器:MULTISKAN GO酶标仪(赛默飞世尔科技有限公司);5424R离心机(德国Eppendorf公司);TMS-TOUCH质构仪 (美国FTC公司);BSA223S电子分析天平(德国Sartorius公司);DK-98-Ⅱ电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 试验方法
1.2.1 保鲜处理 将生菜和瓢儿菜两种叶类蔬菜分别置于4、6 μL/L的1-MCP环境中密闭熏蒸24 h,将样品取出后用保鲜袋包装,不束口,分别置于常温及4 ℃条件下贮藏。贮藏期间定期取样,测定相关指标含量变化。
1.2.2 失水率的测定 取样后测定样品初始质量,之后分别贮藏24、48 h后测定样品质量,按下式计算失水率。
失水率=(m0-m)/m0×100%
式中:m0为样品贮藏前的质量(g),m为样品贮藏后的质量(g)。
1.2.3 相对电导率的测定 用打孔器将样品制成厚薄均匀,大小一致的组织圆片,精确称取 2 g放在盛有20 mL蒸馏水的烧杯中,振荡后浸泡 1 h,测定提取液电导率C1;测定后煮沸5 min,冷却后加蒸馏水补充至20 mL,测定电导率C0;按下式计算相对电导率。
Le=C1/C0×100%
1.2.4 MDA的测定 称取样品2 g,加入三氯乙酸5 mL,冰浴研磨、离心,取上清即为 MDA提取液。取2 mL MDA提取液,加2 mL 2%硫代巴比妥酸,混匀后放置于100 ℃水浴中保温30 min,静置冷却后于波长 450、532和 600 nm下测定吸光值。按下式计算MDA的质量摩尔浓度。
C=6.45×(A532-A600)-0.56×A450
1.2.5 脆性测定 利用质构仪以单刀剪切模式测定两种叶菜脆性。测量最大剪切力(N)和最大位移(mm),用曲线斜率表示其脆性,即斜率(脆性)=最大剪切力/最大位移,斜率越大,说明样品的硬度或脆性越大,反之则越小。测定参数设置为0.1 N的起始力,40 mm/s的测试速度, 10 mm的回程距离。
1.2.6 叶绿素含量的测定 取0.5 g样品,用提取液(丙酮∶乙醇体积比为2∶1)研磨、过滤、定容至25 mL。以提取液为对照,测定 663、645 nm处的吸光值。按下式计算叶绿素含量(mg/g)。
叶绿素总含量=(20.20×A645+8.02×A663)×V/(100×W)
式中:V为提取液体积,W为样品鲜质量。
1.2.7 β-半乳糖苷酶(β-GAL)酶活性,叶绿素酶(CLH)及脱镁叶绿素酶(PPH)酶含量的测定 取0.1 g生菜及瓢儿菜组织鲜样,加入提取液冰浴研磨,高速离心后取上清液分别采用β-GAL酶活性测定试剂盒(苏州科铭生物技术有限公司),CLH酶含量测定试剂盒(上海酶联生物科技有限公司)及PPH酶含量测定试剂盒(上海酶联生物科技有限公司),参照试剂盒说明书测定各酶的活性。测定400 nm处的吸光度值,以每克组织每分钟产生1 nmol对-硝基苯酚定义为1个β-GAL酶活性单位。在450 nm波长下分别测定吸光度值,根据标准曲线y=0.008 6x+0.053 2(R2=0.998 8;其中,x均为浓度,y均为吸光度值)计算样品中植物CLH酶含量,根据标曲y= 0.019 9x+0.245 9(R2=0.999 4;其中x为浓度,y为吸光度值)计算PPH酶活含量。
1.2.8 数据分析 采用Excel 2010软件处理数据,SPSS20.0软件进行标准差及差异显著性分析(当P<0.05时,认为差异显著),Origin 2018软件作图。
2 结果与分析
2.1 4 ℃+1-MCP对2种叶菜失水率的影响
水分是保持果蔬新鲜的重要因素,新鲜生菜中水分含量很高,一般在90%~95%[20],瓢儿菜叶片肥厚,常温储藏3~4 d就会黄化萎蔫[14]。伴随着呼吸作用和蒸腾作用,果蔬采后水分不断散失,重量不断下降,且切割之后叶片受到损伤,更容易失水,外在表现为萎蔫、皱缩、质量下降。由图1可以看出,常温条件下两种叶类蔬菜均快速失水,贮藏4 d后样品严重萎蔫,失水率分别高达40.03%、38.05%,而4 ℃和不同浓度 1-MCP+4 ℃处理均能有效缓解叶菜失水现象,具有较好的保鲜效果。其中,4 ℃和不同浓度1-MCP+ 4 ℃处理生菜保鲜效果差异不明显,而6 μL/L 1-MCP+4 ℃处理瓢儿菜能更有效地缓解水分散失。6 μL/L 1-MCP+4 ℃处理条件下,贮藏12 d后,两种叶菜失水率分别为15.74%、 11.81%。曾顺德研究显示瓢儿菜在微孔气调包装袋中于 4 ℃下贮藏,至第9 d时,其失水率达到16%[14],但6 μL/L 1-MCP+4 ℃处理瓢儿菜至第8天时,失水率仅为6.48%。从上可以看出,6 μL/L 1-MCP+4 ℃处理确实能有效缓解叶菜水分散失。

不同小写字母的柱值表示各处理的平均值(n=3)在P<0.05水平上差异显著,下同。Values on columns followed by different lowercase letters indicate averages(n=3) of different treatments at level of P<0.05,the same below.图1 2种叶菜在贮藏过程中的失水情况Fig.1 Water loss rate in two kinds of leafy vegetables during storage
2.2 4 ℃+1-MCP对2种叶菜膜透性的影响
电导率的大小可以反映细胞膜的完整性和果实的衰老程度。由图2-A可以看出,贮藏过程中,两种叶类蔬菜的电导率均随贮藏时间延长呈上升趋势;但与对照相比,4 ℃和不同浓度 1-MCP+4 ℃复合处理能够显著缓解电导率的升高。其中,6 μL/L 1-MCP+4 ℃复合处理,两种叶菜电导率上升速率最慢,至第12天,分别上升至 17.41%、16.01%,对于缓解电导率上升、细胞膜透性增加均具有最佳效果。
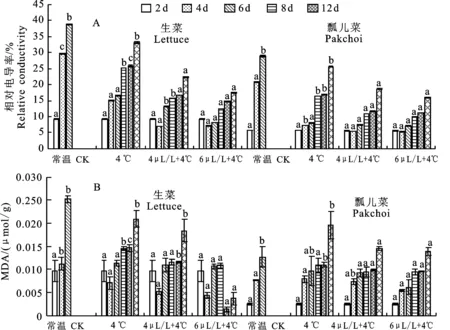
图2 2种叶菜在贮藏过程中电导率、丙二醛的变化Fig.2 Electrical conductivity and MDA in two kinds of leafy vegetable during storag
MDA含量作为判断衰老程度的指标之一[21]。由图2-B可以看出,在两种叶类蔬菜中,常温对照组的MDA明显积累,贮藏4 d时,两种叶菜的MDA分别上升至0.025、0.013 μmol/g,而经4 ℃或不同浓度1-MCP+4 ℃复合处理的样品中MDA增加相对缓慢,该现象表明4 ℃或不同浓度1-MCP+4 ℃复合处理可以抑制MDA的积累,与电导率的变化规律相似。6 μL/L 1-MCP+4 ℃复合处理对于缓解两种叶类蔬菜MDA上升均具有最佳效果。贮藏12 d后,两种叶菜MDA分别为0.0037、0.0139 μmol/g,保鲜效果最佳。
2.3 4 ℃+1-MCP对2种叶菜β-半乳糖苷酶(β-GAL)酶活性和脆性的影响
β-半乳糖苷酶(β-GAL)是细胞壁降解的关键酶之一,其可催化果胶聚合体降解,破坏细胞壁结构,从而使果实软化,而软化是果蔬衰老的重要表现之一。由图3可以看出,脆性与β-GAL酶活性呈负相关关系,β-GAL酶活性越大,叶菜细胞衰老、软化的速度随之增快,脆性便随之减弱。由图3-A可以看出,常温贮藏下,2种叶类蔬菜β-GAL的酶活性上升速度非常快,在贮藏第4 d时,分别上升至22.85、30.91 nmol/(min·g),上升了约2倍。而4 ℃及不同浓度1-MCP+4 ℃处理过的样品组β-GAL酶活性上升速度都相对较慢,其中6 μL/L 1-MCP+4 ℃上升速度最慢,贮藏至第12天时,2种叶菜β-GAL酶活性分别为15.01、 19.53 nmol/(min·g),分别上升了41.86%、 12.74%。由图3-B可以看出,常温条件下,2种叶菜的脆性下降最快,至第4天,下降了 82.89%、 80.12%。4 ℃及不同浓度1-MCP+ 4 ℃处理可以较好地保持两种叶菜的脆性,减缓其衰老的速度。这与缓解电导率上升、MDA积累的作用类似。6 μL/L 1-MCP+4 ℃低温复合处理在保持两种叶类蔬菜脆性中的效果最佳, 12 d后,2种叶菜的脆度分别降低14.48%、 28.12%,4 μL/L 1-MCP+4 ℃处理则降低 47.60%、 40.55%。

图3 贮藏过程中2种叶菜β-半乳糖苷酶酶活性和脆性的变化Fig.3 β-GAL enzyme activity and brittleness in two varieties of leafy vegetable during storage
2.4 叶绿素含量的变化
叶绿素降解是植物叶片衰老最明显的标志[22]。由图4可以看出,常温条件下,两种叶类蔬菜的叶绿素降解速率较快,贮藏至第4天时,分别降至0.3、0.32 mg/g,降低65.76%、 72.37%。而4 ℃及不同浓度1-MCP+4 ℃复合处理叶绿素降解均相对缓慢,贮藏12 d时,4 μL/L 1-MCP+4 ℃处理后叶菜的叶绿素则分别降低32.71%、35.55%,而6 μL/L 1-MCP+ 4 ℃复合处理后2种叶菜叶绿素含量分别为 0.68、0.82 mg/kg,各自降低23.45%、30.13%,由此可见,6 μL/L 1-MCP+4 ℃复合处理保鲜效果最佳。
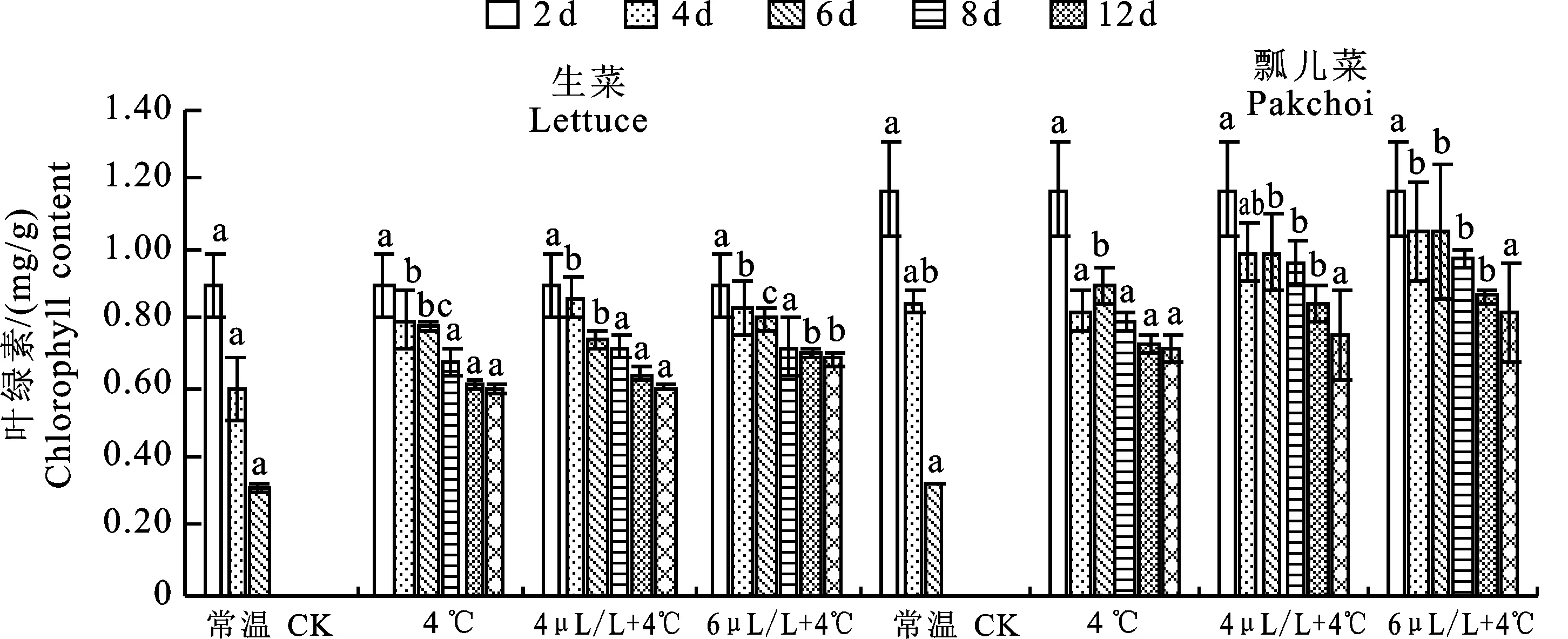
图4 2种叶菜贮藏过程中叶绿素含量的变化Fig.4 Chlorophyll content in two kinds of leafy vegetables during storage
2.5 CLH、PPH酶含量的变化
绿叶蔬菜采后失绿直接影响产品感官品质和货架寿命。相关研究表明,CLH酶和PPH酶是叶绿素降解途径中的关键酶[23-24]。由图5可以看出,随着贮藏时间的延长,2种叶菜中CLH、PPH酶含量都有所降低。CLH酶活变化,生菜常温贮藏4 d后降至526.79 ng/g,降低55.99%,而6 μL/L 1-MCP+4 ℃复合处理后其CLH酶含量降低得却很慢,至第12天,降至690.30 ng/g,降低42.33%;瓢儿菜常温贮藏4 d后降至 600.61 ng/g,降低53.03%,其他经各处理后第12天,其CLH酶活分别降至600.75、633.62、 704.19 ng/g,分别降低53.02%、50.45%、 44.93%,由此可见6 μL/L 1-MCP+4 ℃复合处理能缓解其CLH酶的降解。PPH酶活变化,生菜常温贮藏 4 d后,其PPH酶活降至0.06 nmol/g,降低 74.50%,其他各处理12 d时分别降低73.27%、72.05%、67.11%;瓢儿菜常温贮藏4 d后,其PPH酶活降低52.04%,12 d时,各处理后其酶活分别降至0.08、0.09、0.10 nmol/g,降低 59.16%、55.22%、51.49%,依旧是6 μL/L 1-MCP+4 ℃复合处理其CLH酶降低最少,这表明1-MCP可以调节叶绿素降解途径相关酶表达水平,从而延缓叶绿素降解[25],且对于生菜和瓢儿菜来说,6 μL/L 1-MCP比4 μL/L 1-MCP的效果要好。

图5 2种叶菜贮藏过程中叶绿素酶(CLH)、脱镁叶绿素酶(PPH)含量的变化Fig.5 CLH and PPH enzyme content in two kinds of leafy vegetables during storage
3 结论与讨论
保鲜处理后,在常温和低温条件下,两个品种叶类蔬菜失水率、电导率、MDA含量均呈现上升趋势,1-MCP结合低温冷藏处理可以延缓电导率和MDA等含量增加的时间和速率,这刚好与李剑峰等[26]研究一致。β-半乳糖苷酶酶活性随贮藏时间增加,脆性则不断下降,这一现象表明β-GAL酶活性越大,叶菜细胞衰老、软化的速度随之增快,脆性便随之减弱,且1-MCP结合低温处理可以有效抑制β-GAL酶活性,进而延缓果蔬软化的速度[27]。王森等[28]研究证实,1-MCP处理可以明显减缓果蔬贮藏中硬度与脆度的下降,对延长果蔬货架期具有积极作用,本试验结果与前人研究相吻合,且1-MCP 可减缓果蔬脆度下降有可能与它能抑制β-GAL酶活性增加有关。叶绿素含量、CLH酶、PPH酶含量等随着贮藏时间的延长均呈不同的下降,这表明1-MCP+4 ℃复合处理可以调节叶绿素降解途径中相关酶的含量及表达水平来延缓叶绿素降解,从而在叶类蔬菜上具有较好的保鲜效果。这与前面失水率、脆性等品质正好对应,焦莉等[29]的研究发现,生菜采后使用包装水分散失减少,所以其叶绿素降解得也相对较缓慢,这在本研究结果中也被证实,6 μL/L 1-MCP+4 ℃复合处理后其失水率最低,叶绿素降解得也最缓慢。也有研究者在探究5 ℃低温储藏瓢儿菜时推测叶绿素主要因为脱镁反应而降解,低温抑制了该反应[12,30]。曾顺德等的研究表明微孔气调保鲜袋包装瓢儿菜贮藏9 d后,其SPAD值相比散装对照低10.83%[14],6 μL/L 1-MCP+4 ℃处理在抑制瓢儿菜采后黄化方面仍然显示出其优势,同时这为后面将气调包装与1-MCP、低温结合保鲜瓢儿菜提供了思路,也为其作用机制分析做了铺垫。蔬菜在采后贮藏过程中叶绿素合成作用停止,但代谢作用仍然旺盛,随着贮藏时间延长,叶绿素因受CLH酶和PPH酶主导的代谢途径的影响逐渐被分解,绿色消退并逐渐黄化。CLH和PPH是脱去叶绿素a的植醇,是叶绿素降解途径中的2个关键酶,能够特异性水解脱镁叶绿素a生成脱镁叶绿酸a,其表达水平与衰老程度呈正相关[31]。田雪婷等[25]探讨了1-MCP处理对采后“澳洲青苹”苹果叶绿素降解的影响,发现1-MCP能够延缓果皮黄化,这与本实验结果一致,其认为可能是1-MCP抑制了叶绿素a,b的降解,并减少果实中脱镁叶绿素a与脱镁叶绿酸a含量的积累,从而达到延缓黄化的效果,1-MCP抑制叶菜叶绿素降解的具体原因需要进一步的探究。未来的研究也将集中于探究影响β-GAL酶、CLH酶、PPH酶的基因,为1-MCP+4 ℃方法保鲜叶菜提供理论依据。

