BET蛋白抑制剂JQ⁃1对系统性红斑狼疮患者外周血B细胞分化的调控作用
李昊 曾珊 邱茜 肖游君 徐思琪 王竞男 石茂华 许韩师 梁柳琴
中山大学附属第一医院风湿免疫科(广州 510080)
系统性红斑狼疮(SLE)是一种累及多系统、多器官的异质性自身免疫性疾病,以自身反应性B淋巴细胞多克隆增殖活化及产生大量致病性自身抗体为特点[1]。体内B 细胞的平衡被破坏,是SLE疾病活动的特点,包括幼稚B 细胞减少、IgD/CD27双阴性细胞增加、记忆性B 细胞增加及浆母细胞及浆细胞增加[2]。目前有多种以B 细胞为靶向的治疗策略,如清除B 细胞及浆细胞(如利妥昔单抗)[3]、选择性清除活性B 细胞(贝利尤单抗)[4]、阻断病致病性抗体[abetimus(LJP⁃394)][5]及阻止B细胞活化等(抗IFN[6]、抗IL⁃6[7])。这些治疗策略的有效性提示B 细胞是SLE 的重要治疗靶细胞。
BET(bromodomain and extraterminal)家族蛋白是包含溴区蛋白(bromodomain⁃containing proteins,BRD)的一类,包括BRD2、BRD3、BRD4 和BRDT 四个成员,作为表观遗传阅读器,参与调控多种免疫反应相关基因的表达。BET 家族成员的异常,往往导致生理及病理过程的失调,在免疫及炎症性疾病中具有重要的致病作用。因而以其为治疗靶点,可调控免疫系统的稳态,进而可能在免疫相关性疾病中发挥治疗作用[8]。BRD4 作为研究最为广泛的BET 蛋白,调节不同的生物过程,包括细胞周期[9]、炎症[10-11]、维持高级染色质结构[12]和DNA损伤信号[13],在多种刺激下于多种固有免疫细胞及非免疫细胞中表达升高,主要通过激活多种免疫和炎症基因转录发挥促炎作用,进而促进自身免疫性疾病的发生发展[14-15]。笔者既往的研究证实BRD4 参与调控SLE 外周血浆细胞分化过程,抑制剂PFI⁃1 在狼疮肾炎模型中具有重要的治疗作用[16],但第一代合成的BET 抑制剂JQ1,以模拟乙酰化赖氨酸部分与BET 蛋白家族成员的溴结构域结合发挥抑制BET 蛋白尤其是BRD4 蛋白活性的作用[10,17],目前尚未见其对SLE作用的文献报道。
本研究拟探讨BRD4 蛋白在SLE 外周血B 细胞分化中的作用,拟进一步明确BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞功能的调控作用。
1 材料与方法
1.1 样本来源 本研究使用的46 例SLE 患者外周血标本来源于中山大学附属第一医院。患者纳入标准:(1)女性,年龄19~38 岁;(2)符合1997年修订的美国风湿病学会(American College of Rheuma⁃tology,ACR)SLE 分类标准;(3)初发未经激素和/或免疫抑制剂治疗,或病情稳定小量激素维持治疗的患者即经SLE 疾病活动性指数(SLE disease activity index,SLEDAI[18])⁃2000 评估为基本无活动或低度活动的患者。排除标准:(1)经SLE 疾病活动性指数(SLE disease activity index,SLEDAI[18])⁃2000 评估为中度或高度活动的患者;(2)存在其他自身免疫病,心、肝、血液及肿瘤疾病,感染性疾病及其他代谢疾病;(3)妊娠期、哺乳期妇女。实验符合1975年赫尔辛基宣言(The Declaration of Helsinki)的相关规定,并得到中山大学附属第一医院伦理委员会及提供标本的医院伦理委员会的批准。患者诊断明确,符合各项纳入标准,并无排除标准各项情况,自愿同意,签署知情同意书后纳入本项研究,经肘部静脉采血收集其外周静脉血标本于肝素抗凝管中。
本研究纳入的健康志愿者(HC)为中山大学附属第一医院的健康志愿者,其性别、年龄均与纳入的SLE 患者匹配,所有参与志愿者均已签署知情同意书,并得到中山大学附属第一医院伦理委员会及提供标本的医院伦理委员会的批准。
1.2 方法
1.2.1 SLE 外周血PBMC 的提取 采取密度梯度离心(Ficoll⁃Paque)法分离外周血单个核细胞。取SLE 患者外周静脉血15~20 mL,PBS(Gibco,美国)稀释,加入淋巴细胞分离液(GE Healthcare,瑞典)离心,收集白色窄带层于离心管中,PBS 洗涤2 次,用RMPI⁃1640 培养基(Gibco,美国)将细胞重悬并定容。
1.2.2 人外周血CD19+B 淋巴细胞磁珠分选纯化(阴选) 根据Human B Lymphocyte Enrichment Set⁃DM(BD,美国)说明书操作,使用BD IMagTMbuffer(BD,美国)重悬细胞,加入Biotinylated Human B Lymphocyte Enrichment Cocktail(BD,美国),室温孵育15 min,用10 倍体积的BD IMagTMbuffer 洗涤,加入BD IMagTMStreptavidin Particles Plus⁃DM(BD,美国),室温孵育30 min,过磁力架6 ~ 8 min,吸取上清(enriched fraction)放入新的流式管,加入1 mL BD IMagTMbuffer 重悬positive⁃fraction,重新置于磁力架6 ~ 8 min,吸取上清,与enriched fraction 合并,将combined enriched fraction 再过一遍磁力架6 ~ 8 min,吸取上清,放入新的流式管中,为twice⁃enriched fraction,用于后续实验。
1.2.3 SLE B 细胞体外培养实验 将分离纯化的B 细胞悬液(1 × 106/mL)以2 × 105/200 μL/孔接种于96 孔平底细胞培养板中,按实验分组在培养体系中加入(co⁃stimulate)或不加入(nil)Goat anti⁃IgM F(ab′)fragment(Jackson,美 国)(5 μg/mL)、Monoclonal mouse anti⁃CD40L(RD,美 国)(1 μg/mL)、CpG ODN2006(Invivogen,美国)(5 μmol/L)、Recombinant Human IL⁃4(Pepro Tech,美国)(40 ng/mL),Recombinant Human IL⁃2(Pepro Tech,美国)(10 ng/mL)共刺激,按实验分组在co⁃stimulate 培养体系中不加入(control 组)或加入JQ1(300 nmol/L)(JQ1 组)分别培养7 d 后收集细胞备用。
1.2.4 流式细胞术检测细胞凋亡 根据凋亡试剂盒(BD,美国)说明书操作,将B 细胞制备成单细胞悬液,收集于5 mL 流式管中,每个样品加入Annexin V/PI 各50 μL,室温避光孵育15 min,加入200 μL binding buffer 重悬,30 min 内流式细胞仪检测(Cyto FLEX,BD,美国)。
1.2.5 流式细胞术检测细胞增殖 在避光条件下加入CFSE(eBioscience,美国),孵育15 min,终止染色,离心弃上清,保留沉淀,重悬细胞,流式细胞仪检测。
1.2.6 人外周血浆母细胞体外诱导分化 将分离纯化的B 细胞接种于96 孔平底细胞培养板,按实验分组加入或不加入Goat anti⁃IgM F(ab′)fragment(Jackson,美国)(5 μg/mL)、Monoclonal mouse anti⁃CD40L(RD,美国)(1 μg/mL)、CpG ODN2006(Invi⁃vogen,美国)(5 μmol/L)、Recombinant Human IL⁃10(Pepro Tech,美国)(50 ng/mL),Recombinant Hu⁃man IL⁃15(Pepro Tech,美国)(10 ng/mL)共刺激分别培养7 d 后收集细胞备用。
1.2.7 流式细胞术表面分子染色 收集单细胞悬液,PBS 洗涤,根据实验设计分别加入0.5 μL Anti⁃human CD19⁃APC(Biolegend,美国)、Anti⁃human IgD⁃PE⁃Cy7(Biolegend,美国)、Anti⁃human CD27⁃PE(Biolegend,美国)、Anti⁃human CD38⁃FITC(Bioleg⁃end,美国)、Anti⁃human CD138⁃Brilliant Violet510(Biolegend,美国),于4 ℃避光孵育30 min,终止染色,离心弃上清,保留沉淀,重悬细胞,流式细胞仪进行检测。
1.2.8 RT⁃qPCR 总RNA的提取采用Takara Prime⁃Script RT Reagent Kit(Takara Bio,日本),并在LC480系统中完成RT⁃qPCR(Roche,美国)。用2⁃△△CT检测目的基因相对于甘油醛⁃3⁃磷酸脱氢酶(GAPDH)的表达。BRD4 及GAPDH 引物序列见表1。
1.3 统计学方法 所得数据用SPSS 18.0 软件进行统计学分析,计量资料用()表示,两组间计量资料比较使用独立样本t检验,多组之间使用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 BRD4 蛋白在健康对照组(HC)及SLE 患者外周血B 细胞中的表达 利用RT⁃qPCR 对HC 及SLE 患者B 细胞中BRD4 蛋白的mRNA 水平进行检测。结果显示SLE 外周血B 细胞中BRD4 的表达水平显著高于HC 组(图1)。
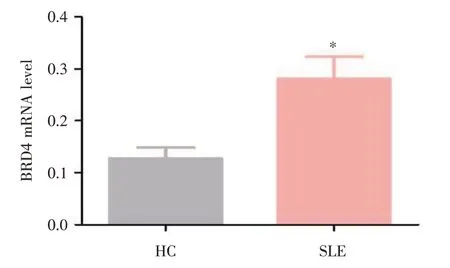
图1 BRD4 蛋白在HC 及SLE 患者外周血B 细胞中的表达Fig.1 Expression of BRD4 in human peripheral B cells of HC and patients with SLE
2.2 BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞凋亡的影响 体外培养SLE 外周血B 细胞,通过Annexin V/PI 染色流式细胞术,检测B 细胞中早期凋亡细胞(Annexin V+PI⁃)的比例。观察到在培养7 d 时与阴性对照组(nil)相比,给予共刺激培养条件下B 细胞的早期凋亡细胞的比例同样明显减少,而加入300 nmol/L JQ1对细胞的凋亡无影响(图2)。提示抑制BRD4 蛋白同样对SLE 外周血活化的B细胞凋亡无影响。

图2 BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞凋亡的影响Fig.2 Effect of JQ⁃1 on the apoptosis of human peripheral activated CD19+B cells
2.3 抑制BRD4 蛋白对SLE 外周血B 细胞增殖的影响 在培养7 d 时与阴性对照组(nil)相比,给予共刺激培养条件下B 细胞的增殖率明显增加,JQ1处理组对细胞的增殖率无影响(图3),提示抑制BRD4 蛋白对SLE 外周血活化的B 细胞增殖同样无影响。
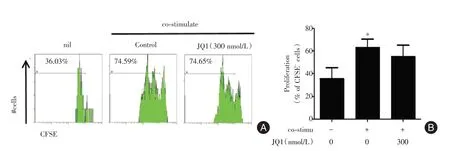
图3 BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞增殖的影响Fig.3 Effect of JQ⁃1 on the proliferation of human peripheral activated CD19+B cells
2.4 BET蛋白抑制剂JQ⁃1对SLE外周血B细胞各亚群分化的影响 体外培养SLE 外周血B 细胞,通过流式细胞术检测B 细胞各亚群细胞(幼稚B 细胞、记忆B 细胞、浆母细胞及浆细胞)的百分比。观察到在培养7 d 时与阴性对照组(nil)相比,给予共刺激培养条件下CD19+IgD+CD27-幼稚B 细胞、CD19+IgD-CD27+记忆B 细胞、CD19+IgD-CD27++浆母细胞、CD19+CD38++CD138+浆细胞亚群的比例均有所升高,而JQ⁃1 组使升高的浆母细胞、浆细胞亚群的比例受到抑制,且显著抑制记忆性B 细胞分化,使幼稚性B 细胞亚群的比例显著增加(图4),提示抑制BRD4 蛋白同样能显著稳定地抑制SLE 外周血浆母细胞途径介导的浆细胞的分化。
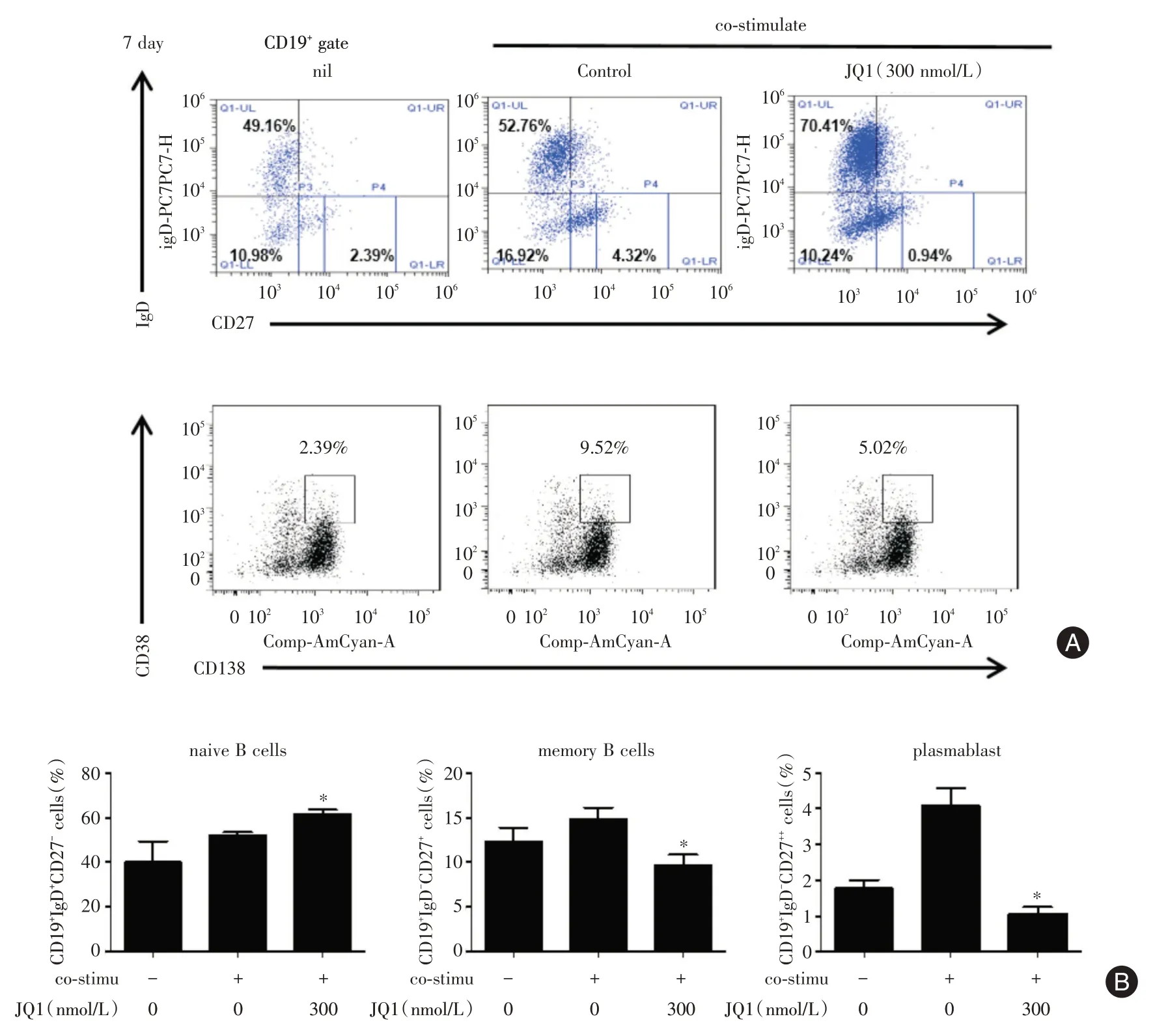
图4 BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞各亚群分化的影响Fig.4 Effect of Brd4 inhibition on the percentages of naïve,memory,plasmablast,and plasma cells in CD19+B cells from patients with SLE
2.5 抑制BRD4 蛋白对SLE 外周血浆细胞分化的影响 为了进一步阐述抑制BRD4 蛋白对SLE 外周血浆细胞分化的研究,利用外周血B 细胞定向诱导分化为大量浆母细胞,通过流式细胞术检测CD19+IgD-CD38hi浆母细胞产生的比例。观察到在培养7 d 时与阴性对照组(nil)相比,加入共刺激培养条件后导致SLE 中CD19+IgD-CD38hi浆母细胞比例大量增加,而JQ1 组使浆母细胞的诱导分化作用受到显著抑制(图5),进一步提示抑制BRD4 蛋白可以显著地抑制SLE 外周血浆母细胞途径介导的浆细胞分化。

图5 BET 蛋白抑制剂JQ⁃1 对SLE 外周血浆细胞分化的影响Fig.5 Effect of JQ⁃1 on differentiation of plasmablasts and plasma cells from SLE patients
3 讨论
系统性红斑狼疮是一个异质性很强的自身免疫性疾病,其免疫耐受被打破,多种因素导致固有免疫和适应性免疫不同程度障碍,导致免疫系统异常激活及大量致病性自身抗体产生[19]。既往曾有文献发现,在SLE 患者妊娠晚期存在外周血淋巴细胞亚群的比例失调,SLEDAI 分数与B 细胞比率具有显著相关性,但与T 淋巴细胞的比率并不具有显著相关性,提示B 细胞在SLE 发病机制中具有独特的重要作用[20];此外亦有研究表明SLE风险等位基因主要在髓系或B 细胞中表达,在B细胞靶向疗法中,尤其是阻断浆细胞分化,可能可使SLE 患者获得长期效益[1]。因此以B 细胞作为靶向细胞是SLE 未来治疗的重要方向。
近年研究发现,抑制BRD4 蛋白已被证实在多种肿瘤的临床前小鼠和异种移植模型中具有显著的抗癌活性[17,21-22]。除了对肿瘤的调控作用,最近发现BRD4蛋白参与调控人和小鼠体内Th17细胞的分化及活化,调节Th17 相关的细胞因子产生[23-24]。这些研究提示BRD4 蛋白很可能参与调控免疫细胞的活化和分化。但关于BRD4 是否参与B 细胞功能的调控目前研究甚少,曾有学者提出BRD2 蛋白促进小鼠B 细胞扩增和有丝分裂[25];笔者曾发现BRD4 蛋白参与调控SLE 患者外周血B 细胞分化,且抑制剂PFI 对狼疮肾炎具有治疗作用[16];这些提示BET 蛋白尤其是BRD4 蛋白可能在B 细胞介导的自身免疫性疾病发病机制中具有重要的作用,但是BET 蛋白抑制剂JQ⁃1 对SLE 外周血B 细胞的调控作用,目前尚未见文献报道。
笔者前期结果发现SLE 患者外周血B 细胞中BRD4 的表达显著高于健康对照组(HC),提示BRD4 可能参与SLE 的发病机制。为此进一步探讨SLE 外周血B 细胞中异常升高的BRD4 蛋白在SLE 浆细胞的分化过程中的作用,观察发现BET蛋白抑制剂JQ1,对B 细胞的增殖及凋亡没有显著的抑制作用,但其可有效降低SLE 外周血浆母细胞和浆细胞的比例,提示JQ⁃1 可调控SLE 中浆母细胞途径介导的浆细胞分化过程。
本研究不足之处在于:尽管JQ⁃1 抑制剂对BRD4 活性的抑制作用具有一定偏好,但其仍可对BRD2、BRD3 及BRDT 蛋白发挥作用,因此不排除JQ⁃1 通过调控其它BET 蛋白活性发挥作用,因此选择BRD4 高选择性抑制剂具有重要意义;此外没有探究JQ⁃1 对SLE 外周血B 细胞的调控机制,且未通过动物模型进一步证实其可能的潜在治疗作用。
总之,BRD4 在系统性红斑狼疮患者外周血B细胞中表达增加,提示BRD4 蛋白在SLE 的发病机制中发挥重要作用,JQ⁃1 可抑制SLE 外周血浆细胞分化,从而发挥对系统性红斑狼疮的治疗作用,但精确的调控机制有待进一步深入研究,JQ⁃1 有望成为SLE 新的潜在治疗药物。

