新型冠状病毒肺炎与甲状腺疾病
陈紫晗,李乃适,连小兰
中国医学科学院北京协和医院内分泌科 国家卫生健康委内分泌重点实验室,北京 100730
2019年12月,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV- 2)感染引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID- 19)疫情暴发,并迅速蔓延引发全球大流行[1]。虽然呼吸系统症状是COVID- 19患者最突出的临床表现,但全身其他脏器受累情况亦不容忽视[2]。有研究指出,COVID- 19发病机制可能与自身免疫应答相关,甲状腺作为自身免疫损伤高发的内分泌器官,其在SARS-CoV- 2感染后的受累情况逐渐受到关注。Doustmohammadian等[3]已针对COVID- 19与甲状腺疾病之间的关系提出荟萃分析的计划。本研究对已报道的COVID- 19相关甲状腺疾病包括亚急性甲状腺炎(subacute thyroiditis,SAT)、自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)、非甲状腺疾病综合征(non-thyroidal illness syndrome,NTIS)以及原因未明的甲状腺功能异常进行总结,以加深临床医师对该类疾病的认识,为临床诊疗提供参考依据。
1 亚急性甲状腺炎
SAT常与前驱病毒感染有关,SARS-CoV- 2作为一种侵袭呼吸道的病毒,理论上存在诱发SAT的可能[4- 5]。意大利学者Brancatella等[6]报道了首例SARS-CoV- 2感染伴发SAT的病例特征。该患者为18岁女性,发现SARS-CoV- 2感染18 d后出现发热、颈部疼痛伴下颌放射痛(SAT经典临床表现),被诊断为轻型COVID- 19。其接受糖皮质激素治疗后,甲状腺功能和炎症指标均于40 d内恢复正常。Caron[7]对22例SARS-CoV- 2感染伴发SAT病例的临床资料总结后发现,女性患者更常见(男性4例,女性18例),SARS-CoV- 2感染至被诊断为SAT的时间为(21±11) d,典型临床表现为颈前部疼痛伴下颌及耳部放射痛。11例颈前区触诊可及甲状腺肿伴触痛,11例出现甲状腺毒症的临床表现,包括心悸、多汗、体质量减轻等。实验室检查可见C反应蛋白(C reactive protein,CRP)升高,白细胞、中性粒细胞亦可轻度增多,促甲状腺激素(thyroid stimulating hormone,TSH)水平较低,游离甲状腺素(free thyroxine,FT4)和游离三碘甲状腺原氨酸(free triiodothyronine,FT3)升高,还可能出现血清甲状腺球蛋白(thyroglobulin,Tg)水平升高以及促甲状腺激素受体抗体(thyroid stimulating hormone receptor antibody,TRAb)、抗甲状腺过氧化物酶抗体(anti-thyroid peroxidase antibody,TPOAb)和抗甲状腺球蛋白抗体(anti-thyroglobulin antibody,TgAb)阳性。超声检查可见明显的甲状腺肿大伴双侧甲状腺弥漫性低回声区,无血管增生,可出现颈部淋巴结形态异常。甲状腺放射性核素显像示放射性同位素在甲状腺的摄取明显减少或缺失。由此可见,部分COVID- 19伴发SAT患者的临床表现与经典SAT相似,一方面应警惕COVID- 19病例发生SAT,另一方面,对COVID- 19高发区的SAT病例进行SARS-CoV- 2病原学检测也具有必要性[8]。
COVID- 19伴发SAT病例并非均具有典型的SAT临床表现。可能是由于COVID- 19治疗方案中糖皮质激素或非甾体抗炎药的应用导致SAT经典临床表现被掩盖。Ippolito等[9]报道了1例COVID- 19伴发SAT的病例未出现颈部疼痛症状,推测可能与其术后大量应用镇痛药有关。
关于SARS-CoV- 2感染伴发SAT病例的治疗方案,Caron[7]研究中,11例使用糖皮质激素治疗,且此11例患者均不具有因COVID- 19使用糖皮质激素治疗的适应证,其采用糖皮质激素治疗可能与伴发SAT有关。此外,3例患者单独应用非甾体抗炎药治疗,2例未明确提及SAT相关治疗,6例在未使用非甾体抗炎药和糖皮质激素的情况下SAT逐渐恢复,提示SAT具有自限性,预后良好,轻型患者可应用非甾体抗炎药,中、重型患者可应用糖皮质激素,且适用于COVID- 19相关SAT病例。
2 自身免疫性甲状腺疾病
目前认为,在SARS-CoV- 2感染致病的病理生理机制中,自身免疫占据非常重要的地位[10]。因此SARS-CoV- 2感染引起AITD具有理论基础。目前亦有病毒感染诱发AITD的报道,如丙型肝炎病毒诱发Graves病(Graves disease,GD),人类疱疹病毒- 6感染诱发桥本甲状腺炎(Hashimoto thyroiditis,HT)的报道[11- 12]。
经检索文献发现5例COVID- 19伴发GD的病例报道,分析可能的致病机制:应激反应是GD的诱发因素,SARS-CoV- 2感染本身即为应激事件,可直接介导GD的发生;此外,由于疫情初期对COVID- 19缺乏全面的了解,确诊COVID- 19后伴随的恐惧心理,亦可成为GD的诱发因素。Harris等[13]报道了首例COVID- 19伴发GD的病例。该患者为21岁女性,发现SARS-CoV- 2感染17 d后出现心悸、烦躁等症状;体格检查可见弥漫性甲状腺肿大、甲状腺区无触痛,未见Graves眼病的表现;实验室检查示FT3、FT4水平升高,TSH水平降低,TRAb阳性,符合GD的诊断。此后,Jiménez-Blanco等[14]和Mateu-Salat等[15]又报道了4例COVID- 19伴发GD病例的临床资料,详见表1。上述5例COVID- 19伴发GD患者均采用甲巯咪唑(methimazole,MMI)治疗,其中3例联合应用β受体阻滞剂(β-receptor blocker,β-RB),GD病情均得到控制,疾病的远期转归尚有待进一步随访。
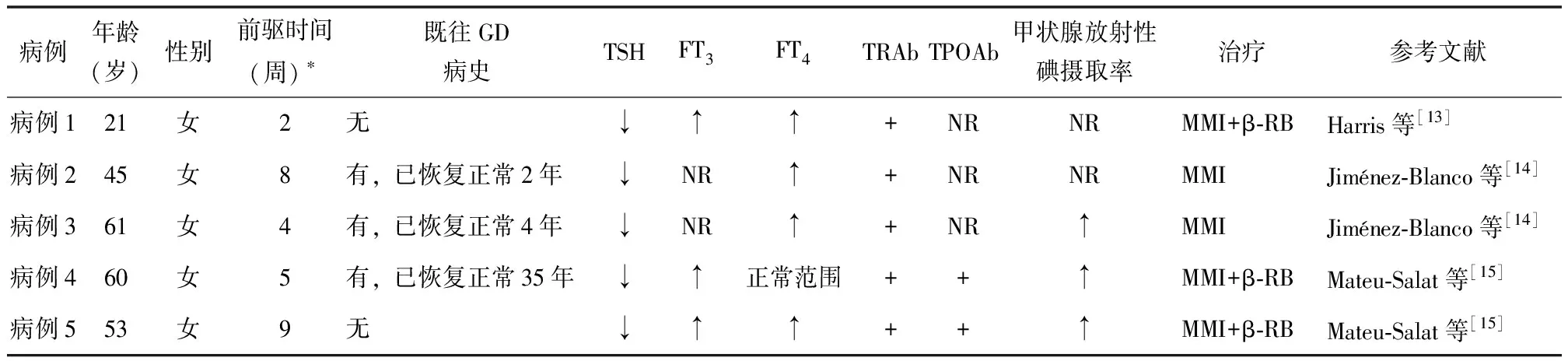
表1 COVID- 19伴发GD的病例特点
目前,仅检索到1例COVID- 19伴发HT的病例报道[16]。患者为45岁男性,发现SARS-CoV- 2感染7 d后出现甲状腺功能减退的临床表现,TPOAb阳性,确诊为HT,经左旋甲状腺素治疗后HT恢复正常。
因此,从发病机制上看,SARS-CoV- 2感染引起AITD具有理论依据;从上述病例的病程进展时间上看,AITD可能为SARS-CoV- 2感染所诱发。关于GD的治疗,应用抗甲状腺药物治疗甲状腺毒症通常较安全,但需注意,粒细胞缺乏症(抗甲状腺药物的不良反应)的临床表现可与COVID- 19类似,应注意鉴别。关于HT的治疗,可通过定期补充左旋甲状腺素以纠正甲状腺功能减退[8]。
3 非甲状腺疾病综合征
NTIS已在多种急、慢性临床疾病中发现,患者出现甲状腺激素谱复杂变化,包括血清T3水平下降、TSH水平正常或轻微下降等,随病情进展T4亦可出现异常[17]。部分COVID- 19病例可出现甲状腺功能紊乱的表现,经鉴定符合NTIS的诊断,且此种病例在重症COVID- 19患者中出现的概率更高。Zou等[18]展开的回顾性队列研究纳入了149例COVID- 19患者,其中41例出现NTIS,NTIS发生率约为28%。1项队列研究纳入来自伦敦3家医院的456例住院患者,包括COVID- 19患者334例、非COVID- 19患者122例。COVID- 19组中甲状腺功能正常者占比86.5%;与非COVID- 19组比较,COVID- 19组TSH和FT4水平降低,尤其重症病例具有更低水平的TSH和FT4[19]。COVID- 19伴发NTIS病例中,CRP、红细胞沉降率、降钙素原等炎症指标明显升高,提示该类人群中呈现强烈的炎症反应和免疫应答[18]。
COVID- 19病情得到有效控制后,NTIS相关甲状腺功能异常可逐渐恢复正常[19],患者能否从甲状腺激素替代治疗中获益,目前尚无相关研究。关于NTIS对COVID- 19患者预后的影响,亦缺乏系统研究。合并甲状腺功能异常可能预示疾病的严重程度更高,且对COVID- 19转归产生不利影响[20- 21]。Zou等[18]研究显示,合并NTIS的COVID- 19患者预后更差。Chen等[22]纳入50例COVID- 19患者并评估甲状腺功能变化,发现其TSH和总T3水平显著低于非COVID- 19患者和健康人群,且TSH和总T3水平降低程度与COVID- 19严重程度呈正相关。Lania等[23]认为,合并显性甲状腺功能亢进或甲状腺功能减退的COVID- 19患者具有更高水平的死亡率。Gao等[24]对来自武汉的100例COVID- 19患者的甲状腺功能进行了回顾性研究,发现相比于非重症患者,重症病例的TSH和FT3水平显著降低,多因素回归分析证实低水平FT3是COVID- 19患者死亡的独立预测因子。Campi等[25]则更直接地提出可将FT3减低作为COVID- 19患者死亡的预测指标。但亦有研究者认为,NTIS并不影响COVID- 19患者预后。Güven等[26]对轻症和重症COVID- 19病例的甲状腺功能评估后发现,虽然重症病例的FT3和FT4水平更低,但甲状腺功能减退与预后无明确相关性。Daraei等[27]共纳入390例COVID- 19患者,其中21例(5.4%)出现甲状腺功能减退,与未出现甲状腺功能减退患者相比,合并甲状腺功能减退COVID- 19患者的死亡率并无显著升高。不同研究之间结果存在差异的原因:(1)甲状腺激素谱变化较为复杂,很多情况下无法明确诊断NTIS,可能导致结果存在偏倚。(2)目前COVID- 19患者全身组织、器官损伤相关研究多为回顾性分析,且主要关注肺部病变,对甲状腺功能异常尚缺乏全面认识,因此,COVID- 19伴发NTIS病例的特征以及预后情况需进一步观察。
4 原因未明的甲状腺功能异常
部分COVID- 19病例的甲状腺激素谱出现异常,但无法明确病因,称为原因未明的甲状腺功能异常。Muller等[28]开展的研究纳入了85例在重症监护病房住院治疗的COVID- 19患者,其中13例(15%)出现FT4水平增高,TSH水平减低;前期在重症监护病房住院治疗的SARS-CoV- 2阴性患者中,仅1%出现类似的甲状腺激素谱改变。甲状腺超声检查示13例患者均表现为弥漫性轻度低回声,闪烁扫描示甲状腺对放射性同位素摄取减少,结合其甲状腺自身抗体阴性,符合SAT的表现;但患者不具有SAT经典临床症状(如颈部疼痛),且甲状腺激素谱仅轻度异常,最终诊断为非典型甲状腺炎。因此,该研究者认为,对重症COVID- 19患者进行甲状腺功能评估尤为重要。
5 新型冠状病毒肺炎相关甲状腺疾病的可能分子机制
5.1 生化机制
目前,已有研究对SARS-CoV- 2感染致甲状腺损伤的可能分子机制进行了揭示。通过对COVID- 19患者进行观察以及哺乳动物模型证实,血管紧张素转换酶2(angiotensin-converting enzyme 2, ACE2)、跨膜丝氨酸蛋白酶2(transmembrane protease serine 2, TMPRSS2)在COVID- 19发病机制中占据重要地位[29]。鉴于ACE2和TMPRSS2在甲状腺组织中呈高水平表达(甚至高于肺组织),其与SARS-CoV- 2感染以及甲状腺功能之间的关系逐渐得到关注[30- 31]。ACE2和TMPRSS2参与了SARS-CoV- 2的内化,其中ACE2可作为SARS-CoV- 2感染靶细胞的受体,SARS-CoV- 2棘突蛋白(S蛋白)经TMPRSS2处理后,可介导病毒侵袭宿主细胞,通过对靶细胞的细胞毒性作用或激活免疫细胞使机体激活炎症反应,引起靶器官损伤[32- 33]。Sigrist等[34]通过同源建模提出了SARS-CoV- 2与整合素αvβ3的结合可促进SARS-CoV- 2内化的假说。但有研究者提出了截然不同的观点,Luan等[35]认为,整合素αvβ3通过识别并与ACE2和SARS-CoV- 2的S蛋白结合,可阻碍SARS-CoV- 2与ACE2的结合,对减少SARS-CoV- 2入侵甲状腺具有积极作用。ACE2和TMPRSS2在COVID- 19相关甲状腺疾病发生中的机制尚需高质量研究进一步验证。
5.2 免疫应答
Peng等[36]通过对恢复期COVID- 19患者外周血采样,应用酶联免疫斑点技术评价了SARS-CoV- 2特异性记忆T细胞免疫应答,发现CD4+T细胞和CD8+T细胞可针对SARS-CoV- 2不同靶点发挥抗感染效应。白细胞介素(interleukin, IL)- 6可用于评估COVID- 19严重程度和患者预后。IL- 6与可溶型IL- 6受体结合后可作用于糖蛋白gp130,激活下游JAK/STAT信号转导通路,诱发多种炎症和自身免疫性疾病;IL- 1β、IL- 10、肿瘤坏死因子-α和γ-干扰素等炎症因子亦可直接或间接参与COVID- 19病程中的免疫功能紊乱[37- 42]。AITD患者的血清IL- 6和肿瘤坏死因子α水平明显上调,此种现象在合并AITD的COVID- 19病例中表现得更为明显;已有研究观察到SARS-CoV- 2可通过破坏免疫耐受诱发AITD或其他甲状腺疾病,其机制与IL- 6等炎症因子能启动Th17细胞的增殖分化,诱导产生具有特异性的自身反应性B细胞,导致免疫损伤相关[43- 46]。
6 小结
我国在COVID- 19的防控中已取得卓越成效,COVID- 19相关研究亦大量涌现,由于甲状腺是一个自身免疫损伤高发的内分泌器官,SARS-CoV- 2引起的甲状腺疾病逐渐得到临床关注。本研究对SARS-CoV- 2感染与甲状腺疾病之间的联系进行了初步探讨,以供临床同行参考。另外,作为一种全新的病毒,SARS-CoV- 2相关研究进展虽然成绩斐然,但研究证据多基于回顾性研究或个案报道,其引发甲状腺疾病的具体分子机制尚缺乏系统研究,在全球COVID- 19仍肆虐的背景下,有待开展多中心前瞻性研究进一步探讨二者之间的联系。
作者贡献:李乃适、连小兰负责构思论文;陈紫晗负责查阅文献资料和撰写论文;李乃适、连小兰、陈紫晗负责修订论文。
利益冲突:所有作者均声明不存在利益冲突

