宫腔镜手术治疗子宫内膜息肉不孕症患者的临床观察
徐香梅
(黄冈市蕲春县妇幼保健院妇产科,湖北 黄冈 435300)
子宫内膜息肉在临床中以育龄期女性较为多见,属于临床妇科常见疾病,主要是因子宫局部内膜过度增生,导致子宫腔内生长形状不一的光滑肿物。临床目前尚未完全掌握子宫内膜息肉的具体病因[1]。诸多研究认为,子宫内膜息肉的发生多半与机体内分泌系统紊乱有关,体内雌激素水平过高可造成子宫内膜增生,而手术、流产及分娩、长期的妇科炎症等因素也可诱发子宫内膜息肉[2]。大多数患者在疾病后期可出现异常子宫出血,且程度不一,严重时可造成不孕。临床对于该病患者多予以刮宫术治疗,但在治疗过程中仅能够依据医生多年的临床经验进行操作,极易对子宫内膜造成损伤,破坏子宫功能。随着近年来临床治疗技术的不断进步与完善,宫腔镜手术治疗得到患者与医疗人员们认可[3]。宫腔镜技术的应用,能够便于术者对患者宫腔内的不同改变进行清晰观察,及时准确地作出相应诊断,且具有术后恢复快与子宫内膜创伤小等优点。但目前临床关于子宫内膜息肉不孕症患者开展宫腔镜手术治疗的相关研究报道较少。鉴于此,本研究旨在探讨宫腔镜手术治疗子宫内膜息肉不孕症患者的临床效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年1月至2020年12月黄冈市蕲春县妇幼保健院收治的160例子宫内膜息肉不孕症患者为研究对象,按照随机数字表法将其分为参照组和试验组,各80例。参照组患者年龄25~45岁,平均年龄(30.17±1.34)岁;病程10个月~5年,平均病程(3.61±0.14)年;息肉直径7~14 mm,平均直径(9.33±1.24)mm;原发性不孕者40例,继发性不孕者40例;多发息肉42例,单发息肉38例。试验组患者年龄25~45岁,平均年龄(30.19±1.24)岁;病程10个月~5年,平均病程(3.66±0.31)年;息肉直径7~14 mm,平均直径(9.30±1.14)mm;原发性不孕者41例,继发性不孕者39例;多发息肉40例,单发息肉40例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经黄冈市蕲春县妇幼保健院伦理委员会批准,患者及其家属均对研究知情并签署知情同意书。纳入标准:①符合《妇产科学》[4]中关于子宫内膜息肉不孕症的诊断标准,并检测肿瘤标记物诊断为子宫内膜息肉不孕症;②基本资料与病历资料完整;③超声检查提示子宫内存在异常回声;④术后能够长期坚持随访调查者;⑤能够进行正常沟通交流者。排除标准:①存在排卵障碍、子宫畸形、宫腔粘连、卵巢肿物、子宫肌瘤者;②因男方因素或自身输卵管因素导致不孕者;③凝血功能障碍者;④近期服用其他激素类药物治疗者;⑤伴有严重肝、肾等其他重要器官衰竭者;⑥存在手术禁忌证者;⑦存在子宫内膜癌变可能者。
1.2 手术方法 参照组患者行刮宫术治疗,采用宫腔镜(桐庐精锐医疗器械有限公司,型号:JRL-1)观察子宫内膜息肉情况,用刮匙刮除息肉,息肉取出后,对宫腔进行负压吸引,将刮匙组织吸出,在宫腔镜直视下观察有无残留组织,确保息肉被刮除干净,对周围内膜不予处理。试验组患者则采用宫腔镜手术治疗,在患者月经排净后3~4 d开展手术治疗,术前帮助患者完善相关检查,检查其心肺功能与血液系统,确定无手术禁忌证,嘱其术前禁食;予以患者静脉麻醉,将膨宫压力与灌流速度分别维持在90~100 mmHg和250 mL/min,协助患者取膀胱截石位,在进行常规消毒与铺无菌治疗巾后,充分扩张宫颈口,将宫腔镜置入宫颈内部,全面检查子宫底与前后壁以及宫颈内口;对息肉蒂部宽度与数量、位置、大小等情况进行详细观察,调整电凝输出功能为80~100 W,定位完成后,切除息肉子宫内膜,取出息肉后,采用腹腔镜(杭州凯立康医疗器械有限公司,型号:KLK-DZ-1)全面复查,确定完全切除子宫内膜息肉。在宫腔镜直视下完成定位,将息肉进行切除,在息肉取出后,再次采用腹腔镜进行全面复查,以此确定子宫内膜息肉是否完全被切除。两组患者均在术后口服安宫黄体酮片(Pfizer Italia S.r.l.,注册证号H20140648,规格:4 mg/片),4 mg/次,2次/d。术后连续用药治疗3个月。
1.3 观察指标 ①比较两组患者治疗指标。包括手术出血量、手术时间、住院时间及月经量。②比较两组患者术后6个月及术后6~12个月妊娠情况、疾病复发情况。③比较两组患者治疗前后生命指征变化。包括血氧饱和度、心率、平均动脉压等指标。
1.4 统计学分析 采用SPSS 22.0软件进行数据处理。计数资料以[例(%)]表示,行χ2检验;计量资料以(x)表示,组间比较行独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗指标比较 试验组患者手术出血量与月经量显著少于参照组,手术时间与住院时间显著短于参照组,差异有统计学意义(P<0.05),见表1。
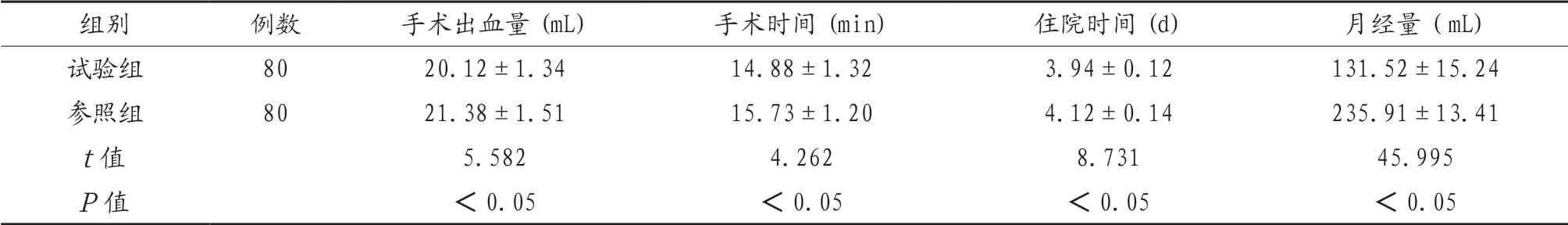
表1 两组患者治疗指标比较(x)
2.2 两组患者妊娠情况及疾病复发情况比较 试验组患者术后6个月与术后6~12个月妊娠率高于参照组,疾病复发率低于参照组,差异有统计学意义(P<0.05),见表2。
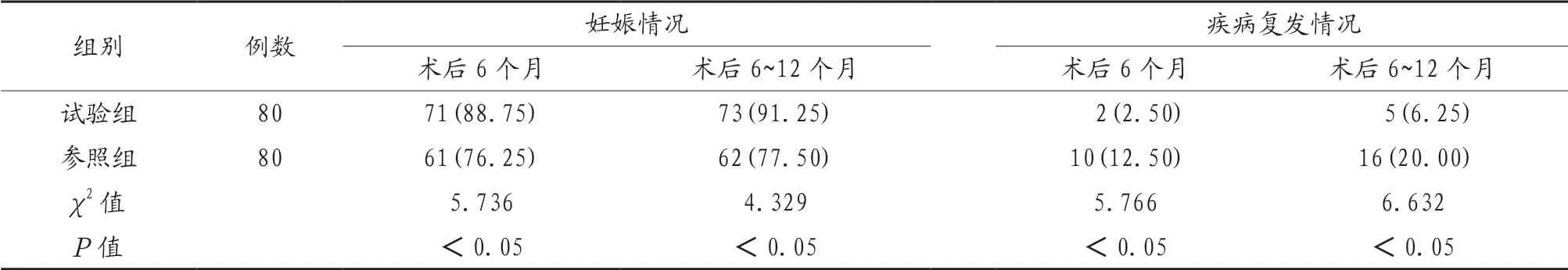
表2 两组患者妊娠情况及疾病复发情况比较[例(%)]
2.3 两组患者治疗前后生命指征比较 治疗前,两组患者体征比较,差异无统计学意义(P>0.05);治疗后,两组患者血氧饱和度高于治疗前,心率、平均动脉压低于治疗前,差异有统计学意义(P<0.05),治疗后,试验组患者血氧饱和度、平均动脉压高于对照组,心率低于对照组,差异有统计学意义(P<0.05),见表3。
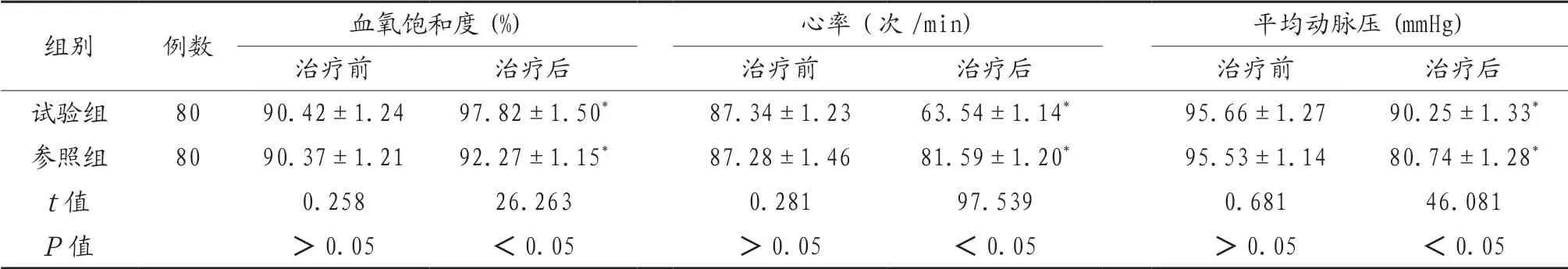
表3 两组患者治疗前后生命体征比较(x)
3 讨论
子宫内膜息肉作为临床妇科的常见疾病。较小的子宫内膜息肉一般无明显症状,而较大息肉常表现为出血性坏死,极易导致感染发生,具有恶臭血性分泌物和月经量过多、月经间期出血等临床表现。子宫内膜息肉往往多见于子宫颈管内,可对精子进入宫腔形成阻碍,影响胚胎正常发育,导致不孕[5]。
由于子宫内膜息肉不孕症患者在患病初期无明显临床特征,使医师在辨别与诊断时极易忽视此类病症,导致该疾病的不断加重[6]。临床以往对于子宫内膜息肉不孕症患者主要予以刮宫术与药物治疗,但由于药物治疗周期相对较长,临床治疗效果欠佳,诸多学者暂不推荐患者使用药物治疗[7]。而刮宫术治疗不利于医师对患者子宫内部情况进行观察,只能依靠医师多年临床经验完成,无法确定是否完全将子宫息肉清除干净,也无法明确息肉根部是否完全刮除。刮宫手术的开展极易对子宫内膜功能层造成破坏,刮匙无法触及宫角与宫底部分,导致息肉残留于子宫内部,极易增加子宫内膜息肉复发率。
近几年,通过临床研究不断深入,整体医疗水平不断提升,妇科疾病治疗中广泛开展宫腔镜手术。通过借助宫腔镜技术能够有效且全面地检查子宫腔内存在的病变情况,以此准确采集子宫内膜病变组织,开展相关检验工作,能够确保检验结果更加全面准确,尽早发现疾病,开展治疗,提升临床整体疗效。与此同时,通过宫腔镜手术切除宫腔粘连与内膜息肉、子宫内膜黏膜下肌瘤具有良好效果,能够显著减少手术对患者造成的创伤,为术后康复奠定基础。宫腔镜作为临床新型的微创新手术,将其应用于子宫腔内部的检查,借助成像系统与纤维光源内窥镜,能细致观察息肉表面组织结构,可准确且直观地呈现病变组织。此外,宫腔镜不仅能够明确病灶大小和具体位置,对病灶表面组织情况进行准确观察,有效弥补传统治疗方式的缺陷,还能够通过宫腔镜进行直接定位,将子宫内膜息肉去除,显著提升治疗子宫内膜的成功率与准确性,对于子宫内膜息肉不孕症患者而言,是一项安全有效的治疗方式。相关研究表明,对于部分诊断需要开展刮宫患者,可先予以宫腔镜检查,在确定好病灶部位后,可根据病灶实际情况展开治疗[8]。对于部分因宫腔粘连或输卵管不畅通等其他因素导致的不孕不育患者,可借助宫腔镜技术进行介入治疗与检查,以此改善不孕症。宫腔手术还具有能够有效控制疾病复发以及术中出血少、创伤小等优点,在去除息肉与缩短手术时间的同时,能够保护子宫不被损伤,被广泛应用于妇科疾病治疗中[9]。本研究结果表明,术后6个月与术后6~12个月试验组患者妊娠成功率显著高于参照组,且疾病复发率比参照组低。进一步提示对子宫内膜息肉不孕症患者开展宫腔镜治疗,手术创伤程度较低,能够有效提升术后妊娠率,降低患者术后疾病复发概率。本研究结果还表明,试验组患者手术出血量显著少于参照组,手术时间与住院时间显著短于参照组。进一步证实,宫腔镜手术在保障子宫内膜完整性的同时,可显著减少术中出血量与缩短手术时间与住院时间。分析原因,宫腔镜手术能够确定定位子宫内膜息肉病变位置,完全清除息肉有关,以此对子宫内膜进行充分保护,有效保留其生育功能。本研究还发现,试验组患者生命体征优于参照组。提示通过运用宫腔镜技术定位,能够准确切除息肉底部附着的基底层,将盆底正常组织结构完整保留,改善患者各项生命体征,提升临床疗效。张丽娟[10]研究发现,宫腔镜手术治疗子宫内膜息肉不孕症患者,治疗效果显著,方式切实可行,在提升临床疗效与准确性的同时,能够有效避免疾病复发,与本研究结果基本一致。进一步揭示宫腔镜手术疗效优于常规刮宫术,能够将子宫内膜息肉精确根除,保障子宫内膜组织结构的完整性,并有效疏通输卵管,对月经量进行有效控制,以此降低复发率,提升妊娠成功率。
综上所述,子宫内膜息肉不孕症患者实施宫腔镜手术治疗,在减少手术出血量,缩短手术时间与住院时间的同时,能够有效控制月经量,提升妊娠结局,避免疾病复发,有效改善其生命体征,在临床中具有较高的应用价值。

