甲型流感病毒T细胞表位预测及HLA-A2限制性抗原肽筛选*
韩雪, 寸怡娜, 朱兰芳, 王泯驿, 卢天畅, 姚宇峰, 史荔, 陶玉芬*
(中国医学科学院 & 北京协和医学院 医学生物学研究所, 云南 昆明 650118)
流感病毒是单负链RNA病毒,属于正黏病毒科[1],可导致严重呼吸道疾病甚至死亡。2019年,《柳叶刀》杂志报道季节性流感造成的死亡病例约有29万至65万[2],甲型流感病毒(influenza A viruses,IAV)和乙型流感病毒主要引起季节性流行,其中病毒株A/California/7/2009(H1N1)已经传播50年[3]。接种疫苗是对抗流感最有效的方法,但目前获得许可的流感疫苗很少能够针对变异株提供有效的保护[4]。为克服现有流感疫苗的局限性,开发一种针对病毒保守组分的通用流感疫苗已成为研究的热点。有研究利用流感病毒保守的基质蛋白胞外区(matrix protein 2 extracellular region, M2e)和血凝素茎域(hemagglutinin stem,HA stem)的流感疫苗,在小鼠中证明了该疫苗对多种流感病毒感染具有保护性[5]。由美国Altimmune公司研制的T细胞表位疫苗FP-01.1可通过肌肉注射、引起强烈的细胞免疫反应,并且耐受性和安全性良好[6]。作为一种主要的通用疫苗形式,基于流感病毒保守表位的疫苗不仅可诱导体液免疫反应,而且可诱导细胞免疫反应来清除感染,细胞免疫在控制流感中发挥重要作用[7-9]。在小鼠中,通过诱导细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)产生广泛的细胞因子和趋化因子,在免疫应答的早期保护中起关键的作用[7];在非人灵长类动物中,交叉反应性T细胞可以诱导灵长类动物流感病毒的早期清除[8-9]。同时,CTL的应答是人类白细胞抗原(human leukocyte antigen, HLA )限制性,即特定HLA分子只识别特定的抗原肽,形成稳定的HLA-Ⅰ类肽加工复合体将病毒肽段呈递于细胞表面,才能诱导CTL的识别和杀伤。此外,HLA基因呈现高度多态性,其中HLA-A*02 ∶01等位基因是全球人群HLA-Ⅰ类等位基因中是最常见的一种,频率为39.08%,中国人群为14.62%[10]。本研究基于H1N1保守的蛋白聚合酶复合物1(polymerase basic 1,PB1)、核内部蛋白(nucleocapsid protein,NP)及基质蛋白1(matrix protein 1,M1)蛋白,通过免疫表位数据库(immune epitope database,IEDB)进行总评分计算、人群覆盖率分析和聚类分析预测HLA-Ⅰ类限制性流感T细胞表位,进而将筛选出的HLA-A*02 ∶01限制性抗原肽进行HLA-A*02 ∶01结合的亲和力和稳定性验证以寻找潜在的抗原肽,为通用流感疫苗的开发提供前期基础。
1 材料与方法
1.1 实验材料
1.1.1抗原肽及T2细胞 本研究抗原肽纯度为95%,由美国金斯瑞公司合成,T2细胞购于上海复祥生物公司。
1.1.2主要仪器与试剂 RPMI 1640培养基购于中国康宁公司,抗人HLA-A2抗体购于美国Biolegend公司,人β2微球蛋白(β2-microglobulin,β2M)购于以色列PROSPEC公司,雷菲德菌素A(Brefeldin A)购于美国MCE公司,流式细胞仪购于美国BECKMAN公司。
1.2 研究方法
1.2.1HLA-Ⅰ抗原肽预测 选择IVA[A/California/7/2009 (H1N1)]作为原始毒株,在Taxonomy Browser中获取PB1、NP和M1蛋白的序列。PB1序列号为YP_009118628.1,NP序列号为AMV49024.1,M1序列号为YP_009118623.1。通过IEDB,对A/California/7/2009(H1N1)的PB1、NP和M1蛋白的CD8+T细胞表位进行预测,选择70个HLA-Ⅰ类等位基因进行预测,其中包括HLA-A等位基因18个,HLA-B等位基因32个, HLA-C等位基因20个。见表1。

表1 本研究选择的HLA等位基因Tab.1 Selected HLA alleles in this study
1.2.2HLA-Ⅰ抗原肽分析 本研究使用总分作为评估抗原肽指标,其中PB1蛋白以0.99为临界值,NP蛋白以0.53为临界值,M1蛋白以0.37为临界值。利用IEDB分析工具将这些抗原肽进行聚类分析,将序列一致性的最小阈值定位为70%。通过人群覆盖率工具分析每个抗原肽的人群覆盖率和HLA等位基因的结合情况,选择95%为人群覆盖率的阈值。
1.2.3HLA-Ⅰ抗原肽结合的亲和力及稳定性验证 (1)HLA-Ⅰ抗原肽结合的亲和力验证,T2细胞用RPMI 1640培养基培养并加入3 μg人β2M,在37 °C条件下与抗原肽孵育16 h后使用HLA-A2抗体染色,检测T2细胞上HLA-A*02 ∶01分子的表达,用平均荧光指数(mean fluorescence index,MFI)的变化来评价抗原肽的亲和力;(2) HLA-Ⅰ抗原肽结合的稳定性验证,T2细胞与60 mg/L抗原肽共孵育16 h,用洗液去除未结合的抗原肽,加入10 mg/L布雷菲德菌素A孵育1 h,用洗液清洗细胞,分别于、2、4、6及8 h后,加入HLA-A2抗体,使用流式细胞仪检测HLA-A*02 ∶02分子的表达。利用抗原肽-HLA-A*02 ∶01复合物解离的半衰期(DC50)来评估抗原肽与HLA-A*02 ∶01分子结合的稳定性。
1.3 统计学分析
使用GraphPad Prism 7.0 (GraphPad Software, 美国)进行统计分析。采用Unpaired T-Test分析方法,P<0.05为差异有统计学意义。
2 结果
2.1 HLA-Ⅰ类抗原肽预测
得到PB1、NP和M1蛋白的HLA限制性抗原肽总数分别为335 151、155 060及108 333条。选择总分0.990作为PB1蛋白选择抗原肽的临界值(75条),达到95%以上的人群覆盖率,通过聚类分析分为25个聚类。选择总分0.530作为NP蛋白抗原肽选择(78条)的临界值,达到95%以上的人群覆盖率,其分为20个簇。对于M1蛋白,以总分0.37作为M1蛋白进行抗原肽选择(55条)的临界值,达到95%以上的人群覆盖率,并分为13簇。见表2。
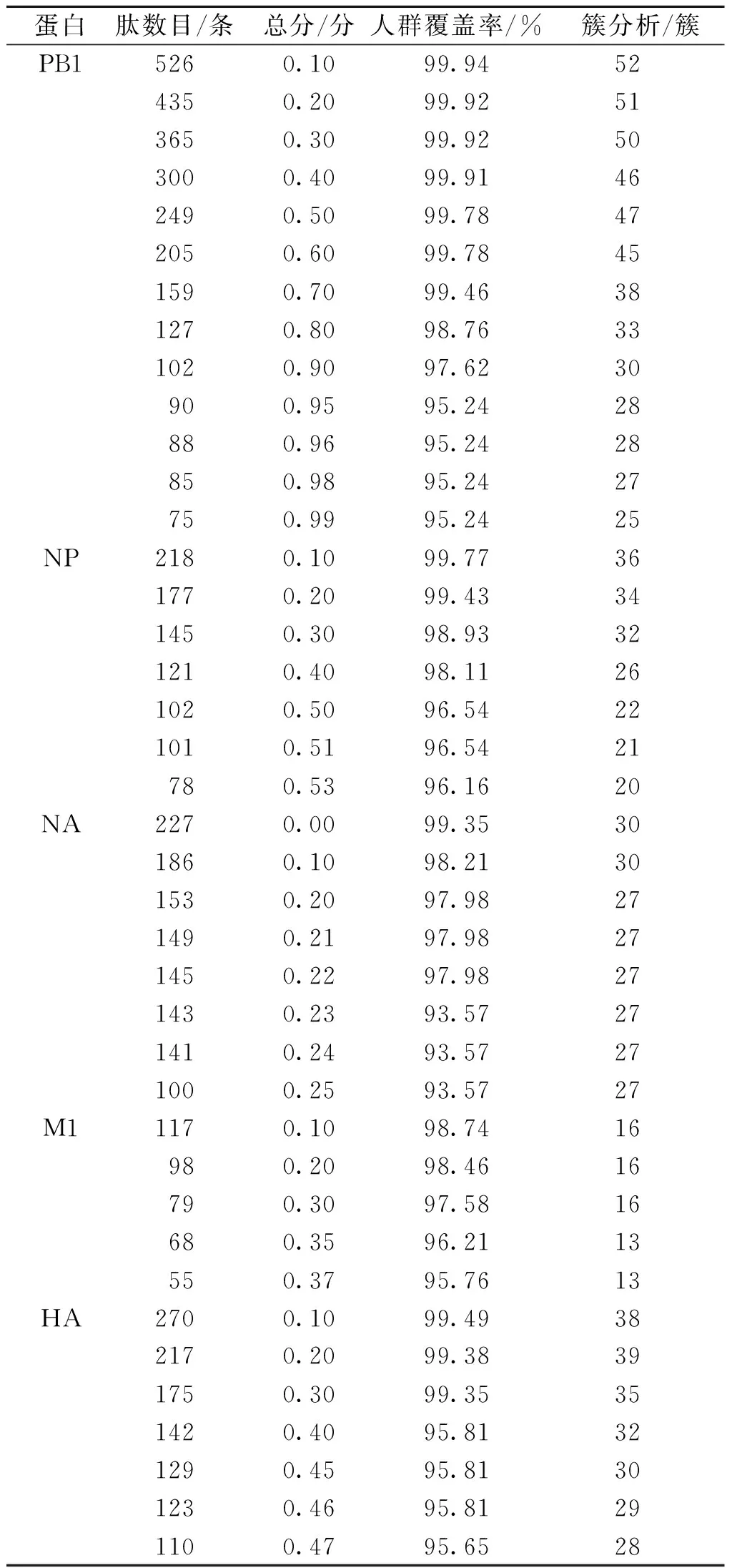
表2 PB1、NP和M1蛋白预测抗原肽数目、簇分析、人群覆盖率Tab.2 Antigenic peptide number,cluster analysis, and population coverage predicted by using PB1,NP, and M1 proteins
2.2 HLA-A*02 ∶01限制性抗原肽的人群覆盖率
从预测所获得的抗原肽库中,筛选出6条HLA-A*02 ∶01的限制性抗原肽,它们与其他HLA分子具有交叉呈递性 (表3)。例如,PB1-395,除HLA-A*02 ∶01外,可由 HLA-A*02 ∶06、HLA-B*15 ∶01、HLA-B*15 ∶25、HLA-C *03 ∶02、HLA-C*03 ∶03、HLA-C*03 ∶04、HLA-C*12 ∶02、HLA-C*12 ∶03、HLA-C*14 ∶02及HLA-C*16 ∶01分子呈递。这6条抗原肽在全球的人口覆盖率为76.98%。
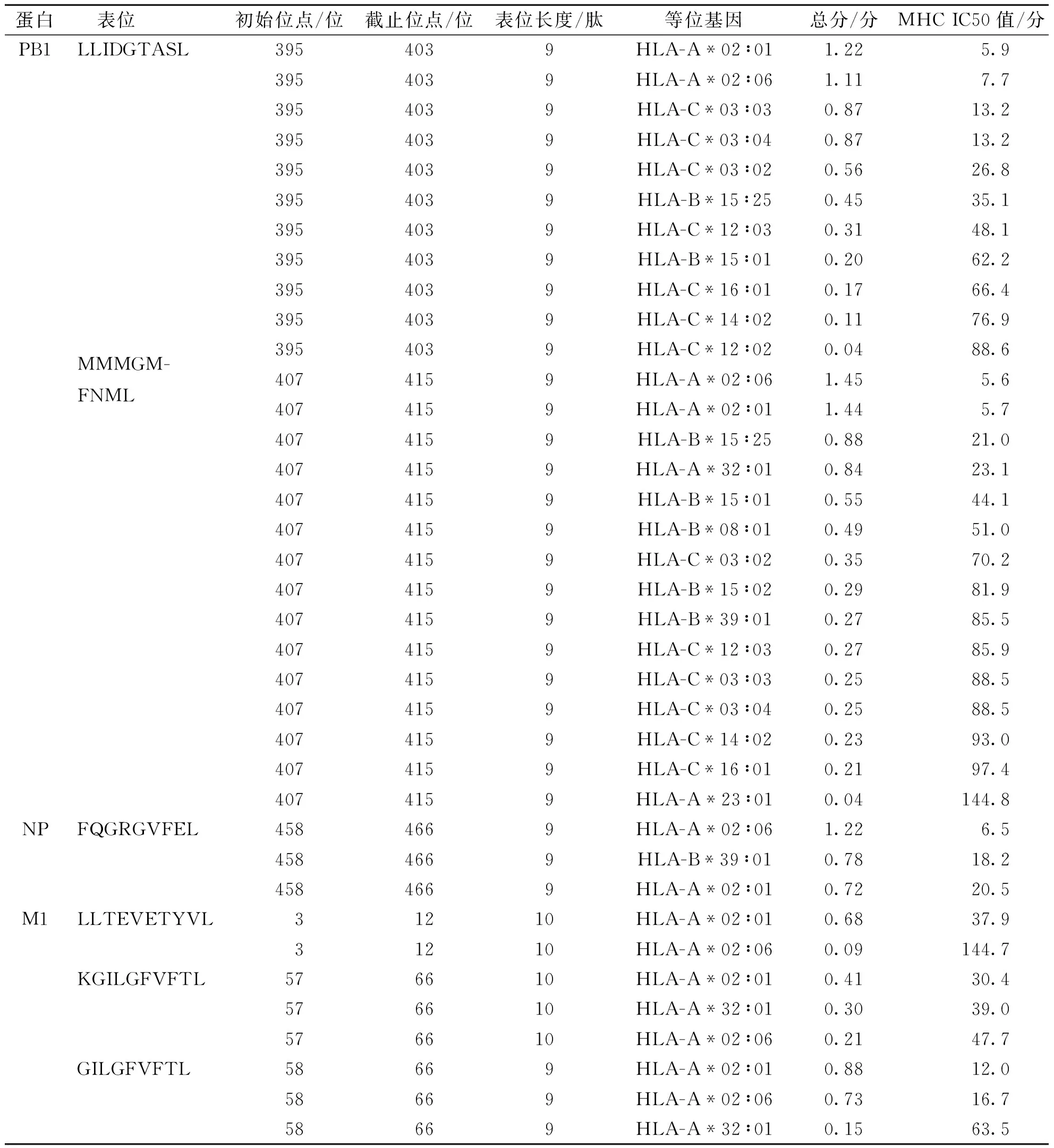
表3 HLA-A*02 ∶01限制性抗原肽长度、等位基因、总评分和IC50Tab.3 Total HLA-A *02 ∶01 restricted peptide length, allele, total score, and IC50
2.3 抗原肽与HLA-A*02 ∶01分子的亲和力
通过T2细胞结合实验评估了抗原肽对HLA-A*02 ∶01分子的亲和力(图 1A)。选取HLA-A*29 ∶02呈递的抗原肽PB1-1,作为阴性对照,M1-58为阳性对照。结果显示:PB1-407、NP-458和M1-57对HLA-A*02 ∶01分子的亲和力较低,M1-3具有中等亲和力、并显示为抗原肽浓度依赖性;PB1-395具有高亲和力,在60 μg剂量时,PB1-395和阳参肽M1-58的MFI均达到饱和状态,PB1-39的MFI高于M1-58 (P<0.000 1,图1B)。 PB1-395随着抗原肽浓度的增加,MFI没有明显变化;M1-58则随着剂量的增加,呈下降趋势。
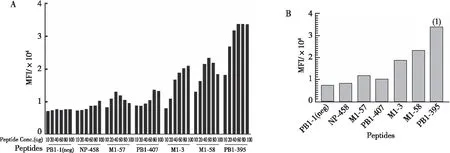
注:A为不同抗原肽在浓度梯度下MFI值,B为60 μg剂量下不同抗原肽MFI值,(1)与M1-58比较,P<0.00 01。图1 T2细胞结合实验中MFI Fig.1 MFI values of T2 cells in binding tests
2.4 HLA-A*02 ∶01分子限制性抗原肽的稳定性
结果显示,阴性对照PB1-1的DC50>2 h,M1-58的DC50 >6 h,PB1-395 DC50>8 h (表4),PB1-395具有较高的稳定性。
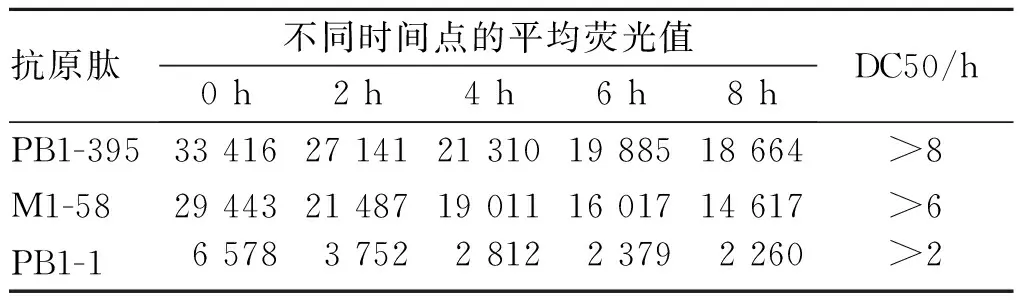
表4 候选抗原肽与HLA-A*02 ∶01结合稳定性实验结果Tab.4 Binding stability of candidate antigen peptides to HLA-A*02 ∶01
3 讨论
保守的T细胞表位可对不同的流感毒株和亚型提供长期交叉保护,使得通用型疫苗的开发成为可能[11]。在本研究中,使用IEBD分析流感A/California/7/2009 (H1N1)株的PB1、NP和M1保守蛋白序列,预测出HLA限制性CTL表位75个PB1表位,78个NP表位和55个M1表位。在6个HLA-A*02 ∶01限制性抗原肽中,PB1-395具有高的亲和力和稳定性,提示其有可能成为T细胞表位疫苗的候选。
T细胞表位疫苗是流感通用疫苗的研究热点之一。最近一项在HLA-A2转基因小鼠的研究中表明,CD8+T细胞表位疫苗诱导的免疫应答,能使小鼠获得保护,抵御流感病毒的攻击[12]。抗原肽M1-58于1991年被发现,在Bednarek等[13]的研究中发现M1-58在HLA-A2.1转基因小鼠中具有引起细胞免疫的能力。此外,在人HLA-A*02 ∶01供体的外周血单个核细胞中,M1-58具有诱导记忆T细胞的功能[14]。在本研究中,与M1-58相比,PB1-395对HLA-A*02 ∶01分子的亲和力更高(P<0.0001)。PB1是流感病毒RNA聚合酶核心的关键亚基之一,包含一个典型的RdRp结构域[15],此结构域是高度保守的催化核心,结构域中残基的突变会导致聚合酶活性的降低[16]。例如,在Waters等[17]的研究中,发现PB1蛋白序列的395位点, 401位点和402位点残基的突变会影响聚合酶的活性,在本研究筛选出的PB1-395序列中恰好包含了这3个位点。PB1-395不仅能被HLA-A*02 ∶01分子呈递,还可以被HLA-A*02 ∶06、HLA- C*03 ∶03、HLA-C*03 ∶04、HLA-C*03 ∶02、HLA-B*15 ∶25、HLA-C*12 ∶03等其他HLA分子呈递。作为最常见的HLA等位基因,HLA-A*02 ∶01在全球人群的分布频率为39.08%,加上HLA-A*02 ∶06、HLA-C*03 ∶03、HLA-C*03 ∶04、HLA-C*03 ∶02、HLA-B*15 ∶25、HLA-C*12 ∶03,累积频率可达到60.26%。因此,PB1-395抗原肽制备的T细胞表位疫苗,有望在全球范围内提供广泛的保护。
抗原肽与特定HLA分子的结合以及相互作用的亲和程度取决于抗原肽的氨基酸构象和MHC分子的抗原肽结合凹槽的三维结构[18]。在HLA分子凹槽中的锚定位点是决定抗原肽与HLA分子结合的重要因素,第2位偏向与亮氨酸或蛋氨酸结合,第9位偏向与缬氨酸或亮氨酸结合[19]。在本研究中,PB1-395的第2位和第9位是亮氨酸,可能是与HLA-A*02 ∶01分子结合的具有较好的稳定性和亲和力的原因。然而,PB1-407的2号和9号位置均为蛋氨酸,但与HLA-A*02 ∶01分子的亲和力则较低。而M1-58在2位和9位没有这样的锚定残基,却也显示出很高的稳定性和亲和力。因此,锚定残基规律可能只是影响抗原肽结合效果的因素之一。与本研究中NP-458具有较低亲和力的结果相反,YK张在T2结合试验中显示NP-458具有较高的结合亲和力[20]。然而,在HLA-A2.1转基因小鼠的体内研究中发现NP-458和PB1-407诱导的CTL反应均较低,可能与其与HLA-A2的亲和力较低有关[21]。本研究中,M1-3亲和力适中,而Derin在干扰素-γ(interferon-γ,IFN-γ)酶联免疫吸附试验中,发现M1-3无显著反应[22]。不同的实验方法可能是产生不同亲和力结果的可能原因。
综上,本研究采用免疫信息预测获得了流感病毒限制性抗原肽,抗原肽PB1-395显示出良好的亲和力和稳定性,有望成为通用型流感疫苗的候选抗原肽,但还需要进一步的体外和体内实验来评价抗原肽的免疫原性和有效性。

