运动疲劳引发的大鼠纹状体神经元树突棘可塑性变化及其细胞骨架机制
龚 云,刘晓莉,乔德才*
(1.北京师范大学 体育与运动学院,北京 100875;2.西北师范大学 体育学院,甘肃 兰州 730070)
突触是神经元之间的信息联系节点,在诸多突触类型中,轴-树突触最为常见,轴-树突触实质为轴突终末与树突棘形成的突触联系结构.树突表面的微小棘状突起称为树突棘,是突触后结构的基础,其可塑性变化主要体现在形态和功能上[1].树突棘中丰富的细胞骨架—微丝与微管决定其形态及功能变化,它们在树突棘可塑性中扮演重要角色[2].研究发现,在不同发育阶段及学习记忆过程中,树突棘均会发生可塑性变化[3].运动疲劳是制约体育成绩或健身功效的关键因素.纹状体是基底神经节的重要核团,在运动神经调控环路中具有重要作用.Yasuyuki等[4]研究发现,跑步运动通过改变患者纹状体树突棘形态结构,进而提高其运动能力.Christoffel等[5]通过调节特定神经元的活性改变树突棘的可塑性.陈巍等[6]的研究显示,运动疲劳可以使中等棘状神经元树突棘的密度产生显著变化.但这种变化的内在机制与细胞骨架之间的关联研究较少.鉴于此,文中通过7 d重复力竭跑台运动,建立运动疲劳模型,观测树突棘数量、形态变化及F-actin,MAP2,Tau基因表达情况,以期从细胞骨架视角探讨运动疲劳引起大鼠纹状体神经元树突棘可塑性变化的机制,为深入揭示运动性疲劳中枢机制积累分子水平的科学事实.
1 材料与方法
1.1 实验对象
随机选用Wistar成年雄性大鼠20只,体重185~200 g,购于兰州大学实验动物中心(SCXK(甘)2018-0002),国家标准啮齿类饲料(繁育级)喂养、自由饮食、分笼饲养、自然光照,温度22~23 ℃,湿度35%~40%,紫外线定期照射实验室及相关器具.
1.2 分组、建模与取材
适应性饲养3 d后,随机将大鼠分为2组:对照组(CG)和实验组(PG),后置跑台(BCPT-96,中国杭州)上运动适应3 d.在Bedford方法[7]的基础上,对常用的递增负荷跑台运动方案[8]予以改良:Ⅰ级负荷:速度15 m·min-1(30 min);Ⅱ级负荷:速度20 m·min-1(30 min);Ⅲ级负荷:速度25 m·min-1(60 min),前6 d按既定负荷运动,第7 d由第Ⅲ级负荷运动至力竭.力竭判断标准[9]:不能维持预定跑速,滞留跑道后挡板不动,光、电、声刺激及驱赶均无效,并伴有呼吸急促、俯卧、垂头不起等行为表现.第7 d力竭后即刻,各组大鼠行腹腔注射麻醉(0.4%戊巴比妥钠),心尖真空管抽血测试血糖(日本会好血糖仪),后迅速剥取整脑、沿纵裂切分为二,用生理盐水冲洗(>3次)表面血渍,左侧置于4%的多聚甲醛溶液中固定24 h以上,高尔基染色备用;参照鼠脑图谱剥离两组大鼠右侧纹状体(图1),滤纸吸干表面水分、锡纸包裹后置于液氮罐冷藏供qRT-PCR备用.
1.3 高尔基染色、切片及拍照
取固定好的左侧脑组织用生理盐水漂洗3次,后置于装有高尔基染液的容器中,放置在阴凉通风避光处,48 h后换新染液,后每3 d换1次,第14 d将组织块取出,先置于15%的蔗糖溶液中(4 ℃避光)脱水1 d,后置于30%的蔗糖溶液中(4 ℃、 避光)再脱水;2 d后将组织块取出,先用蒸馏水冲洗1 min,后用浓氨水浸泡30~45 min,再用蒸馏水洗1 min,定影液处理30~45 min后,蒸馏水再冲洗1 min.后将组织块置于30%的蔗糖溶液中(4℃、 避光)脱水2~3 d,冰冻切片机(CryoStar NX50)切片(100 μm),捞片、贴片后用梯度酒精脱水,二甲苯透明、中性树胶封片.最后用Motic数码显微镜(BA400/450,麦克奥迪实业集团有限公司)镜检并拍照(图1),每组分别拍摄400×,800×照片各10张.
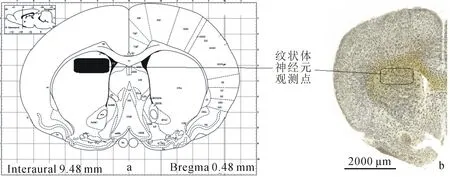
a 电子图谱,黑框为观测部位;b 高尔基染色切片,黑框为镜检及拍照部位
1.4 图像分析
运用Image J软件分析树突棘密度:将Golgi染色显微照片(400×)用Image J软件打开并选取任意部位,校对标尺,截取适当长度(像素131×152)的树突(图2a)进行灰度化(图2b)、二值化(图2c)、 骨骼化(图2d)处理, 计算树突棘密度及长度.在800×照片上,运用Image J软件统计树突棘的类型.
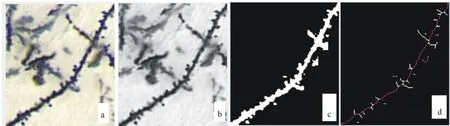
a 树突;b 树突灰变化;c 树突二值化;d 树突骨骼化
1.5 qRT-PCR实验
1.5.1 总RNA抽提及检测 将两组大鼠右侧纹状体从液氮罐中取出并复温,采用UNIQ-10柱式Trizol总RNA抽提试剂盒,严格按照试剂盒操作步骤操作.使用超微量分光光度计(Nanodrop 2000)检测RNA浓度及纯度:仪器调零后取2.5 μl待测RNA溶液置检测基座上,放下样品臂,使用电脑自带软件检测吸光值,测定样品在260 nm/280 nm的吸光值以评定RNA的质量.
1.5.2 反转录 取一PCR管,加入含2 μg RNA的溶液,再加入 1 μL oligo(dT)18,用无核糖核酸酶的去离子水补足至12 μL;先置PCR仪上保温5 min (65 ℃),后置冰上冷却;依次加入4 μL (5× Reaction Buffer), 2 μL (10 mmol·L-1dNTP Mix),1 μL (RiboLock RNAase抑制剂,20 U·μL-1和1 μL RevertAi M-MuLV 逆转录酶(200 U·μL-1),用枪抽吸混匀;于PCR仪上42 ℃保温60 min,结束后70 ℃保温5 min灭活反转录酶.
1.5.3 qRT-PCR引物设计 运用Primer软件对目的基因的mRNA序列进行检索,遵循qRT-PCR引物设计原则,设计引物见表1.

表1 qRT-PCR引物设计
1.5.4 qRT-PCR实验 取0.2 mL PCR管,配制反应体系(表2),每个反转录产物配制3管.PCR扩增:预变性(95 ℃,10 min)、变性(95 ℃,15 s)、退火延伸(60 ℃,60 s),循环40次.用比较Ct法计算基因相对表达量(2-△△Ct).

表2 实时荧光定量qRT-PCR反应体系
1.6 数据处理
采用SPSS20.0统计软件处理数据,数据均以平均数加减标准差(M±DS)表示.定量数据差异比较采用t检验,定类数据差异比较采用卡方检验,P<0.05表示差异有显著性意义,P<0.01表示差异有非常显著性意义,用GraphPad Prism 6.01作图.
2 结果
2.1 体重及血糖
体重与血糖是运动性疲劳的常用观测指标.实验前、后两组大鼠体重及血糖变化见表3.
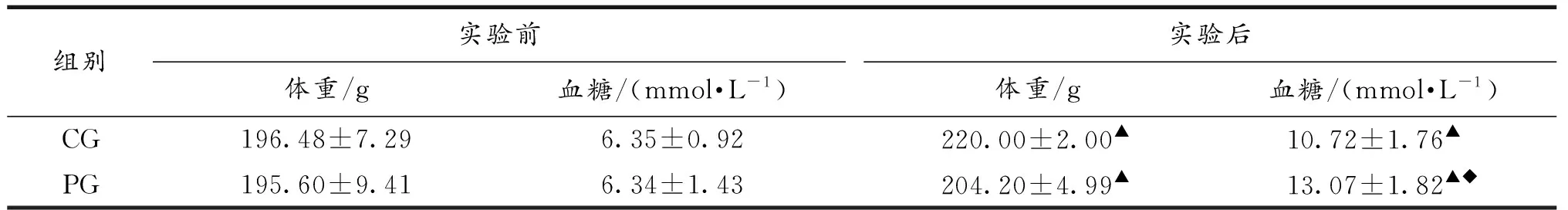
表3 实验前、后大鼠体重及血糖变化(N=10)
注:▲表示P<0.05,与实验前本组大鼠比较;◆表示P<0.05,与实验后CG组大鼠比较.
由表3可见,重复力竭运动7d后,两组大鼠体重、血糖均较本组实验前显著上升(P<0.05);且实验后,PG组血糖较CG组显著升高(P<0.05),体重组间差异不显著.
2.2 树突棘观测
2.2.1 树突棘分型 树突棘形态呈现多样性(图3a),依据大小和形状可分为:蘑菇型(Mushroom)、短粗型(Stubby)、细长型(Thin)和分叉型(Branch)4种类型[10].

a 树突棘形态,800×;b 实验组树突棘,400×;c 对照组树突棘,400×
每组随机选取10个视野(800×),运用ImageJ软件统计4种类型树突棘的数量,统计百分比后进行卡方检验,结果见表4.

表4 两组大鼠纹状体神经元树突棘分型百分比(n=10)
依据表4结果,运用GraphPad Prism 6.01作图,结果见图4.
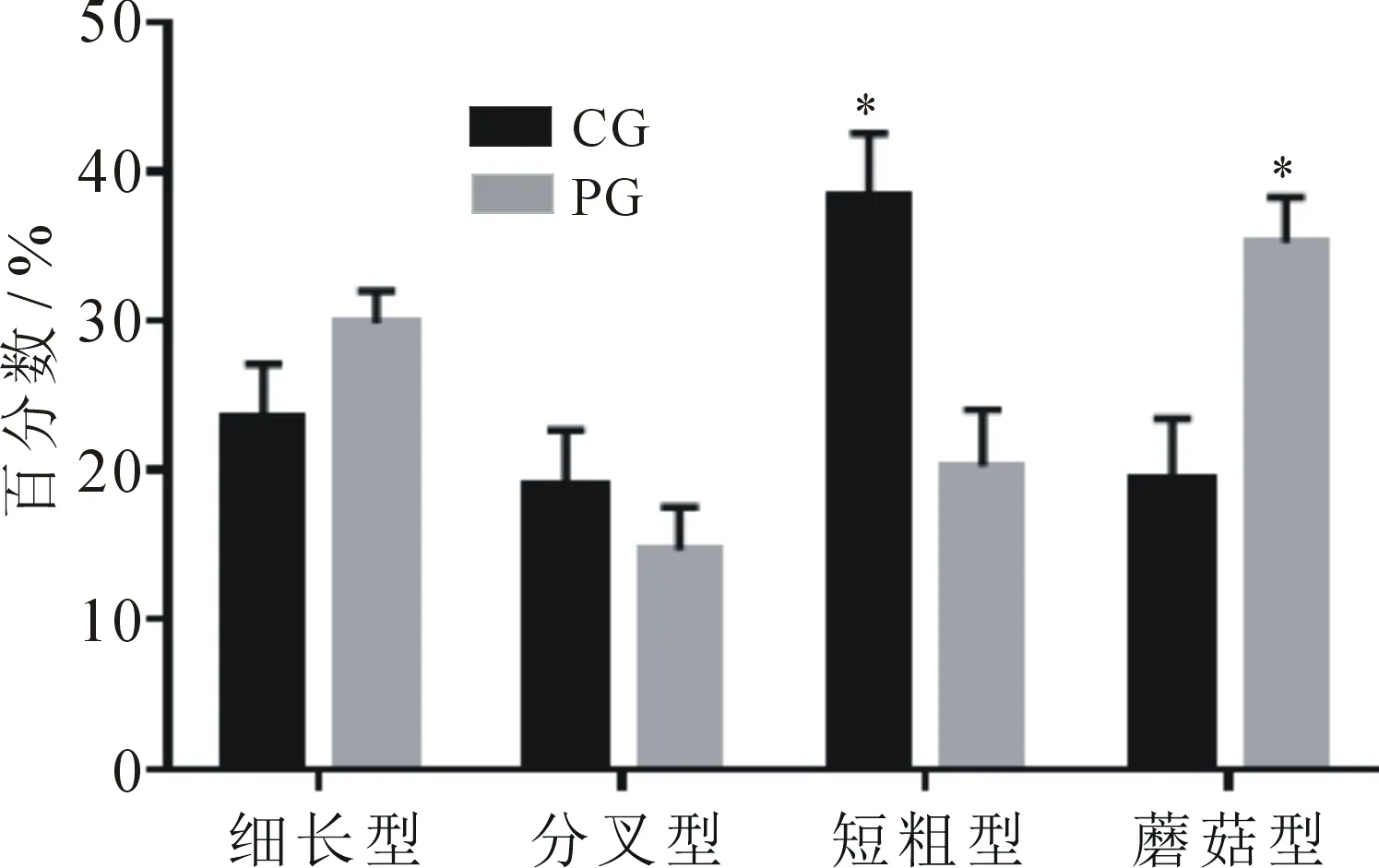
图4 两组大鼠树突棘类型百分比
由表4和图4可知,第7 d力竭后即刻,PG组细长型占比尽管较CG组有所升高,分叉型较CG组有所下降,但都不具统计学意义(P>0.05).短粗型占比较CG组大鼠下降非常显著(P<0.01),蘑菇型占比较CG组大鼠升高非常显著(P<0.01).
2.2.2 树突棘密度 树突棘的密度即单位长度内树突棘的个数,密度的变化不仅反应局部神经环路的调整,还直接影响神经元间信息传递的效率,也可体现神经元信息储藏及传递的能力.本实验树突棘密度分别以1 μm及10 μm长度内的个数来统计(见表5, 图3b,3c).

表5 两组大鼠单位长度内树突棘密度的变化(M±SD, n=10)
由表5和图3b,3c可知,与CG组相比,PG组大鼠纹状体神经元树突棘数量及密度显著增高(P<0.05)树突棘平均长度在两组之间无显著性差异(P>0.05).
2.3 qRT-PCR
2.3.1 总RNA浓度及纯度检测 若OD260/280的比值在1.8~2.1视为抽提的RNA溶液纯度很高.由表6可见,本次实验抽提的总RNA介于1.8~2.1,说明纯度很高,无蛋白质污染.

表6 两组大鼠纹状体RNA浓度及纯度测定结果
2.3.2 qRT-PCR反应结果 经qRT-PCR反应,以比较ΔCt法计算基因相对表达量,两组各基因扩增结果见表7.依据表7结果,运用GraphPad Prism 6.01作图,结果见图5.由表7和图5可知,运用比较ΔCt法计算基因相对表达量,结果以Ct均值和2-ΔΔCt呈现,结果显示,PG组三种基因的表达量分别是CG组的1.33,1.06和1.71倍.
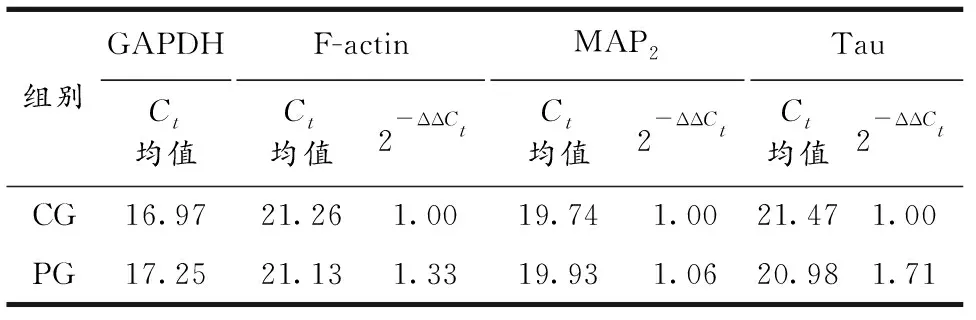
表7 两组大鼠纹状体神经元3种基因Ct均值及相对表达量
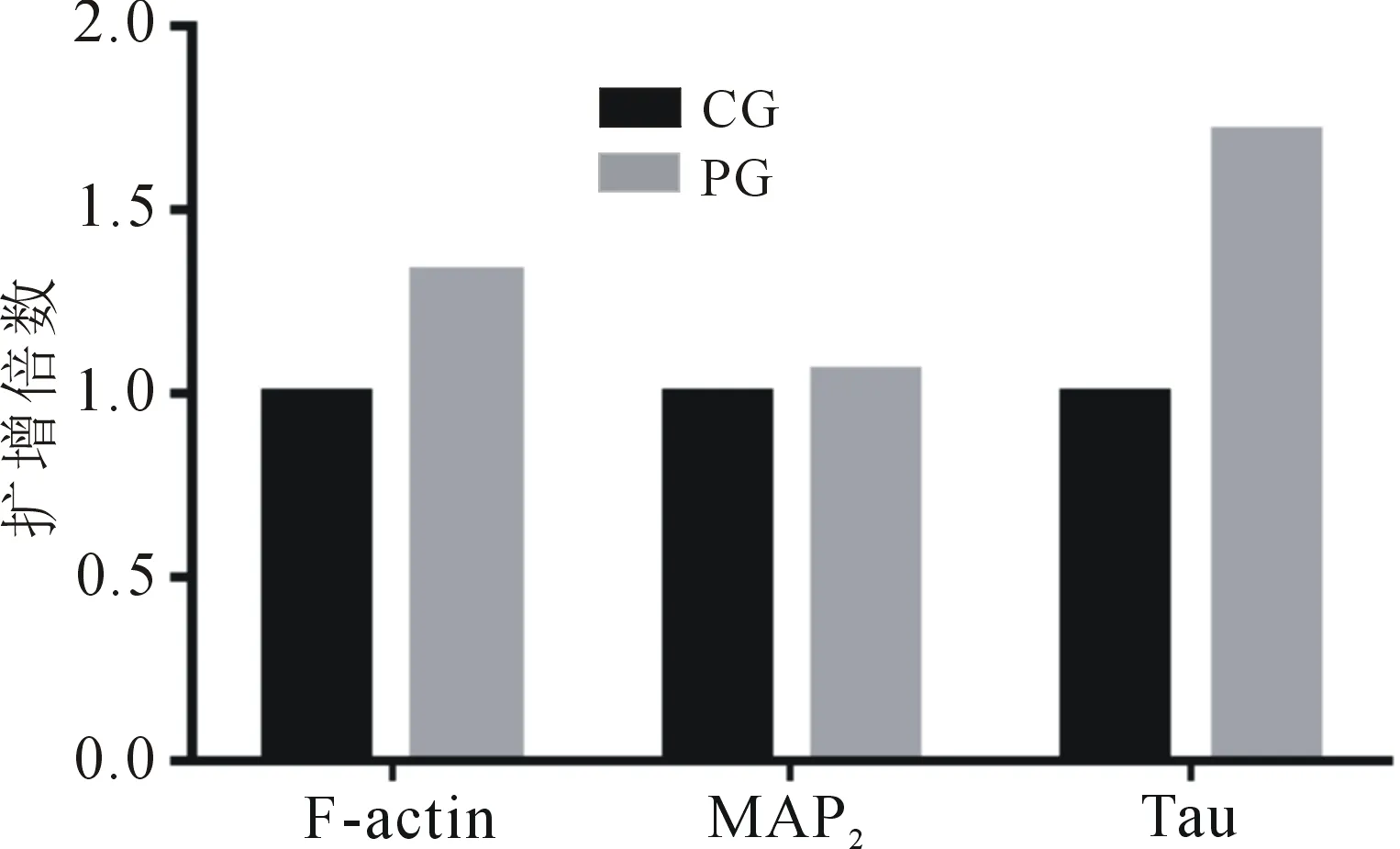
图5 两组大鼠3种基因扩增倍数
3 讨论
3.1 运动性疲劳后体重及血糖变化
现已知,中枢神经系统无法充分驱动运动神经元的兴奋性是造成肌肉工作能力下降的主要原因[11-12].哺乳动物大脑皮质与基底神经节之间存在三条环路联系,在这些环路联系上,纹状体依然具有承上启下的核心地位.纹状体以中等棘状神经元占优势比例,与大脑皮质运动区、黑质、丘脑底核等核团联系广泛而密切.众所周知,突触是神经元间信息传递的关健敏感部位,其可塑性变化必然牵涉大脑皮质运动神经元向下发放神经冲动的频次和强度,造成下行锥体束支皮质脊髓束等的传递效率下降,从而影响其驱动脊髓运动神经元的效果,或可造成肌肉工作能力的下降.侯莉娟等[13]的研究提示:随着运动疲劳程度的加深,大鼠纹状体神经元突触后致密物质(PSD)厚度逐渐减小,但与PSD-95蛋白表达无相关性.在运动性疲劳发生机制的诸多学说中,保护性抑制学说倍受青睐,或与运动性疲劳发生的中枢机制更为贴近.
从本实验结果来看,第7 d力竭运动后,体重在两组之间没有显著性差异,这与本组前期实验结果一致,但血糖水平实验组较对照组显著升高,与之前的实验结果相反.目前,运动与血糖水平变化方面研究结果尚不统一.有研究显示,力竭运动过程中大鼠血糖水平呈显著降低走势[14],相反的研究结果提示,大鼠负重游泳至力竭时血糖水平升高[15],这与本实验结果一致.也有研究显示,力竭运动后大鼠血糖浓度几乎无变化[16].机体内降低血糖水平的唯一激素是胰岛素,外周骨骼肌、脂肪等组织有两条途径调控血糖水平:即胰岛素依赖途径与非胰岛素依赖途径,且前者为主要途径.而纹状体神经元在运动状态下,多依赖非胰岛素途径调控血糖[17],力竭运动作为应激刺激,不能有效激活胰岛素受体相关的信号分子,譬如磷脂酰肌醇-3激酶-丝氨酸/苏氨酸激酶(PI3K/AKT)、糖原合成酶激酶-3β(GSK-3β)、钙离子(Ca2+)、蛋白激酶C(PKC)等,导致胞内葡萄糖转运体4(GLUT4)、葡萄糖转运体3(GLUT3)不能有效及时进行膜转位,造成葡萄糖转运迟滞,从而血糖水平不降反升.
3.2 运动疲劳后树突棘数量及形态变化
树突棘是兴奋性神经元树突分支上的微小突起.树突棘与突触超微结构密切相关,是绝大多数兴奋性突触在体条件下的突触后结构基础,包括膨大的棘头和狭窄的棘颈[18],可将兴奋性突触的PSD和相关的细胞器包裹在树突棘的局部范围内,使其成为一个相对独立于树突支干的电信号和生化信号单元[19].在哺乳动物的生命周期中,大脑树突棘的密度呈现高度的动态变化特征,先后经历发生、修剪、成熟、消失4个阶段[20].这种密度的动态性变化隐含着神经环路的强化、弱化及调整,是突触可塑性的重要表现,与之相伴随的是形态结构的多样性,一般认为短粗型和蘑菇型是成熟型树突棘,常参与突触后结构的重塑.
由本实验结果可知,第7 d力竭运动后,实验组大鼠树突棘密度及数量显著增加(P<0.05),而树突棘平均长度在两组之间无显著性差异(P>0.05).李晓康等[21]的研究提示,旋转运动刺激可引起大鼠中央杏仁核神经元树突棘数量增加.白石等[22]实验结果发现,8 W循环流水运动实验,可致训练组大鼠大脑皮质运动区V层及小脑浦肯野氏神经元树突棘密度显著增高.Petzinger等[23]研究表明,大强度跑台运动可以使健康小鼠纹状体神经元树突棘密度、数量显著增加.Stranahan等[24-25]的研究结果显示,自主跑轮运动使成年大鼠神经元树突棘密度增加,这些均与本实验结果一致.现已知,运动性疲劳的发生是一个渐进的累积过程,力竭只是运动性疲劳的终点.这种数量及密度的显著增加,既有树突棘修剪走向成熟阶段的内在因素使然,也有运动刺激触发的适应性外在原因存在,更有深层次的发生方面原因.目前,树突棘的形成有3种假说:伪足说、Miller/Peters说及Sotelo说[10,26],因伪足说与Sotelo说主要论点相近、并多有重合,且Sotelo说被广泛接受和认可,因此学界普遍接受Sotelo说的观点,认为树突棘结构的形成可能先于突触联接的建立,并在一定时间内等待轴突末端的到来,从而形成突触联接[10].依此学说,树突棘密度及数量的显著增加,预示着突触联系的可能增加,突触整合作用随之强化,从而及时调控运动神经元的兴奋性,并延搁运动性疲劳的发生.
另外,树突棘形态方面,本实验结果显示,细长型占比有所增高、分叉型占比有所下降,但都不具统计学意义;短粗型占比非常显著(P<0.01)下降,蘑菇型占比非常显著(P<0.01)升高.有研究提示,高频刺激使突触前神经递质释放增加,引发突触后出现长时程增强(LTP)现象,并表现为树突棘数量的增加和棘头的增大;相反,低频刺激触发的长时程抑制(LTD)会使树突棘逐渐萎缩、脱落,表现为树突棘数量的减少和体积的缩小[27].但出现这些变化的内在机制有待进一步研究.众所周知,树突棘的形态依赖于其内富含的细胞骨架,或可从细胞骨架及相关基因表达方面探寻蛛丝马迹.
3.3 相关基因qRT-PCR结果
采用比较Ct法的相对定量结果评判目的基因扩增效果,以2-ΔΔCt呈现扩增倍数.从实验结果可知,目的基因F-actin,MAP2,Tau的相对表达量分别是CG组的1.33,1.06,1.71倍.现已知,树突棘内的细胞骨架主要是微丝,又称纤维状肌动蛋白(F-actin),在神经元胞体及树突内均有存在,并积极参与突触后神经活动.丰富的F-actin使树突棘具有高度的动力性和可变性,微丝动态性的聚合和解聚改变着树突棘的形态,如解聚时树突棘缩小,聚合时树突棘则扩大[28].除微丝外,神经元内还含有微管及其伴随组装和去组装存在的微管相关蛋白(MAP),在诸多微管蛋白中,研究较清楚的是MAP2和Tau.一般认为,MAP2存在于神经元的胞体和树突,而Tau多存在于轴突.神经元可将MAP2mRNA运输到树突远端,且具有极大的选择性,将特异性的mRNA运输到树突并在此翻译成蛋白质,可能是蛋白质特异性的分布于神经元不同部位的一种手段,其机制或与突触部位活动情况相关联.从本实验结果来看,分布于树突中的MAP2mRNA表达量与对照组几近相同,而F-actin及Tau mRNA的表达量均显著增高,据此可以推测,因运动疲劳引发的突触可塑性可诱使不同mRNA特异性分布,造成本实验树突棘数量、密度及形态变化的主要因素是F-actin及Tau mRNA,而非MAP2mRNA.
另外,MAP2通过聚合反应调节微管的稳定性,并促进其组装,参与神经元形态构建、细胞器转运等生理过程,其表达的增强是树突生长的标志[29].Tau在大脑组织中含量很高,但Tau蛋白的磷酸化水平却很低,其与微管的结合能力受制于丝氨酸(Ser)和苏氨酸(Thr)的磷酸化水平,且这种磷酸化水平受多种因素调节,GSK-3β便是其中之一[30].房国梁等[31]的研究提示,有氧运动通过PI3K/Akt信号通路抑制GSK-3β的活性,降低大鼠海马组织Tau蛋白的磷酸化水平.
同时,树突棘形态的可塑性变化多由复杂的分子信号网络介导,并受神经活动的精准调控.有关树突棘膨大过程中形态变化与分子动态变化的顺序性研究显示[32-33],sLTP发生后,受局部高频谷氨酸刺激后1 min内,树突棘结构即可发生膨大,同时在树突棘内肌动蛋白(actin)、丝切蛋白(cofilin)等相关蛋白开始聚集;随后的1~4 min内,谷氨酸受体亚基、钙信号相关分子等在蛋白质水平开始升高;在晚期sLTP,突触后脚手架蛋白等才开始聚集.在这些分子的动态聚集中,cofilin水平的上升出现最早,且其上升幅度大于树突棘体积增大的幅度[33].这种顺序性变化的结果可理解为sLTP发生后,因兴奋性递质分泌量突增的刺激,树突棘内细胞骨架蛋白随即开始聚集,而后其体积增大,随后才有谷氨酸受体亚基及相关信号分子蛋白水平的上升,最后脚手架蛋白等才开始聚集.这或许可解释本实验F-actin,MAP2,Tau的相对表达量变化及与树突棘形态、数量变化之间的内在逻辑关系及机理.
乔德才等[34-35]的研究显示,运动疲劳时纹状体Glu和GABA浓度变化是导致神经元兴奋性改变及运动能力降低的重要原因.据此推测,运动疲劳状态下,Glu暂时性的高分泌激活NMDA受体等介导的信号通路,大量Ca2+内流致使胞内钙超载,Ca2+既可与CaM结合激活CaMKⅡ、也可与质膜内侧的DAG协同激活PKC,从而触发一系列级联酶促反应,导致细胞骨架蛋白、特别是F-actin及微管相关蛋白Tau的聚合或解聚,最终表现为树突棘数量和形态的改变.
另外,现已知,PI3K/AKT/GSK-3β信号通路与胰岛素及其受体、受体底物直接关联,是胰岛素信号转导胞内的主要下游信号途径,并参与葡萄糖稳态、细胞骨架蛋白表达、神经元稳态、细胞凋亡、肿瘤发生等生理生化过程.有实验结果提示,外周葡萄糖代谢障碍或胰岛素功能低下时,体外培养的人神经元的 GSK-3β可由非活化型转变为活化型,致使Tau蛋白磷酸化[36].在敲除小鼠神经元膜上的胰岛素受体基因的实验中,发现血糖明显升高,大脑组织GSK-3β活性明显改变、Tau蛋白过度磷酸化[37].由此可见,糖代谢障碍时,GSK-3β与Tau蛋白之间会产生一定的联系.基于上述机理,运动疲劳后纹状体神经元F-actin及Tau mRNA的高表达可致树突棘数量、密度显著增加,且蘑菇型及短粗型树突棘占比极显著改变.
4 结束语
从实验结果可知,运动疲劳即刻大鼠血糖显著增高,纹状体神经元树突棘密度和数量显著增加,蘑菇型树突棘占比极显著增高、而短粗型树突棘占比却极显著下降,F-actin及Tau mRNA相对表达量升高.其发生机制可能为:运动疲劳状态下,GluR介导的NMDA构象(Ca2+浓度)发生改变、或PI3K/AKT/GSK-3β等信号通路被激活或抑制,触发相应的级联反应,致血糖升高而使葡萄糖失稳态,并与作为应激刺激的运动疲劳效应相互叠加,产生协同作用,导致F-actin及Tau mRNA基因相对表达量上调,并最终表征为树突棘形态、数量及密度的可塑性变化.

