NLRP3炎性小体在辐射诱导肝损伤中的作用
丁艳平,张培怡,董晓庆,李昕妍,马一凡
(西北师范大学 生命科学学院,甘肃 兰州 730070)
电离辐射(Ionizing radiation, IR)在医学上常用于肿瘤和癌的放射治疗[1],其对人体损伤程度可因辐射剂量及机体辐射敏感度而异.对正常组织辐射毒性机制的评价表明,炎症在早期和晚期IR的不良反应中起着重要作用.近年来,有研究表明,核苷酸结合寡聚化结构域(NOD)样受体蛋白3(NLRP3)炎症小体的表达上调在辐射损伤中起关键作用[2].NLRP3炎症小体作为激活Caspase-1的多蛋白复合物,可导致白介素-18(IL-18)和白介素-1β(IL-1β)等促炎细胞因子成熟[3].研究表明,NLRP3炎症小体的上调对辐射损伤有很大影响,其中包括辐射引起的口腔粘膜炎[4-5]、皮肤反应[6]、肺损伤[7-8]、肠道损伤[9].前期的实验表明,辐射会对肾[10]和肺[11]的功能及组织学水平、细胞学水平造成不同影响,但是辐射对肝脏的损伤及NLRP3炎症小体在肝脏放射损伤中的作用鲜有报道.文中通过Co60γ辐射建立小鼠辐射模型,检测辐射对小鼠肝脏形态、功能及NLRP3炎症小体信号通路的影响.
1 材料与方法
1.1 实验动物
雄性昆明小鼠(20~25 g)购于兰州大学医学院动物实验中心,动物许可证号:SYXK(甘)2018-0002.饲养室内温度保持在23±2 ℃,明暗周期12 h,自由饮水和进食.将小鼠随机分为2组:对照组(Control组)和辐射组(IR组),每组20只.IR组在兰州维特辐照公司进行8Gy的Co60γ射线全身一次性均匀辐射.
1.2 样本采集
将每组10只小鼠进行灌流固定,取肝脏做苏木精-伊纪(HE)染色和免疫荧光染色;另外10只小鼠眼眶静脉采血后断颈处死,迅速在肝脏取2 mm3大小的组织固定于2.5%戊二醛中用于电镜检测,剩余的肝组织在-80 ℃保存用于免疫印迹(Western blotting)检测.血液样本以2 000 r·min-1离心10 min,取血清送检,其中的丙氨酸氨基转移酶(AST)和天冬氨酸氨基转移酶(ALT)水平作为肝功能的指标.电镜样本的制作、拍照和血清样本的检测均交由武汉赛维尔生物科技有限公司完成.
1.3 肝组织HE染色和免疫荧光染色观察
HE染色:取上述固定的各组小鼠肝组织,进行常规石蜡包埋,连续切片(8 μm)后用HE染色,在显微镜下进行观察及拍照.
免疫荧光染色:石蜡切片经脱腊、修复、封闭后用NLRP3一抗(兔抗-NLRP3,博奥森)4 ℃孵育过夜,用荧光素标记的二抗异硫氰酸荧光素(FITC)37 ℃孵育30 min后,再用4,6-二脒基-2苯基吲哚(DAPI)染液室温孵育15 min,最后用甘油缓冲液封片,在荧光显微镜下观察拍照.
1.4 Western blotting检测相关蛋白表达
将-80 ℃冻存的肝脏组织按照提取总蛋白的方法提取肾总蛋白,用二辛酸(BCA)法对蛋白进行定量.取蛋白于10%的SDS-聚丙烯酰胺凝胶中电泳分离,湿转至聚偏氟乙烯(PVDF)膜上.5%脱脂奶粉封闭1 h,将一抗(NLRP3, Caspase-1,IL-1β)4 ℃摇床孵育过夜,TBST洗膜5次,每次5 min;二抗室温摇床孵育2 h,TBST清洗5次,每次5 min,电化学发光法(ECL)检测液放射自显影.显影结果用Image J进行条带分析,结果用甘油醛-3-磷酸脱氢酶(GAPDH)校正.各抗体稀释比均为1∶1000.
1.5 统计分析
蛋白数据先用ImageJ进行灰度值取值,收集的数据用SPSS17软件进行处理,单因素ANOVA进行标准误差以及显著性分析,最后用Origin 7.5作图.
2 结果
2.1 肝组织HE染色和透射电镜观察
从肝脏的HE染色可以看出(图1),肝细胞排列成索状,围绕中央静脉呈放射状排列,肝细胞索有分支,彼此吻合成网.相较于对照组,辐射组的肝脏表现出肝细胞索排列紊乱,肝窦明显变宽且肝细胞形状发生空泡变性,呈现病理特征.
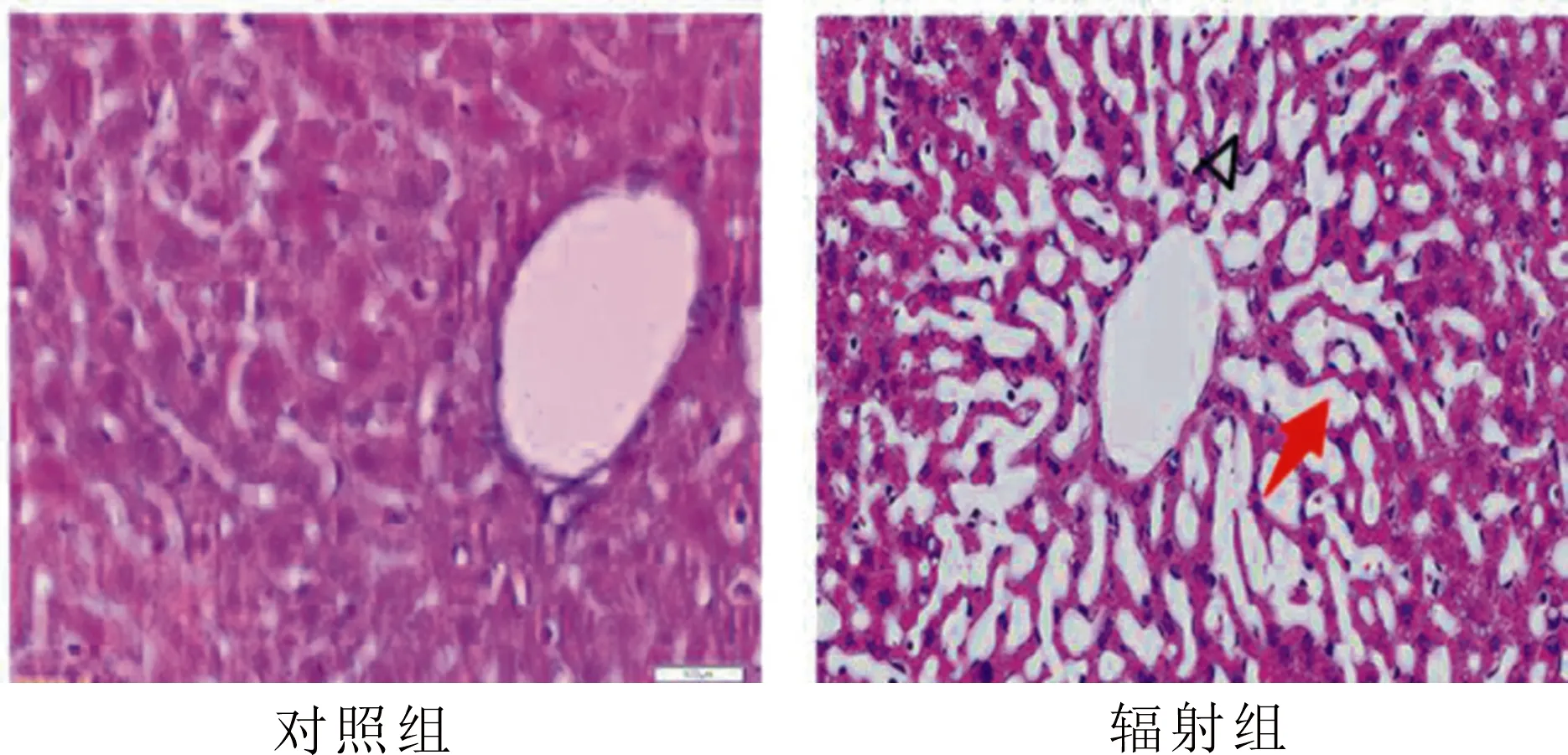
注:箭头指向肝窦;三角指向空泡变性
用透射电镜观察辐射对小鼠肝细胞的病理损伤的影响.如图2所示,对照组正常肝细胞的超微结构特点为:细胞核圆润,线粒体、粗面内质网、糖原颗粒分散在细胞质中,肝细胞间可见胆管并且肝细胞间细胞边界明显.辐射组相对于对照组细胞核固缩,糖原颗粒的随机散布变少,肝细胞边缘消失,细胞质呈海绵状,粗面内质网明显扩张,胆管管腔内可见电子致密物(黄色箭头).表明辐射可以引起肝脏组织超微结构的损伤.

N:肝细胞核;cb:细胞边界;箭头所指为胆管
2.2 对肝功能生化指标的检测
ALT和AST是肝功能损伤检测的重要指标.ALT参与人体蛋白质新陈代谢,可加快体内氨基酸的转移,主要存在于肝细胞的细胞浆;AST能促进蛋白质氨基转化作用.如图3所示,IR组小鼠血清ALT(图3a)和AST(图3b)明显高于Control组(P<0.001).说明辐射会引起肝脏功能损伤,辐射后肝脏会发生代谢功能改变,辐射诱导肝细胞释放化学物质,随后进入血液循环.

与对照组相比, ***P<0.001
2.3 肝组织中NLRP3表达情况
NLRP3是NLRP3炎性小体的重要配件,在肝细胞的胞浆中表达,免疫荧光法检测其阳性表达位于胞浆.如图4所示,细胞质中的NLRP3阳性表达为绿色荧光,肝细胞的核进行DAPI染色呈蓝色荧光,将二者融合得到Merge图像,检测NLRP3炎性小体在肝细胞中的位置和表达情况.结果发现对照组中NLRP3阳性细胞很少,辐射组的阳性表达对比对照组的NLRP3阳性表达明显升高,说明辐射可以激活肝脏NLRP3炎性小体.

图4 对照组和辐射组肝脏NLRP3(绿色)免疫荧光表达(400×)
2.4 肝组织中的NLRP3,IL-1β,Caspase-1的蛋白表达
为检测辐射诱导激活NLRP3炎症信号通路,测定了肝组织中的NLRP3,IL-1β,Caspase-1的蛋白表达变化.如图5所示,与对照组相比,辐射处理后NLRP3,IL-1β,caspase-1蛋白表达量明显呈上升趋势,具有极显著性差异(分别为P<0.01,P<0.001,P<0.001).结果提示,辐射可以激活肝脏NLRP3炎性小体通路.
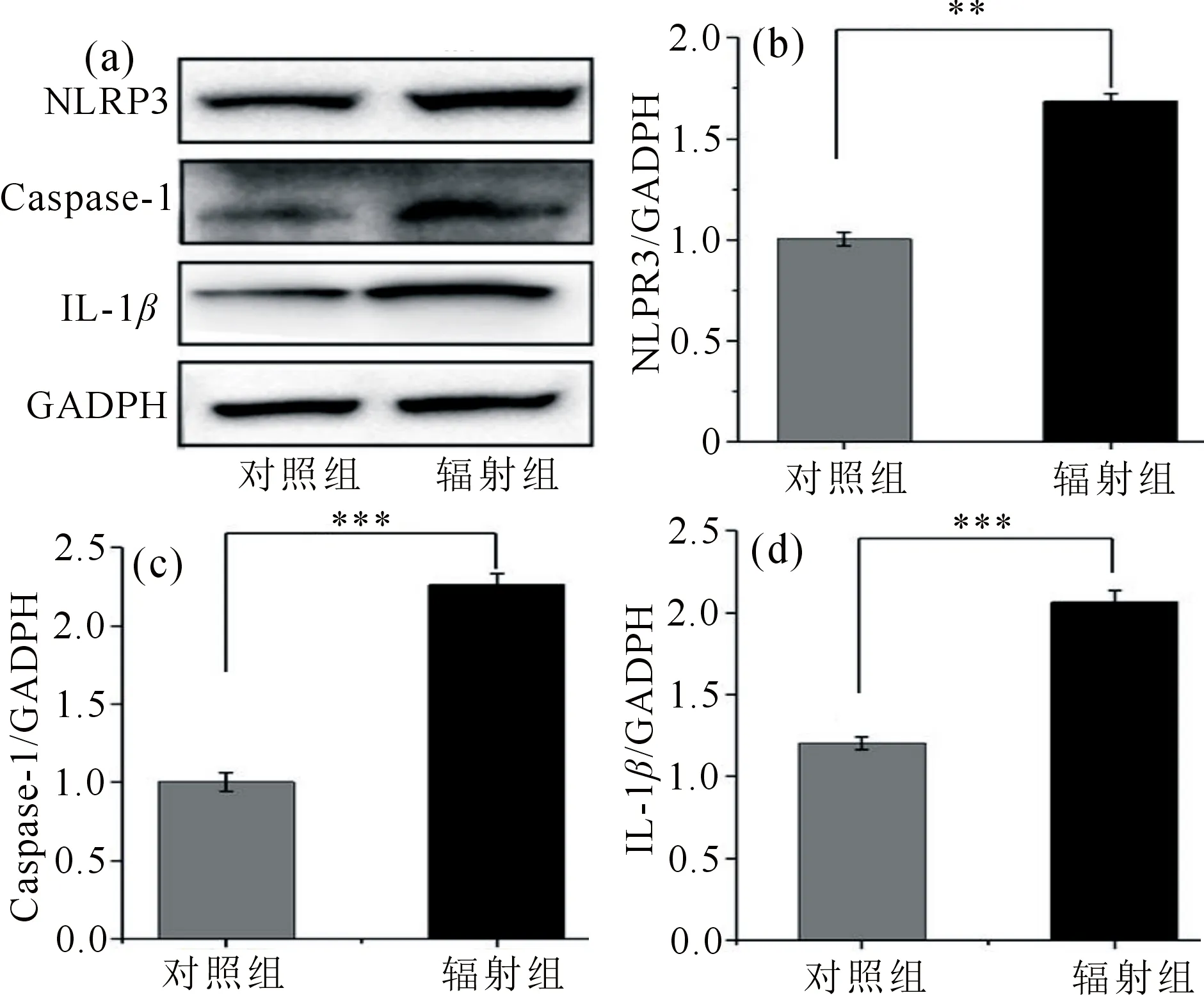
a为NLRP3,Caspase-1,IL-1β在肝组织的Weastern Blotting的结果; b,c,d分别为小鼠肝中NLRP3, Caspase-1,IL-1β蛋白的相对灰度值变化统计图,以GAPDH为内参(**P<0.01, ***P<0.001)
3 讨论
研究表明,4.5 GHz手机辐射电磁场可使大鼠肝脏组织出现窦样扩张、局灶性滤过、枯否细胞减少、肝细胞脂肪变性等[12].频率为2.45 GHz的电磁场中大鼠肝脏组织会出现中度充血、肝窦扩张、肝小叶内小的炎性球囊炎,电镜下可见肝细胞有不同大小和形状的囊泡、脂滴和光滑内质网的增生[13].本实验HE染色病理检测结果表明,相较于对照组,辐射组的肝脏表现为肝细胞索排列紊乱、肝窦明显变宽且肝细胞形状发生气球样变;超微结构也表现出核固缩、肝细胞边缘消失、细胞质呈海绵状等变化,这与有关研究结论一致[14-15],说明Co60γ照射可对小鼠肝脏造成形态学损伤.在暴露于电磁场的母鼠所生的仔鼠肝脏辐射模型中,ALT和AST水平明显升高[16].ALT与AST为临床肝功能检测指标,其含量增高常常与肝损伤程度成正比.Eassawy等研究表明,过量使用APAP或γ射线治疗大鼠会引起肝毒性,导致肝酶活性(ALT,AST,碱性磷酸酶,谷胺酰转肽酶,乳酸脱氢酶和苹果酸脱氢酶)显著增加[17].本实验结果表明,辐射组血清中ALT,AST水平较对照组极显著升高,这与Abou-Zeid等的研究结果一致[18],表明Co60γ照射可对肝功能造成损伤.
炎症小体既能识别病原相关分子模式,又能识别宿主来源的危险信号分子,所以通常被认为是一种大型的细胞内信号转导平台,其中包含胞质模式识别受体,尤其是核苷酸结合的寡聚化域样受体(NLR)或黑色素瘤中缺失的一种2型受体(AIM2)[19].在NLR炎性小体复合物中,NLRP3炎性小体的作用最为突出,NLRP3炎性小体可以调控两种促炎白细胞介素-1家族细胞因子IL-1β和IL-18的激活,IL-18和IL-1β的积累通过募集嗜中性粒细胞和加速肝脏病理而充当促炎介质[20-21].NLRP3炎症小体的激活和组装机制仍存在争议,目前普遍认为NLRP3炎症小体有3种激活模式:第1种激活模式认为ATP作为NLRP3激动剂,使细胞外的NLRP3激动剂进入细胞质,参与NLRP3的形成;第2种激活模式认为颗粒结构或晶体结构,包括石棉、尿酸钠、硅、淀粉样蛋白可作为激动剂,吞噬细胞吞噬这些激动剂导致溶酶体损伤,进而导致溶酶体内容物的胞质释放,通过组织蛋白酶依赖的NLRP3配体过程;第3种激活模式中,所有的病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)都会触发活性氧(ROS)的产生.硫氧还蛋白互作蛋白(TXNIP)是NLRP3的配体,且对ROS敏感.在正常生理条件下,氧化还原酶硫氧还蛋白(TRX)与TXNIP结合,并抑制其活性;当细胞内ROS浓度增加时,该复合物解离,TXNIP与NLRP3(主要是亮氨酸富集的重复区LRRs结构域)结合进而触发NLRP3炎症小体的形成[2].在NLRP3与肝脏相关的研究中发现,在非酒精性脂肪肝炎(NASH)患者中,NLRP3和IL-1β水平与肝纤维化呈正相关,而且NASH的发展与肝细胞内NLRP3炎性小体的激活和Kupffer细胞内Caspase-1的激活有关[22-23],Casp1基因敲除小鼠和Kupffer细胞衰竭的野生型小鼠表现出较轻的饮食诱导的脂肪性肝炎[24-25];在不同小鼠食源性脂肪肝模型中,NLRP3和成熟IL-1β水平升高也与肝纤维化呈正相关[26].此外,Nlrp3基因敲除小鼠表现出明显的肝损伤和纤维化保护作用,而三苯氧胺诱导的Nlrp3敲除小鼠表现为肝损伤和纤维化的加速[27-28].还有研究表明,药物抑制剂BAY 11-7082抑制NLRP3激活降低了Caspase-1以及IL-1β生产,从而减少和改善食源性肝病[29];番茄红素通过促进Nrf2/HO-1通路的激活,进一步抑制NLRP3炎症体,减轻肝脏损伤[30].
研究表明,机体中的水大约占了80%以上,而辐射损伤主要来自于水的辐射分解,进而诱导产生ROS,因而ROS是放射后正常组织损伤的主要来源[31].线粒体障碍、mtDNA和mtROS的释放是NLRP3炎性小体激活的重要触发因素,NLRP3激活因子诱导NLRP3进行自身寡聚化,招募凋亡相关斑点样蛋白(ASC),后者组装成丝状结构招募并使pro-Caspase-1自身剪切活化,活化的Caspase-1剪切pro-IL-1β和pro-IL-18,使之成熟并引起下一步炎症反应.本实验研究结果表明,辐射后,肝脏内NLRP3,IL-1β,Caspase-1蛋白表达量明显呈上升趋势,结合已有文献可以推测,当机体暴露在辐射下时,受损的线粒体会释放ROS,激活NLRP3炎性小体通路,进而激活Caspase-1,产生炎性细胞因子IL-1β,并在体内聚集从而引起肝功能损伤.因而,可以NLRP3为作用靶点,通过抑制NLRP3炎性小体的激活,减轻辐射诱导的肝损伤.

