基于高通量测序技术分析恩施州淡豆豉的细菌多样性
马上超,程 超,田 成,陈 业,莫开菊,汪兴平,
(1.湖北民族大学生物科学与技术学院,湖北 恩施 445000;2.生物资源保护与利用湖北省重点实验室(湖北民族大学),湖北 恩施 445000)
豆豉是以大豆为主要原料,经过浸泡蒸煮,自然发酵或者纯菌种接种发酵而成的传统豆制品[1]。根据发酵菌种不同,可分为曲霉型、毛霉型、根霉型和细菌型4 种[2];根据生产工艺不同,可分为水豆豉、冻豆豉、霉豆豉、干豆豉。大豆经微生物发酵后,产生独特的豆豉风味,同时产生黄酮、低聚肽、皂苷、豆豉纤溶酶等活性物质[3],具有一定的药用价值,对消化不良、烦躁胸闷、焦躁不安有一定的缓解作用。日本纳豆富含纳豆激酶,通过长期深入的优势菌种筛选和优化,培养获得高产纳豆激酶的菌种,纳豆及其健康产品得到长足发展,而我国传统豆豉营养丰富、种类多样,但离产业化、健康化差距较大。因此,我国科技工作者亟需开展豆豉微生物菌群的多样性研究,从众多优势菌群中筛选具有医疗保健价值的菌株,促进传统豆豉的现代化发展。
高通量测序技术能更全面、精确地测定生物环境中各类微生物的相对丰度[4],已广泛用于分析各种发酵产品的微生物群落结构[5]。李世瑞等[6]采用454高通量焦磷酸测序技术发现曲霉型豆豉发酵中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)为优势细菌门。王强等[7]采用Illumina MiSeq高通量测序技术对湖南省龙山县传统发酵豆豉细菌多样性进行研究,结果表明,其优势细菌门为厚壁菌门,相对丰度为7.43%,优势细菌属芽孢杆菌属(Bacillus)和魏斯氏菌属(Weissella),相对丰度分别为21.46%和15.83%。Chen Yuhang等[8]研究中国西南地区水豆豉微生物多样性,发现其优势菌门为厚壁菌门、拟杆菌门和变形菌门,主要优势细菌属为芽孢杆菌属、拟杆菌属(Bacteroides)和乳酸杆菌属(Lactobacillus)。庞春霞等[9]采用Illumina MiSeq高通量测序技术分析纳豆、豆豉、大酱、霉豆渣、天贝的细菌多样性,其中相对丰度大于10%的主要优势菌属为芽孢杆菌属、枝芽孢菌属(Virgibacillus)、变形杆菌属(Proteus)、依格纳季氏菌属(Ignatzschineria)、四联球菌属(Tetragenococcus)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、解脲芽孢杆菌属(Ureibacillus)、泛菌属(Pantoea)和片球菌属(Pediococcus)。通过以上研究发现,豆豉种类、产地不同,主要的优势菌也有差异。
我国生产制作细菌型豆豉的地区很多,如云南、湖南、贵州、山东、湖北等地。湖北恩施山区气候宜人,独特的饮食文化孕育了种类繁多的豆豉产品,恩施传统豆豉以作坊式生产为主,生产环境条件相对粗放且制作微环境差异大,但目前缺乏对恩施豆豉的微生物菌群特征的系统研究。因此本实验收集恩施州不同产地5 种细菌型淡豆豉,利用Illumina PE250高通量测序技术对16S rRNA V3~V4区进行测序,分析恩施地区豆豉发酵微生物菌群结构,初步鉴定其优势菌群,以期推进恩施豆豉的现代化生产,为提高恩施地区豆豉质量和深度开发保健性、安全性产品奠定理论基础。
1 材料与方法
1.1 材料与试剂
样品来源于湖北民族大学周边2 km内及利川市关东村5 个不同商家制作的传统自然发酵细菌型淡豆豉,制作时间均为12月初。选取5 种未经后加工的细菌型淡豆豉毛坯,使用已紫外灭菌的勺子取发酵坛内部豆豉,现场分装于灭菌离心管,液氮冷冻运回实验室,存放于-80 ℃冰箱备用,使用15 kg干冰进行样品寄送。样品编号分别为S1、S2、S3、S4、S5。
D3141 HiPure Stool DNA Kits 广州美基生物科技有限公司;无水乙醇 广州化学试剂厂;琼脂糖 西班牙Biowest公司;GoldView I型核酸染色剂 武汉富鑫远科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)用试剂 美国New England Biolabs公司;AMPure XP磁珠 美国贝克曼库尔特公司。
1.2 仪器与设备
5427R离心机 德国艾本德股份公司;TM-D超纯水仪器 上海乐枫生物科技有限公司;DWHL528S-80 ℃冰箱 中科美菱低温科技股份有限公司;Mix-28+涡旋振荡器 广州围谷润仪器有限公司;NanoDrop 2000微量分光光度计、Qubit 3.0荧光计 美国赛默飞世尔科技公司;DYY-6C琼脂糖凝胶电泳仪 北京六一仪器厂;Tanon-2500凝胶成像系统 上海天能科技有限公司;ETC811 PCR仪 苏州东胜兴业科学仪器有限公司。
1.3 方法
1.3.1 豆豉样品中总DNA的提取和鉴定
取-80 ℃中保存的S1、S2、S3、S4、S5样品,充分破碎搅拌,取200 mg豆豉样品于离心管中,按照R Stool DNA试剂盒说明书提取总DNA。对提取的基因组DNA产物用2%琼脂糖凝胶电泳进行检测,目的条带大小正确,浓度合适,将检测合格样品进行高通量测序,每组做4 次生物学重复。
1.3.2 豆豉16S rRNA高通量测序
以豆豉总DNA为模板进行细菌16S rRNA V3~V4区域扩增。引物:341F(CCTACGGGNGGCWGCAG)和806R(GGACTACHVGGGTATCTAAT)。PCR扩增体系和程序参照Guo Mengjiao等[10]的方法并略作改动。第1轮PCR扩增体系:模板100 ng,2 mmol/L dNTPs 5 µL,10×Buffer KOD 5 µL,10 μmol/L正向引物1.5 µL,10 μmol/L反向引物1.5 µL,25 mmol/L MgSO43 µL,KOD 1 µL,无菌双蒸水33 µL。第1轮PCR扩增程序:94 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸30 s,共循环30 次;68 ℃再延伸5 min。利用AMPure X磁珠纯化第1轮PCR产物,纯化后用Qubit 3.0荧光计定量。第2轮PCR扩增体系:模板100 ng,2 mmol/L dNTPs 5 µL,10×Buffer KOD 5 µL,25 mmol/L MgSO43 µL,10 μmol/L索引引物1 µL,10 μmol/L通用PCR引物1 µL,KOD 1 µL,无菌双蒸水34 µL。第2轮PCR扩增程序:94 ℃预变性2 min,98 ℃变性10 s,65 ℃退火30 s,68 ℃延伸30 s,共循环12 次,68 ℃再延伸5 min。使用AMPure XP磁珠纯化第2轮扩增产物,用StepOnePlus Real-Time PCR System进行定量,根据Novaseq 6000 PE250进行混合测序。
1.4 数据分析
使用Illumina PE250对高通量测序数据进行操作分类单元(operational taxonomic units,OTU)聚类分析、物种注释、α多样性分析、β多样性分析[11-15];使用R语言工具进行主成分分析(principal components analysis,PCA)、非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类树、物种间相关系数计算和检验;使用R语言工具进行稀释曲线、Shannon曲线、Simpson曲线、群落热图绘制;使用Omicsmart平台(http://www.omicsmart.com)进行生物信息学分析。
2 结果与分析
2.1 细菌多样性分析
由图1可知,随着测序量增大,测序检出的OTU数量先增加后逐渐趋于平缓,表明继续延长测序时间没有更多物种被检出,说明本次测序数据量合理,能够较好反映出20 例恩施州豆豉样品中的菌群信息。
从20 例恩施细菌型淡豆豉中共得到2 528 835 条序列,筛选出2 380 484 条高质量序列,平均每个样品119 024 条高质量序列(范围:107 609~131 494 条,标准偏差:6 705 条),平均序列有效性达92.5%。对这些序列进行分析,共得到3 901 个OTU(范围:90~264 个,标准偏差:52 个),经对比匹配,这些OTU可以划分为17 门、24 纲、43 目、78 科、152 属以及93 种。
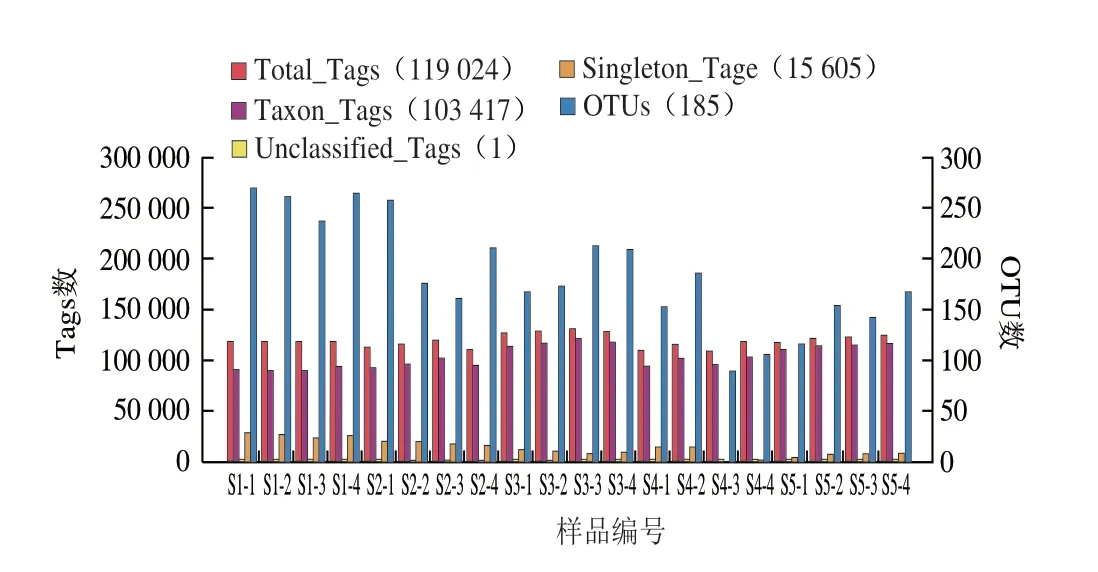
图2 20 例样品中Tags及OTU数Fig.2 Statistics of the number of tags and OTUs in 20 samples
2.1.1α多样性分析
由表1可知,样品的OTU覆盖率均为100%,说明测序结果可以反映5 种豆豉样品中细菌多样性。Chao指数和ACE指数体现物种的丰富度信息,数值越大,多样性越高;Shannon指数和Simpson指数综合体现物种的丰富度和均匀度,数值越大,多样性越高。S1、S2、S3物种多样性和丰富度较高;S4、S5物种多样性和丰富度较低,S4的Shannon指数和Simpson指数与其OTU数、Chao指数和ACE指数的趋势不一致。
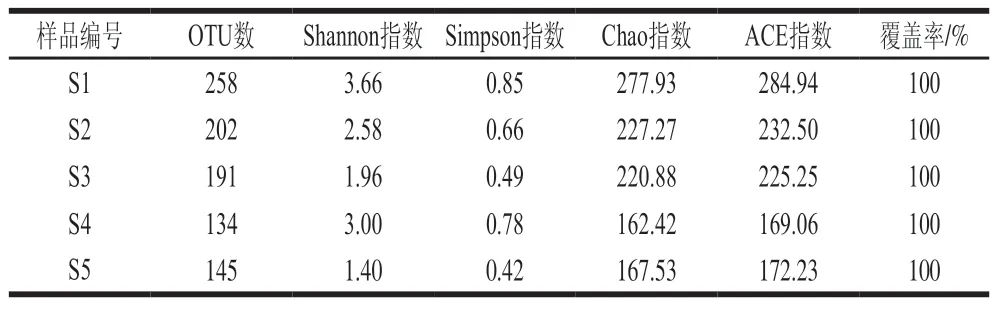
表1 样品组内多样性分析Table 1 Diversity analysis within sample groups
2.1.2β多样性分析
2.1.2.1 PCA
由图3可知,对各样本中细菌相对丰度进行PCA时,PC1和PC2的贡献率分别为67.47%和21.34%,累计贡献率达88.81%,说明能很好区分5 种豆豉细菌群落。S1分布于第3象限,S2、S4分布于第2象限,S3、S5分布于第1象限,分布于同一象限两组之间距离最近,且聚集度较高,说明其细菌群落结构较为相似。而第3象限的S1与第2象限的S2、S4在PC1上距离较近,因此,S1与S2、S4在微生物群落组成和结构上也存在一定相似。
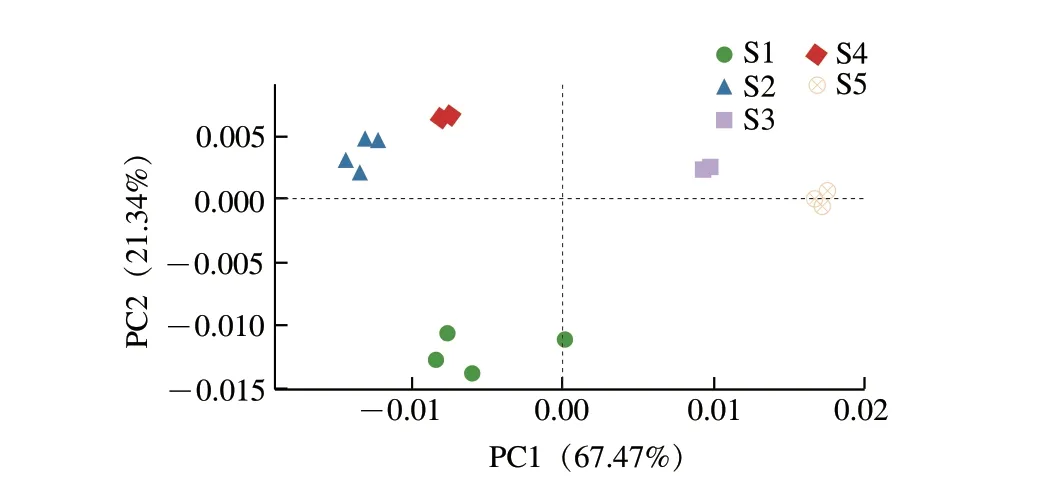
图3 属水平样品加权PCAFig.3 Weighted PCA at genus level
2.1.2.2 UPGMA聚类树分析
基于加权对样品属水平进行聚类分析,如图4所示,5 种豆豉样品可分为3 大类,S1独立为一簇(I),S2、S4聚类为一簇(II),S3、S5聚类为一个簇(III);且第I簇与第II簇菌群结构较接近,其结果与加权PCA结果一致。
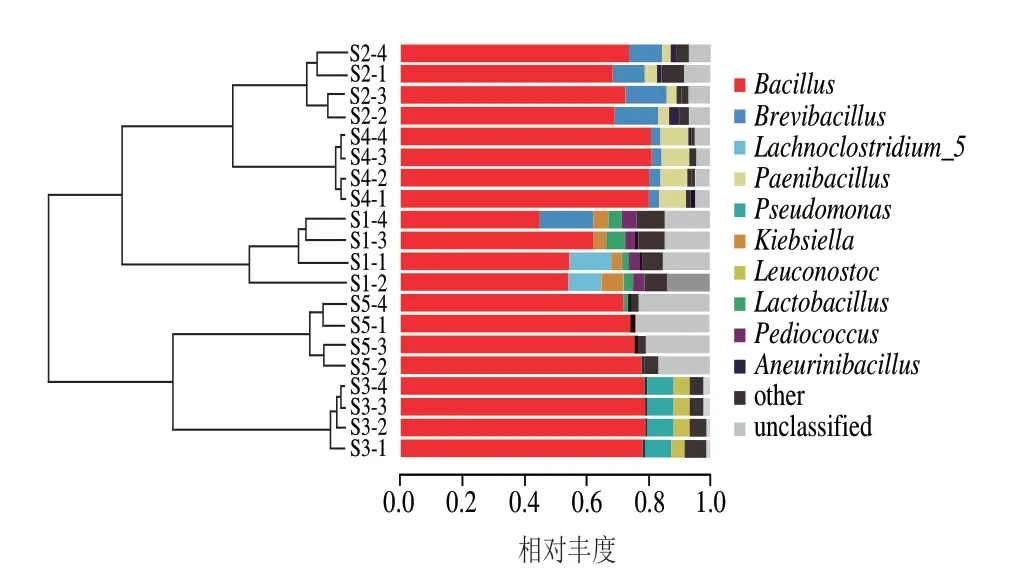
图4 样本间β多样指数UPGMA聚类图Fig.4 UPGMA clustering diagram of β-diversity index between samples
2.2 细菌群落结构分析
2.2.1 恩施豆豉门水平细菌群落结构分析
以平均相对丰度大于0.1%作为优势菌门的评判标准,由图5可知,恩施细菌淡豆豉中优势菌门分别为厚壁菌门(88.18%(平均相对丰度,下同))、变形菌门(7.59%)、蓝细菌门(Cyanobacteria,4.05%)、放线菌门(0.10%),且5 种样品中优势细菌门丰度有所差异,S1中厚壁菌门(82.62%)和变形菌门(16.49%)为主要优势细菌门;S2和S4中均以厚壁菌门为绝对核心优势菌门(98.31%和99.42%);S3中厚壁菌门(84.68%)和变形菌门(14.02%)为主要优势细菌门;S5中厚壁菌门(75.88%)和蓝细菌门(18.42%)为主要优势细菌门。
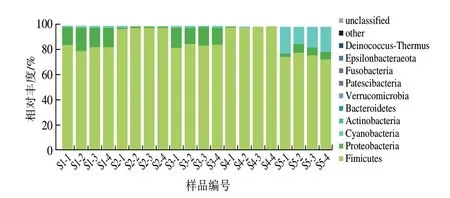
图5 样品中细菌门水平分布Fig.5 Distribution of bacterial phyla among samples
据报道厚壁菌门广泛存在于发酵食品中[16];Yang Lin等[17]研究发现中国传统豆豉的优势菌群为厚壁菌门、放线菌门和变形菌门;贵州水豆豉中的厚壁菌门为绝对优势菌,其次是变形菌门[18];江西豆豉中主要为蓝细菌门、厚壁菌门[19];湖南豆豉中,厚壁菌门为其主要优势菌群[20]。因此,在门水平上,各地细菌性豆豉的优势菌群有高度一致性,厚壁菌门是最普遍、最丰富的菌门。
2.2.2 恩施豆豉属水平细菌群落结构分析
选取所有样本中相对丰度均值前10 位的菌属作为优势细菌属,由图6可知,恩施豆豉的优势菌属分别为芽孢杆菌属(70.81%)、短芽孢杆菌属(Brevibacillus,3.20%)、梭状芽孢杆菌5(Lachnoclostridium_5,3.14%)、类芽孢杆菌属(Paenibacillus,2.50%)、假单胞菌属(Pseudomonas,1.87%)、克雷伯菌属(Klebsiella,0.97%)、明串珠菌属(Leuconostoc,0.97%)、乳杆菌属(Lactobacillus,0.84%)、片球菌属(Pediococcus,0.75%)、神经氨酸杆菌属(Aneurinibacillus,0.68%)。其中芽孢杆菌属为核心优势细菌属。不同样品中优势细菌属的丰度不同,芽孢杆菌属在S1、S2、S3、S4、S5中的相对丰度分别为48.77%、70.85%、78.89%、80.53%、75.04%。5 种样品中次要菌群各不相同,S1中为梭状芽孢杆菌5(15.24%),S2中为短芽孢杆菌属(12.18%),S3中假单胞菌属较丰富,相对丰度为8.82%;S4含8.80%的短芽孢杆菌属(Brevibacillus);S5含0.36%假单胞菌属。各样品中不可鉴定到属水平的序列含量相似,平均相对丰度为10.73%,说明恩施细菌型淡豆豉中仍有未发掘的细菌属。
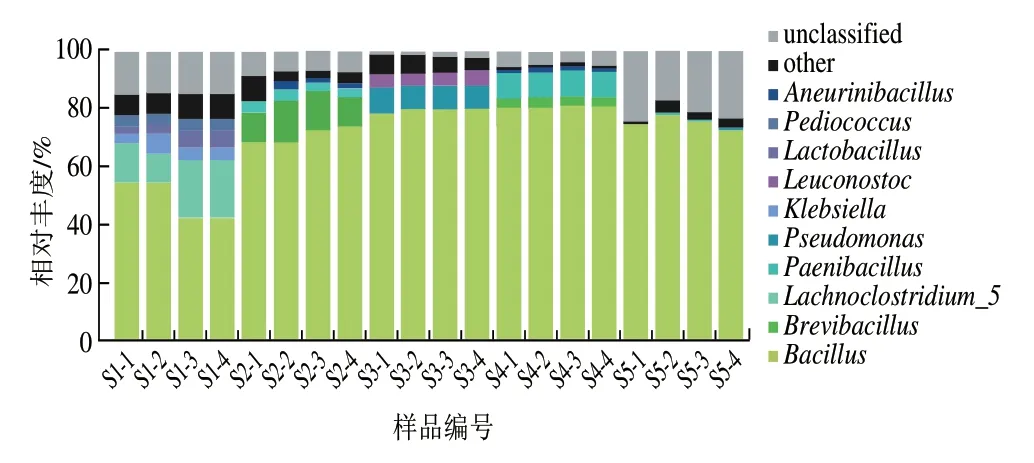
图6 样品细菌属水平分布Fig.6 Distribution of bacterial genera among samples
贵州水豆豉中芽孢杆菌属是绝对优势菌属,其次是变形杆菌属[18];江西豆豉主要为蓝细菌门未分类属(unclassified_Cyanobacteria)、葡萄球菌属(Staphylococcus)和乳杆菌属[19];湖南豆豉发酵过程中,芽孢杆菌属相对丰度高,乳酸菌种类较多、相对丰度较高[20]。由此可见,各地细菌型豆豉的发酵主要为厚壁菌门中芽孢杆菌属,可能由于地区间环境微生物和发酵制作工艺差异等,微生物群落结构中个别菌群存在差异,从而导致各地豆豉间风味和营养不同。在豆豉发酵过程中,芽孢杆菌属、乳杆菌属具有益生菌潜力[21]。神经氨酸杆菌和短杆菌属有助于豆豉香气形成[22],短杆菌发酵可以产生谷氨酸[23],而大多数假单胞菌可以产生一种或多种蛋白酶、脂肪酶和卵磷脂酶[24],从而增强豆豉的风味。
2.2.3 恩施豆豉种水平细菌群落结构分析
由图7可知,豆豉样品中不可鉴定到种水平的序列含量较高。样品S2、S3、S4中不可鉴定到种水平的序列水平相似,平均相对丰度为14.87%。S1中鉴定到种水平的序列相对丰度为36.64%,S5仅鉴定出2.64%的种水平序列。说明在S1、S5中有大量种水平细菌未被鉴定出。
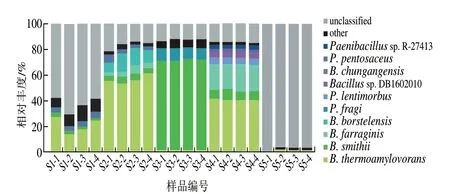
图7 样品细菌种水平分布Fig.7 Distribution of bacterial species among samples
5 种恩施豆豉种水平的优势细菌均为芽孢杆菌属,相对丰度前10 位的优势菌种分别为嗜热淀粉芽孢杆菌(Bacillusthermoamylovorans,23.77%)、史密斯芽孢杆菌(Bacillus smithii,17.16%)、苏云金芽孢杆菌(Bacillus farraginis,4.73%)、波茨坦短芽孢杆菌(Brevibacillus borstelensis,2.58%)、脆假单胞菌(Pseudomonas fragi,1.78%)、迟钝芽孢杆菌(Paenibacillus lentimorbus,1.68%)、类芽孢杆菌亚种DB1602010(Bacillussp.DB1602010,0.81%)、中港芽孢杆菌(Bacilluschungangensis,0.80%)、发酵乳杆菌(Pediococcus pentosaceus,0.74%)、类芽孢杆菌亚种R-27413(Paenibacillussp.R-27413,0.72%)。其中嗜热淀粉芽孢杆菌、史密斯芽孢杆菌为核心优势菌种,在5 种样品中均存在,但相对丰度有差异。S1中嗜热淀粉芽孢杆菌相对丰度为20.48%,S2中为56.22%,S3中为1.32%,S4中为40.02%,S5中为0.82%。5 种恩施豆豉中史密斯芽孢杆菌相对丰度为0.24%~70.36%,在S3中最丰富。此外,5 种样品中次要菌种差异较大,S1为戊糖片球菌(Pediococcus pentosaceus)(3.59%),S2、S4为苏云金芽孢杆菌(4.06%和19.23%),S3为脆假单胞菌(8.80%),S5为中港芽孢杆菌(0.13%)。
Chen Tingtao等[25]采用聚合酶链反应-变性梯度凝胶电泳发现枯草芽孢杆菌、解淀粉芽孢杆菌、假单胞菌、酿酒酵母和粉状毕赤酵母在大多数豆豉样品的菌群结构中具有显著地位。黄晓润等[26]研究发现,贵州自然发酵型水豆豉制曲和后发酵期间的优势菌种为枯草芽孢杆菌、嗜热淀粉芽孢杆菌和地衣芽孢杆菌(Bacillus licheniformis)。研究表明,豆豉发酵过程中,芽孢杆菌代谢产生的各种酶类使脂肪、蛋白质、碳水化合物和黄酮苷类分解转化为有机酸、氨基酸和糖苷配基等,是豆豉特有风味、营养形成的关键菌[27]。
3 结论与讨论
在5 种恩施州细菌型淡豆豉菌群结构中共鉴定出17 门、24 纲、43 目、78 科、152 属以及93 种。其中厚壁菌门占绝对优势,其次是变形菌门、蓝细菌门、放线菌门。优势菌种为厚壁菌门的芽孢杆菌属中的嗜热淀粉芽孢杆菌和史密斯芽孢杆菌。由于恩施豆豉为自然发酵生产,因此其微生物种属非常丰富,本研究中还检测到短芽孢杆菌属、梭状芽孢杆菌5、类芽孢杆菌属、假单胞菌属、克雷伯菌属、明串珠菌属、乳杆菌属、片球菌属、神经氨酸杆菌属。后期需深入研究恩施豆豉菌群中是否存在高产功能成分的菌种,以提高产品的健康性。
芽孢杆菌属作为核心优势细菌群,在细菌型淡豆豉的发酵过程中发挥至关重要的作用。日本纳豆中主要为芽孢杆菌属枯草芽孢杆菌亚种——纳豆芽孢杆菌(Bacillus natto)[28],其高产具有溶栓作用的纳豆激酶。国内多地利用高通量测序技术对豆豉的优势菌群进行研究,经对比分析,恩施州细菌型豆豉的优势菌群与甘肃[29]和贵州[18]相似,以芽孢杆菌属为主。芽孢杆菌属作为核心优势菌群,可产生大量的酶,如蛋白酶[30]和淀粉酶[31],因此,芽孢杆菌的存在可以加速豆豉的发酵过程,并提供其他细菌所需营养物质[32]。此外,各地豆豉呈现显著的细菌多样性,相应也表现出风味多样性。
本研究中S1、S2、S3、S5取样地点接近,样品的微生物菌群组成并未表现出地域相似性,β多样性分析显示S2与S4、S3与S5较相似,S1独立成一簇。因此,菌群的差异性主要来自于生产时的原始菌群和生产环境的微生物控制。
Chen Tingtao等[33-34]在豆豉制曲过程中检测到葡萄球菌、肠杆菌和气球菌等病原菌。贵州自然发酵水豆豉中检测到黏质沙雷菌(Serratia marcescens)、粪产碱菌(Alcaligenes faecalis)、蜡样芽孢杆菌和奇异变形杆菌(Proteus mirabilis)4 种致病菌[26];在云南豆豉中发现有属于人类致病菌和植物病原菌的序列[35]。本研究在S1中检测到梭状芽孢杆菌5(15.24%)、克雷伯菌属(4.68%)这类能引起炎症的病原菌,说明其在加工过程中可能被条件致病菌污染,其他样品中也存在微量梭状芽孢杆菌属、克雷伯菌属和沙雷氏菌。因此,在传统豆豉制作过程中应注意控制发酵条件以减少致病菌污染。

