红汁乳菇多糖的结构特征及对肠道菌群的影响
张馨方 程孟雅 杨 桥 常松林 任佳丽
(1. 林产可食资源安全与加工利用湖南省重点实验室,湖南 长沙 410004;2. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
肠道菌群的组成与健康、发育和疾病等诸多方面关联紧密[1],肥胖[2-3]、免疫[4]、炎症[5]、慢性肾病[6]等疾病受肠道菌群的影响尤为显著。研究[7-9]发现,饮食干预可以直接降低风险并维持肠道稳态。目前发现具有调节肠道菌群能力的益生元包括菊粉、低聚糖、半乳糖和葡聚糖[10-11],但这些物质也存在腹泻、胀气、便秘等不足,因此需要探索多样化的天然多糖作为替代物[12]。
红汁乳菇(Lactariushatsudake)是一种美味的食药用真菌,分布广泛[13],其中多糖是红汁乳菇中重要的生物活性成分[14-15]。由于人体消化酶不能直接分解多糖,多糖的消化吸收需要肠道微生物分泌的碳水化合物活性酶的帮助[16]。研究[17]证实,大多数多糖可调节肠道微生物群的丰度,如灵芝多糖可通过增加短链脂肪酸的产生来对抗氧化偶氮甲烷诱导的炎症、肿瘤的发生。研究拟提取红汁乳菇多糖LHP,并获得纯化的级分,分析其基本结构并探索其对肠道菌群的影响,旨在为肠道微生物群失调相关的病理治疗提供依据。
1 材料与方法
1.1 材料与试剂
红汁乳菇:经ITS测序鉴定为红汁乳菇(Lactariushatsudake),市售;
无水乙醇、正丁醇、氯仿:分析纯,国药集团化学试剂有限公司;
半乳糖(Gal)、葡萄糖(Glc)、鼠李糖(Rha)、甘露糖(Man)、DEAE-纤维素、Sephadex G-100:上海源叶生物科技有限公司;
大孔吸附树脂D941:陕西乐博生化科技有限公司;
C57BL/6雄性小鼠:(20±2) g,10周龄,湖南斯莱克精达实验动物有限公司。
1.2 主要仪器设备
真空冷冻干燥机:LJG-10型,北京松源华兴科技发展有限公司;
可见光分光光度计:721G型,上海仪电分析仪器有限公司;
高效液相色谱仪:LC-20A型,日本岛津公司;
扫描电子显微镜:Quanta FEG250型,美国FEI公司;
傅里叶红外光谱仪:IR Tracer-100型,日本岛津公司。
1.3 方法
1.3.1 LHP的提取和纯化 将干燥的红汁乳菇子实体粉末(100 g)与蒸馏水(2 L)混合,85 ℃提取3 h并不断搅拌,55 ℃超声处理1 h,4 000 r/min离心15 min,重复提取两次并合并上清液,60 ℃旋蒸浓缩。浓缩物用乙醇缓慢沉淀至终浓度80%,8 000 r/min离心20 min,得粗多糖。Sevage试剂(V氯仿∶V正丁醇=4∶1)用于除蛋白,微孔吸附树脂D941用于除色素,将冷冻干燥后获得的多糖命名为LHP。将LHP溶解于水中(5 mg/mL),依次通过DEAE-纤维素柱(16 mm×500 mm)和Sephadex G-100柱(16 mm×500 mm)进行纯化,分别用蒸馏水和不同浓度的氯化钠洗脱。透析(截留分子量7 000 Da),冻干后获得进一步纯化的级分LHP-1和LHP-2。
1.3.2 化学成分分析
(1) 多糖含量:采用苯酚—硫酸法[18]。
(2) 蛋白质含量:采用考马斯亮蓝法[19]。
(3) 单糖组成:参照文献[20]。LHP-1和LHP-2在4 mol/L三氟乙酸中100 ℃酸解6 h,所有酸解产物和标准品均由0.5 mol/L PMP-甲醇溶液衍生化,然后通过高效液相色谱法分析纯度,色谱条件为ODS-C18(5 μm,250 mm×4.6 mm)色谱柱,流速1 mL/min,流动相为乙腈和pH 6.8的磷酸盐缓冲溶液(V乙腈∶V磷酸盐缓冲溶液为13∶87),进样量20 μL,检测波长250 nm。
1.3.3 扫描电子显微镜观察 取少量的多糖样品粘附于载物台上,减压至真空环境下喷上一薄层金粉,用场发射扫描电镜对样品不同方位的表面特征进行观察。
1.3.4 傅里叶变换红外光谱扫描 采用KBr压片法,扫描范围4 000~400 cm-1。
1.3.5 动物试验 饲养小鼠保持在(25±2) ℃环境中,12 h明暗循环,自由采水。将30只小鼠随机分为3组,一组为正常对照组(记为Cont组),其余两组小鼠给予头孢曲松钠灌胃,每天一次,灌胃剂量为8 g/kg体重,持续灌胃5 d,观察小鼠粪便状态,当小鼠出现腹泻现象视为造模成功[21]。对于造模成功的两组小鼠,一组用红汁乳菇粗多糖进行干预(记为AntP组);一组作为自然恢复组(记为Ant组)。AntP组自成功建模以来每天灌胃300 mg/kg LHP,Cont组和Ant组灌胃等体积的生理盐水。喂食期间,观察并记录小鼠体重、行动能力和粪便状态,收集干预第0,3,7,14天的粪便贮藏至液氮中。
1.3.6 小鼠肠道菌群16S rRNA测序 对动物试验中收集的样本进行微生物测序,从粪便中提取DNA后,使用带有barcode的特异引物341F CCTACGGGNGGCWGCAG和805R GACTACHVGGGTATCTAATCC扩增16S rDNA的高变区V3和V4区,目标片段采用AMPure XT beads回收试剂盒进行回收。对纯化后的PCR产物使用Qubit对文库进行定量,将合格的各上机测序文库(Index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序,使用NovaSeq测序仪进行2×250 bp的双端测序。
1.3.7 统计分析 通过SPSS 24.0进行统计分析,数据采用单因素方差分析,P<0.05代表具有显著性差异。所有数据均表示为平均值±标准差。
2 结果与讨论
2.1 LHP-1和LHP-2的组成
由图1可知,水洗多糖和盐洗多糖通过葡聚糖凝胶柱洗脱后均得到一个单一的洗脱峰,说明得到了纯度较高的均质多糖,分别将其命名为LHP-1和LHP-2。
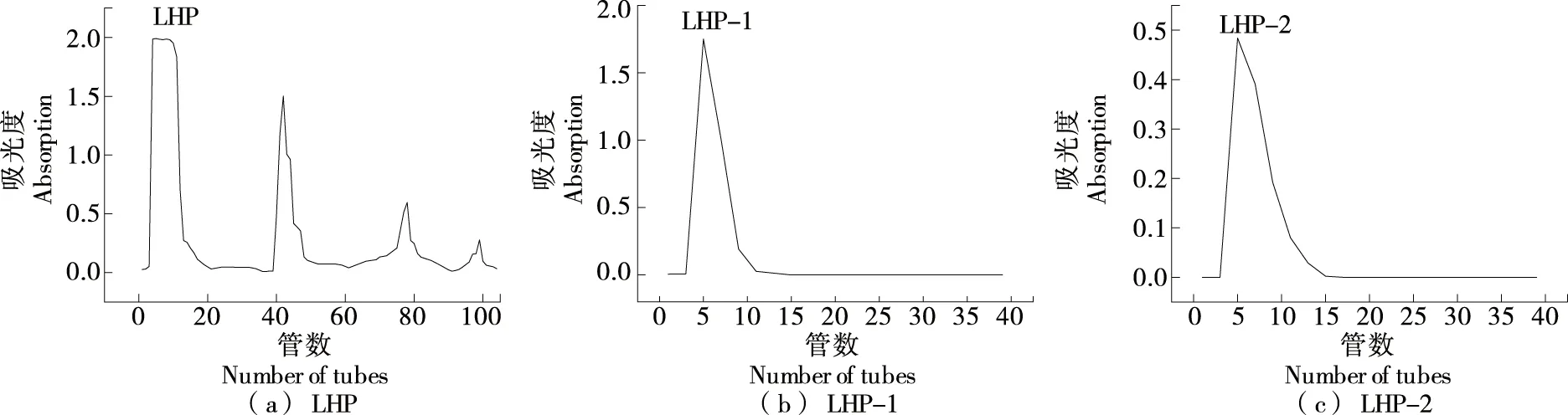
图1 LHP的DEAE-纤维素柱和Sephadex G-100凝胶柱洗脱曲线Figure 1 Elution profiles of DEAE-cellulose column and Sephadex G-100 gel column for LHP
由表1可知,从红汁乳菇子实体中提取LHP的得率为6.34%,与LHP相比,LHP-1和LHP-2的得率较低,但中性糖含量较高,分别达到98.20%和97.32%,而且几乎无蛋白质。LHP-1主要由甘露糖、葡萄糖、半乳糖组成,其摩尔质量比为3.44∶61.10∶1.22。LHP-2主要由甘露糖和葡萄糖组成,其摩尔质量比为3.84∶153.00,LHP-2中主要含有葡萄糖,而不含半乳糖,这两种多糖都可能属于葡聚糖[22],该试验结果符合食用菌多糖的规律[23]。

表1 LHP、LHP-1和LHP-2的得率、化学成分与单糖组成Table 1 Yields,chemical and monosaccharide composition of LHP,LHP-1 and LHP-2
2.2 红外光谱分析
由图2可知,3 311,3 346 cm-1附近的强吸收带归因于O—H的伸缩振动,2 926,2 927 cm-1附近存在另一个弱峰,表示存在甲基或亚甲基,进一步证实这些样品为多糖。酰胺I带在1 679,1 631 cm-1附近的强吸收带有N—H偏差振动,但是强度很弱,证明蛋白质较少。此外,1 079,1 078 cm-1处检测到的峰是由C—O伸缩引起的,1 028,1 031 cm-1处检测到的峰是由糖苷键引起的,843,856 cm-1处的光谱特征表明LHP-1和LHP-2存在β构型。

图2 LHP-1与LHP-2的红外图谱Figure 2 Infrared spectra of LHP-1 and LHP-2
2.3 扫描电镜分析
由图3可知,LHP-1呈非常均匀的状态,且由两种结构组成:一种类似于神经元的结构,中间是一个平面多边形的“细胞体”,细胞边缘延伸出几个“轴突”到4个侧面,称为“神经元”区域;另一个结构是链,符合多糖结构。LHP-2整体看起来比较杂乱,“神经元”结构区和链状结构区几乎重叠,层次不清晰,可能与多糖状态有关。LHP-1和LHP-2除了结构均匀性不同外,均有一条粗壮的主链,有很多分支,这些分支的末端呈球形,LHP-2的末端小球明显多于LHP-1。LHP-1的骨架形态更直,而LHP-2则多呈弧形弯曲。

图3 LHP-1和LHP-2的扫描电镜图Figure 3 SEM images of LHP-1 and LHP-2 (1 000×)
2.4 动物试验分析
2.4.1 LHP对小鼠体重的影响 由图4可知,Cont、Ant和Antp组的小鼠体重无显著性差异,且最终达到了相同的水平,说明LHP对小鼠体重无明显影响。

图4 小鼠平均体重变化Figure 4 Average body weight changed of mice
2.4.2 LHP对肠道微生物群落水平的影响 对各试验组中丰度前20的门进行物种注释,并在菌门水平上分析各试验组的细菌群落组成,结果见图5。小鼠肠道中丰度高的细菌包括拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和蓝细菌(Cyanobacteria)。与Cont组相比,干预第0天,Ant组的拟杆菌门丰度极低,变形菌门丰度较高;干预第7天,疣微菌门和拟杆菌门丰度显著增加,而变形菌门丰度急剧下降至与Cont相同的水平,厚壁菌门丰度也减少,蓝细菌无影响,表明小鼠肠道菌群具有一定的恢复能力。对于Antp组,疣微菌门丰度随LHP干预时间的延长而增加,且显著高于Cont组;变形菌丰度显著下降,但仍显著高于Cont组;拟杆菌丰度随多糖干预时间的延长而增加,但干预第14天仍显著低于Cont组。

图5 门水平上的肠道微生物组成Figure 5 Gut microbial composition at the phylum level
由图6、图7可知,Cont组的菌群组成基本一致,以肠球菌属和阿克曼菌属为主,拟杆菌属次之。Ant组的菌群组成差异较大,干预第0~3天,肠球菌属、短杆菌属和拟杆菌属是优势种,干预第4~14天,肠球菌和短单胞菌丰度减少,而卟啉单胞菌科、阿克曼菌属和拟杆菌属是优势种,且干预第14天,拟杆菌丰度急剧下降,阿克曼菌丰度减少,而变形杆菌数量显著增加。Antp组干预第0天的结果与Ant组相似,肠球菌在干预第3天迅速增加并成为优势种,随后逐渐减少退出优势种群之列,阿克曼菌的丰度随干预时间的推移而增加,并显著高于Cont组。从第14天菌属组成情况上来看,Ant组细菌组成与Cont组相似,Antp组细菌组成及比例与Cont组有显著差异。

图6 属水平上的肠道微生物组成Figure 6 Gut microbial composition at the genus level

图7 属相对丰度条形图Figure 7 Genus relative abundance bar chart
综上,LHP干预后使一些有益菌属增加。阿克曼菌作为一种优势菌,随干预时间的推移逐渐增加,最终高于其他组。阿克曼菌具有促进免疫、减轻肥胖和抗癌的作用[24],是主要的丁酸生产者,可预防多种疾病[25]。拟杆菌属是另一个优势属,试验结果中超过了Cont组,拟杆菌可以分泌大量的碳水化合物活性酶,碳水化合物的利用能迅速调整以适应各种饮食,此外,拟杆菌属通过消化多糖为其他细菌提供合适的多糖,有利于复杂肠道菌群之间的互利共生[26]。另一方面,肠球菌等有害菌[27]明显减少,说明LHP具有调节肠道菌群结构和多样性,维持其稳态的作用,并且具有治疗与肠道微生物群失调相关的疾病的潜力。
3 结论
从红汁乳菇中提取了红汁乳菇多糖(LHP),并确定了其纯化级分LHP-1和LHP-2的单糖组成、官能团和直观的表面结构。结果表明,LHP-1主要由甘露糖、葡萄糖、半乳糖组成,其摩尔质量比为3.44∶61.10∶1.22,LHP-2主要由甘露糖和葡萄糖组成,其摩尔质量比为3.84∶153.00,具有“神经元”结构和链状结构区域。动物试验表明,小鼠体重在喂食期间无影响,有益菌阿克曼菌和拟杆菌属数量增加明显并超过对照组,说明红汁乳菇多糖具有调节肠道菌群紊乱以维持体内平衡的能力,但其作用机制有待进一步探究。

