溴氰菊酯对稀有鮈鲫早期生命阶段发育和内分泌干扰毒性
姜锦林,吕建伟,曹少华,刘仁彬,石佳奇,龙 涛,单正军
溴氰菊酯对稀有鮈鲫早期生命阶段发育和内分泌干扰毒性
姜锦林*,吕建伟,曹少华,刘仁彬,石佳奇,龙 涛,单正军
(生态环境部南京环境科学研究所,国家环境保护土壤环境管理与污染控制重点实验室,江苏 南京 210042)
采用半静态水体暴露方式研究了水中溴氰菊酯对稀有鮈鲫早期生命阶段的发育毒性与内分泌干扰效应.结果表明,影响稀有鮈鲫胚胎孵化的LOEC(最低可观察效应浓度)>3.0μg/L;影响稀有鮈鲫仔鱼发育畸形和死亡指标的LOEC和NOEC(无可观察效应浓度)分别为1.0和0.33μg/L.低至0.04μg/L的溴氰菊酯暴露便可显著下调稀有鮈鲫幼鱼体内雄激素受体基因(AR)表达量并上调甲状腺激素受体基因(TRβ)表达量;0.11μg/L的溴氰菊酯暴露可以下调稀有鮈鲫幼鱼体内雄激素受体基因(AR)、雌激素受体基因(ER1、ER2b)和芳香烃受体基因(AhR1a)的表达量,并上调甲状腺激素受体基因(TRβ)表达量;0.33μg/L的溴氰菊酯可以下调稀有鮈鲫幼鱼体内雄激素受体基因(AR)、雌激素受体基因(ER1、ER2b)、芳香烃受体基因(AhR1a、AhR1b、AhR2)的表达量,并诱导甲状腺激素受体基因(TRβ)表达量的上调.上述作用浓度水平已经处于多个天然水体中溴氰菊酯的检出浓度范围,因此,关于水体残留溴氰菊酯对鱼类的内分泌干扰效应必须予以重视.
溴氰菊酯;稀有鮈鲫;早期生命阶段;发育毒性;内分泌干扰
拟除虫菊酯类农药是一种高效杀虫剂,在全球范围内使用历史较长,由于其疏水性较强,易富集在水生生物体内,且对水生生物的毒性较大,故对水生生态系统存在一定风险.溴氰菊酯是拟除虫菊酯类农药中对虫类毒力最高的一种,在我国较为常见,被广泛用于农林渔业病虫害防治.鉴于其健康风险,溴氰菊酯被美国环保局确定为首要控制使用的拟除虫菊酯类农药之一[1],近期研究也发现溴氰菊酯及其代谢产物在人体尿液及母乳中广泛存在,流行病学研究结果显示,体内溴氰菊酯可能和小儿智力发育障碍,小儿孤僻症相关,这可能和哺乳动物早期发育的神经元对溴氰菊酯暴露具有高度敏感性有关[2].一般来说,拟除虫菊酯类农药在哺乳动物和高等脊椎动物体内的代谢较快,可快速被清除,但在水生生物体内的代谢和排泄能力较低,毒性较高.作为最早使用拟除虫菊酯类农药的国家,美国很早就开始关注拟除虫菊酯类农药对水生态环境带来的影响[3].
由于拟除虫菊酯类农药的广泛应用,近年来世界上越来越多的水体环境中检测到拟除虫菊酯类农药的存在[4–10].由于此类农药在我国的使用量较大,水环境中残存的农药可能会对水生生物造成有害影响.急性研究表明,大部分拟除虫菊酯类类农药对枝脚类等浮游生物、虾类和鱼类的毒性等级处于高毒,且总体上,对前两者(枝脚类和虾类)的毒性高于后者(鱼类).如溴氰菊酯对多刺裸腹溞的24h- LC50为0.133μg/L[11];溴氰菊酯和氰戊菊酯对凡纳对虾的24h-LC50分别为0.20和0.17μg/L[12].而溴氰菊酯对花鳗鲡和黔东南田鱼(鲤)的96h-LC50分别为7.67[13]和5.38μg/L[14],联苯菊酯对真鲷的24h-LC50为2.5μg/L[15].以上研究表明拟除虫菊酯类农药对水生态风险不可忽视.目前针对菊酯类农药对水生生物的致毒机理和毒性效应特征研究相对较少,研究表明溴氰菊酯在48h内可通过氧化损伤途径对克氏原螯虾机体产生毒性作用[16];另有研究表明溴氰菊酯对中华绒螯蟹免疫系统有显著影响[17],且对中华绒螯蟹血细胞有较强的DNA损伤作用[18].此外,诸多研究揭示溴氰菊酯处理对水生鱼类具有神经、心血管和生殖毒性,且对鱼类的运动有负面影响[19].
稀有鮈鲫()是一种中国特有的淡水鱼类,主要生活于支流的沟渠等小水体中,分布于中国四川省汉源县等地,具有性周期短、易于饲养、对化学物质敏感等优点,是进行化学品毒性测试和环境水样毒性实验的理想材料[20,21].本研究选择稀有鮈鲫作为供试生物,研究溴氰菊酯暴露对稀有鮈鲫早期生命阶段的发育毒性和内分泌相关核受体基因表达干扰效应,以期为丰富溴氰菊酯的水生生物毒性效应特征和毒性机制研究,及其更完善的水生态风险评估打下基础.
1 材料与方法
1.1 仪器与试剂
仪器:繁殖盒(北京爱生科技发展有限公司);1L玻璃鱼缸(配盖,三合祖平玻璃仪器厂);人工气候箱(上海新苗医疗器械制造有限公司);体视显微镜(Leica,S8APO);手持式组织匀浆机;离心机(Sigma 2-16PK);核酸蛋白质测定仪(Beckman-DU800); PCR仪(Bio-Rad DNAEngine);荧光定量PCR仪(Bio-Rad CFX96TMReal-Time System).
试剂:98.2%溴氰菊酯原药,购自江苏农博生物科技有限公司;二甲基亚砜(DMSO),购自上海凌峰化学试剂有限公司;RNA提取试剂盒RNAprep Pure Micro Kit(TIANGEN,Beijing,China);反转录试剂盒ReverTra Ace qPCR PT Kit(TOYOBO,Tokyo,Japan);实时荧光定量PCR试剂盒ChamQ Universal SYBR qPCR Master Mix (Vazyme,Q711-02).
1.2 受试材料
供试鱼种为稀有鮈鲫(Gobiocypris rarus),品种为封闭群IHB.种鱼购自中国科学院水生生物研究所,引入批号为稀有鮈鲫20180728,从该批次的养殖群体中选择健康、体表无损伤、体质健壮的成鱼为亲鱼,饲养在实验室内循环养殖系统中14d,温度(25±2)°C,每天14h光照,溶解氧大于空气饱和浓度的60%,每日定时投喂丰年虫2次(08:00、16:00).
将雌雄亲鱼以1:1比例配对,每日观察雌雄鱼的行为,当观察到雄鱼追逐雌鱼时,将雌雄鱼捞出,人工受精方式获取受精卵.试验开始前在显微镜下随机抽样观察,确认本批受精卵处于单细胞期.
试验用水为曝气处理24h以上的除氯自来水,水温为(25±1)°C,pH值控制在6.5~7.5,光/暗比为14h/10h,溶解氧³60%,水质硬度为145.0mg/L(以CaCO3计).
1.3 暴露实验方法
1.3.1 试验药液配制 准确称取0.0509g 98.2%溴氰菊酯原药,加10.0mL DMSO,用试验用水溶解并定容至500mL,得到浓度为100.0mg/L溴氰菊酯贮备溶液.使用时将贮备溶液分别稀释为1.0mg/L和100.0µg/L的稀释溶液,再进一步稀释为各暴露组溶液.吸取100.0µL DMSO,用试验用水稀释定容至1.0L,得到浓度为0.1mL/L的溶剂对照组.受试物溶液每隔72h更新一次,受试物溶液体积1L.
1.3.2 鱼类早期生命阶段毒性试验 根据稀有鮈鲫幼鱼(受精卵孵出后1月龄)急性毒性预试验结果,将早期生命阶段毒性试验试验处理组浓度分别设置为0.04,0.11,0.33,1.0,3.0µg/L,同时设置不含受试物的空白对照组和一组二甲基亚砜(DMSO)溶剂对照组.受试溶液稳定性测试结果表明,在半静态试验条件(换水频率为72h)下,试验过程中受试物浓度的变化小于初始测试浓度的±20%,符合半静态试验质控要求,因此试验采用半静态试验法.
试验期间,受试溶液体积为1L,容器内溶液的负荷率不超过5g/L.每一浓度处理组和对照组90粒卵,分为3个平行.鱼卵受精后开始试验,在胚盘开始分裂前将胚胎浸在试验溶液中.试验期限:孵育期3d,孵出后28d,共计31d.光暗比为14h:10h,温度24.2~ 25.8°C,溶解氧81.8%~96.8%.亲鱼饲喂丰年虾,刚出生仔鱼饲喂草履虫,幼鱼饲喂孵出48h的卤虫幼体.第一次仔鱼饲喂在产卵后第6d开始.在每次更换试验液时清理试验容器.试验期间,记录胚胎孵化情况,每24h观察记录胚胎及幼鱼畸形、死亡情况,并清理死亡胚胎和幼鱼.
1.4 荧光定量PCR实验方法
暴露31d后,用液氮速冻各处理浓度组和对照组稀有鮈鲫幼鱼并提取鱼体总RNA.按照RNA提取试剂盒说明书提取暴露31d后幼鱼的总RNA,用核酸蛋白质仪测定RNA的浓度和纯化质量,再按照反转录试剂盒说明书对RNA进行反转录,得到互补DNA(cDNA).最后按照实时荧光定量PCR试剂盒说明书在冰上配制20µL反应体系,反应程序:95°C预变性30s;95°C 10s,60°C 30s,共40个循环;融解曲线采集程序使用仪器默认的采集程序.所用基因引物序列如表1.

表1 实时荧光定量PCR引物序列
1.5 数据处理
相对基因表达量采用2-ΔΔCt法进行计算,其中ΔΔCt由公式(1)计算得到:
ΔΔCt=(Cttarget-Ctactin)·t-(Cttarget-Ctactin)·0(1)
式中:Ct表示循环阈值;Cttarget表示目标基因的Ct值;Ctactin表示内参基因的Ct值;t代表任意时间点;0表示经β-actin基因校正后1倍量的目标基因表达.
在满足正态分布和方差齐性的前提条件下,采用单因素方差分析法(One-way ANOVO)和最小显著性检验法(LSD)分析处理组和对照组之间的差异显著性(<0.05为差异显著,用*表示),否则采用非参数检验来检验组间差异的显著性,结果以平均值±标准误(SE)表示.用Origin 9.1软件作图.
2 结果与分析
2.1 溴氰菊酯对稀有鮈鲫胚胎孵化和仔鱼发育影响
稀有鮈鲫胚胎孵出48~72h后逐渐孵化,到96h孵化全部完成,各浓度处理组孵化率与对照组的孵化率不存在显著性差异,所以0.04~3.0μg/L的溴氰菊酯对稀有鮈鲫的孵化无显著影响.如图1所示,3.0µg/L浓度组4~5d时,孵化出的仔鱼开始出现畸形,可以观察到的畸形终点指标包括仔鱼躯体弯曲和体轴弯曲等;1.0µg/L浓度组6~7d时,孵化出的仔鱼开始出现畸形,可以观察到的畸形终点指标包括卵黄囊水肿和尾部弯曲(144h),以及心包水肿(168h)等;其余浓度组基本未出现仔鱼畸形的情况.从第10d开始,畸形的仔鱼开始死亡,故统计了4~9d各浓度组的畸形率变化情况,结果见图2.与对照组相比,1.0和3.0µg/L浓度组的稀有鮈鲫畸形率随暴露时间延长而显著升高,而暴露在其它几组较低的浓度组的仔鱼相比对照组则无显著差异.

图1 溴氰菊酯暴露对稀有鮈鲫仔鱼的致畸效应
A为正常仔鱼(CK,144h);B为卵黄囊水肿、尾部弯曲(1.0µg/L,144h);C为卵黄囊水肿(1.0µg/L,168h);D为心包水肿(1.0µg/L,168h);E为躯体弯曲(3.0µg/L,144h);F为体轴弯曲(3.0µg/L,144h)

图2 溴氰菊酯对稀有鮈鲫畸形率的影响
2.2 溴氰菊酯对稀有鮈鲫幼鱼死亡率影响
1.0与3.0µg/L浓度组的稀有鮈鲫在暴露第9d时出现数量较多的畸形,死亡率结果如图3所示,从第10d开始,畸形的仔鱼开始死亡,到第13d时,1.0与3.0µg/L浓度组的稀有鮈鲫仔鱼基本全部死亡.试验结束后,对31d各暴露组稀有鮈鲫死亡率做了统计,结果显示,除1.0和3.0µg/L浓度组外,暴露在其它几组较低浓度组的仔鱼死亡率相比对照组无显著性差异.综合发育与死亡终点指标,溴氰菊酯对稀有鮈鲫的LOEC(最低可观察效应浓度)为1.0µg/L,NOEC (无可观察效应浓度)为0.33µg/L.

图3 溴氰菊酯暴露对稀有鮈鲫仔鱼死亡率影响
2.3 溴氰菊酯对稀有鮈鲫幼鱼性激素受体基因表达的影响
选取雄激素受体(AR)和雌激素受体(ERs)作为溴氰菊酯对稀有鮈鲫幼鱼发育过程中的生殖内分泌干扰机制的研究对象.如图4所示,在经溴氰菊酯暴露31d后,各浓度组稀有鮈鲫幼鱼体内AR基因的相对表达量与对照组相比均显著下降,分别为对照组的0.77倍、0.65倍、0.37倍(数值分别对应0.04, 0.11,0.33μg/L浓度组).测定溴氰菊酯对稀有鮈鲫幼鱼发育过程中体内ERs表达情况,结果表明,0.11, 0.33μg/ L浓度组稀有鮈鲫幼鱼体内ER1、ER2b基因的相对表达量与对照组相比均显著下降,分别为0.69、0.42倍(0.11μg/L组别)和0.74、0.50倍(0.33μg/ L组别),而0.04μg/L浓度组稀有鮈鲫幼鱼体内ER1、ER2b基因的相对表达量与对照组相比无显著差异.各浓度组溴氰菊酯对ER2a基因的相对表达量无显著影响.
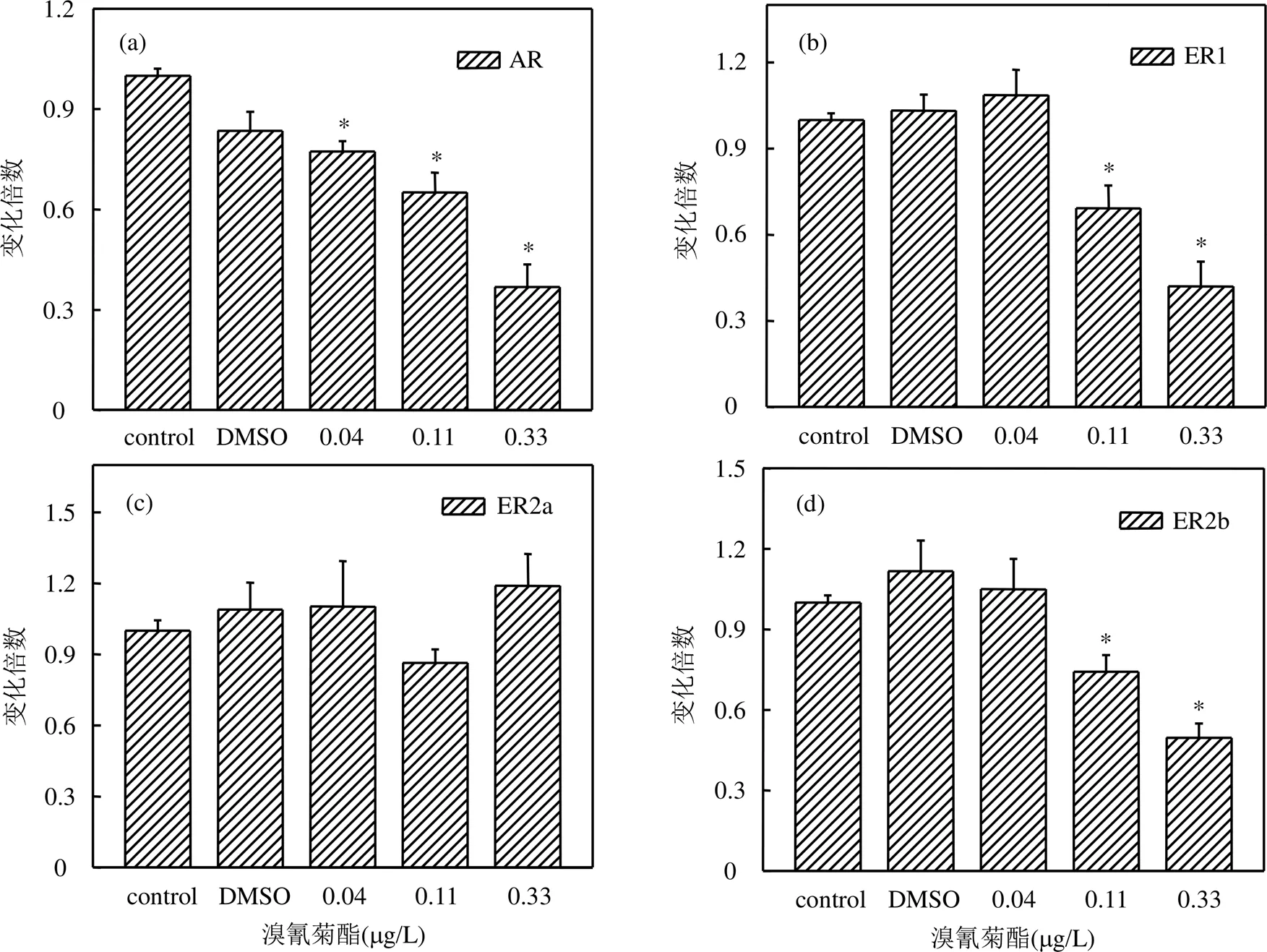
图4 溴氰菊酯对稀有鮈鲫幼鱼性激素受体基因表达影响
2.4 溴氰菊酯对稀有鮈鲫幼鱼甲状腺激素受体基因表达的影响
通过溴氰菊酯暴露后稀有鮈鲫幼鱼体内甲状腺激素受体TRα和TRβ基因的表达情况,分析溴氰菊酯对稀有鮈鲫幼鱼甲状腺干扰效应.如图5所示,在经溴氰菊酯暴露31d后,各浓度组稀有鮈鲫幼鱼体内TRβ基因的相对表达量与对照组相比均显著上升,分别为对照组的2.66倍、3.07倍、4.41倍(数值分别对应0.04,0.11,0.33μg/L浓度组),而各浓度组溴氰菊酯对TRα基因的相对表达量无显著影响.
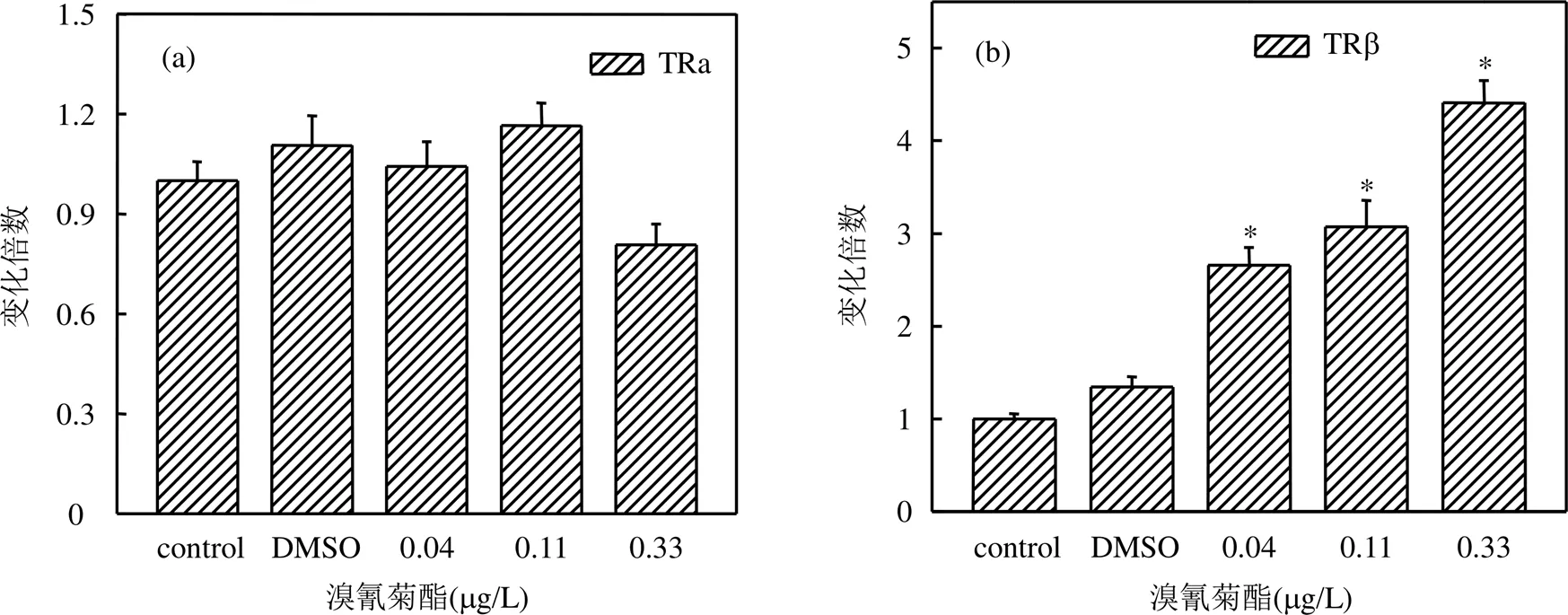
图5 溴氰菊酯对稀有鮈鲫幼鱼甲状腺激素受体基因表达影响
2.5 溴氰菊酯对稀有鮈鲫幼鱼芳香烃受体基因表达的影响

通过溴氰菊酯暴露后稀有鮈鲫幼鱼发育过程中体内芳香烃受体基因AhRs表达情况,分析稀有鮈鲫暴露溴氰菊酯后芳香烃受体介导毒性反应的影响.如图6所示,0.11和0.33μg/L浓度组稀有鮈鲫幼鱼体内AhR1a基因的相对表达量与对照组相比均显著下降,下降程度分别为0.68倍和0.50倍;而0.04μg/L浓度组稀有鮈鲫幼鱼体内AhR1a基因的相对表达量与对照组相比无显著差异.0.33μg/L浓度组稀有鮈鲫幼鱼体内AhR1b基因和AhR2基因的相对表达量与对照组相比均显著下降,分别为0.44倍和0.59倍,而0.04和0.11μg/L浓度组稀有鮈鲫幼鱼体内AhR1b、AhR2基因的相对表达量与对照组相比均无显著差异.
3 讨论
拟除虫菊酯类农药是继有机氯、有机磷农药和氨基甲酸酯之后的第三代农药,具有高效广谱,对哺乳动物低毒和低残留的优点,在农业中得到了广泛的应用,且其使用量逐年增加.其中,溴氰菊酯是最常见的拟除虫菊酯类农药品种.拟除虫菊酯类农药进入水环境的方式有3种,一种是施于农田的农药通过沉降及地表径流等方式进入水体环境中[22];一种是由于农药的不恰当使用,如在鱼类养殖时使用拟除虫菊酯类农药进行清塘工作,使其直接进入养殖水体中;还有一种是活性成分随人类使用的蚊香、驱蚊水残渣随生活污水进入水体.近年来,由于拟除虫菊酯农药的广泛应用,世界上越来越多的水体环境中检测到拟除虫菊酯类农药的存在[4–6].此外,国内九龙江口[7]、官厅水库[8]、梁滩河流域[9]和珠江三角河网[10]等水体环境中也均有拟除虫菊酯类农药的检出,其中溴氰菊酯检出浓度范围为ND~106.3ng/L.由于溴氰菊酯等农药对水生生物具有较高的毒性,水环境中残存的溴氰菊酯可能会对鱼类造成不利影响.已有研究表明,斑马鱼幼鱼在溴氰菊酯胁迫下出现体长缩短、头眼面积减小和孵化率增加等现象,其头部、身体、心脏和尾部区域产生不同程度的凋亡,溴氰菊酯显著诱导血管内皮生长因子flk1和fli-1以及心肌发育相关基因myl7呈剂量依赖性下降,增加了斑马鱼幼鱼的趋触性行为,引起了类似焦虑的行为[23].暴露在溴氰菊酯中的鲢鱼出现不同程度的行为失调,肝、鳃、脑、肌肉组织中总蛋白含量显著降低,全身皮质醇和血糖水平显著升高[24].最近的研究还发现,20和40µg/L的溴氰菊酯处理显著阻碍了斑马鱼胚胎鱼鳔前体细胞和组织层的形成,因此损害了斑马鱼鱼鳔的发育[19].目前对环境浓度范围该类农药是否能引起鱼类的发育和内分泌干扰毒性方面的研究还相对较少.本研究将处于早期生命阶段的稀有鮈鲫胚胎暴露于0.04~3.0µg/L的溴氰菊酯溶液中,发现考察浓度范围内溴氰菊酯对稀有鮈鲫胚胎的孵化无显著影响(LOEC>3.0µg/L),但暴露于1.0和3.0µg/L的溴氰菊酯溶液7~9d后,大量仔鱼出现畸形症状,暴露31d后的幼鱼死亡率分别为96.7%和100%,综合来看,影响稀有鮈鲫仔鱼发育畸形和死亡指标的LOEC和NOEC分别为1.0和0.33µg/L.由此可见0.33~1.0µg/L浓度水平的溴氰菊酯水环境赋存浓度可能会对水生鱼类幼体造成畸形和死亡风险.从内分泌干扰终点指标(性激素受体基因表达和甲状腺激素受体基因表达)来看,低至0.04μg/L的溴氰菊酯浓度已经对稀有鮈鲫幼鱼内分泌指标造成了干扰,而该浓度水平已处在当下诸多天然水体的检出浓度范围,这需引起重视.
性激素受体包括雄激素受体(AR)和雌激素受体(ERs),本研究选取这两类受体基因作为溴氰菊酯对稀有鮈鲫幼鱼发育过程中的生殖内分泌干扰效应的研究对象.AR和ERs通常在鱼类的性腺和脑中表达,属于核受体超家族成员之一[25].现有研究表明,一些化合物会影响性激素核受体的表达,从而对水生生物造成类雌激素效应.例如,有机氯农药会与靶细胞上的雌激素结合,对内源性雌激素造成影响[26].拟除虫菊酯类农药对生殖内分泌的干扰机制可能包括对性激素合成和代谢干扰、类雌激素效应、抗雄激素效应等.现有的拟除虫菊酯类农药干扰类雌激素和抗雄激素活性的研究表明,对于雄激素受体基因,高效氯氟氰菊酯、氰戊菊酯和氯菊酯暴露均会抑制斑马鱼幼鱼体内AR的表达,表现出一定的抗雄激素效应;对于雌激素受体基因,高效氯氟氰菊酯暴露会上调斑马鱼幼鱼体内ER1的表达,下调ER2a的表达,氰戊菊酯暴露会上调ER1的表达,氯菊酯暴露会上调ER2a、ER2b的表达[27].类似的,本研究从基因水平上对比分析溴氰菊酯对稀有鮈鲫幼鱼发育中性激素受体基因的影响,也发现溴氰菊酯对雄激素受体基因和雌激素受体基因均存在抑制作用,且对AR基因表达的抑制作用要高于ERs基因(表现在抑制ER1、ER2b基因的表达).
甲状腺激素受体基因(TR)属于核受体超家族,主要包含TRα和TRβ两种基因,对于机体的正常分化发育和维持调控体内代谢平衡等多个方面具有重要作用.其中,TRα在机体中的主要功能是调节机体生长发育、维持甲状腺功能;TRβ在机体中的主要功能是增加T3的敏感性,维持甲状腺激素TH对促甲状腺素TSH的负反馈[28–30].甲状腺激素能影响鱼类胚胎向幼鱼的转变,所以,鱼类的生长发育离不开甲状腺激素的作用.多个研究证明内分泌干扰物可以干扰鱼类体内甲状腺系统的循环调节,影响甲状腺的功能,如添加型阻燃剂六溴环十二烷对斑马鱼体内T3和T4具有明显抑制作用,随着其暴露浓度的增加,T3和T4的含量水平呈现下降趋势[31];纳米氧化铜会损伤甲状腺滤泡结构,改变上皮细胞形态,诱导甲状腺激素T3和T4上升,造成代谢酶编码基因ugt1ab表达的下调[32];多氯联苯暴露会引起褐牙鲆幼鱼甲状腺滤泡细胞出现明显的增生以及胶质缺损现象,并造成血浆甲状腺激素水平显著下降[33].本研究结果表明,0.04μg/L的溴氰菊酯暴露便会通过干扰稀有鮈鲫幼鱼TRβ基因的表达,对稀有鮈鲫幼鱼的甲状腺系统产生干扰效应.本研究从基因层面上丰富了溴氰菊酯对稀有鮈鲫体内甲状腺干扰作用机制的研究,然而,拟除虫菊酯对甲状腺系统的具体调控机制还有待进一步补充研究.
芳香烃受体基因(AhRs)作为一种配体诱导的转录因子,可以协助维持免疫系统的正常运行. AhRs能诱导CYP1A1和CYP1A2表达,参与辐射、感染、炎症和氧化应激等应激刺激,介导多种细胞毒性反应和重要的生物学过程,如信号转导、细胞分化、细胞凋亡、肿瘤演进、生长发育和再生等[34-35].外源污染物会影响哺乳动物芳香烃受体基因的表达,根据已有的拟除虫菊酯类农药的研究,联苯菊酯和功夫菊酯暴露均会影响大鼠CYP1A的表达,从而影响其氧化代谢功能[36].已有研究表明,某些外源性污染物也会影响鱼类芳香烃受体的表达,对鱼类的氧化代谢造成干扰,如低剂量三唑锡对雌性斑马鱼暴露处理后可抑制卵巢芳香化酶基因的表达,而高剂量组则促进了芳香化酶基因的表达,此外,各浓度组三唑锡均显著抑制雄性斑马鱼精巢芳香化酶基因的表达[37];类二噁英多氯联苯(PCB126)能明显诱导斑马鱼胚胎EROD活性及CYP1A基因mRNA相对表达量,呈现出明显的剂量-效应关系[38].CYP对氯菊酯的代谢具有保护作用[39],而氯氰菊酯可以介导斑马鱼幼鱼和成鱼体内CYP酶的转录水平和催化活性[40].本研究结果表明,0.11μg/L的溴氰菊酯暴露便开始干扰稀有鮈鲫幼鱼AhRs基因的表达,从而影响体内CYP的表达,对稀有鮈鲫幼鱼的代谢水平产生影响.
4 结论
4.1 考察浓度范围内的溴氰菊酯暴露对稀有鮈鲫胚胎的孵化无显著影响(LOEC>3.0µg/L),但1.0和3.0µg/L的溴氰菊酯暴露7~9d可以诱导稀有鮈鲫仔鱼发育出现显著的畸形,包括躯体弯曲、体轴弯曲和卵黄囊水肿等症状.综合早期生命阶段稀有鮈鲫的发育和死亡毒性终点,溴氰菊酯对其LOEC=1.0µg/L, NOEC=0.33µg/L.
4.2 低至0.04μg/L的溴氰菊酯暴露31d可以影响稀有鮈鲫幼鱼性激素受体基因表达和甲状腺激素受体基因表达,从而干扰鱼类生殖系统和甲状腺系统.其中,溴氰菊酯对其雄激素受体基因和雌激素受体基因均存在抑制作用,且对AR基因表达的抑制作用要高于ERs基因;溴氰菊酯通过干扰稀有鮈鲫幼鱼TRβ基因的表达对其甲状腺系统产生干扰效应.
4.3 0.11~0.33μg/L的溴氰菊酯暴露通过下调稀有鮈鲫幼鱼芳香烃受体基因(AhR1a、AhR1b、AhR2)表达量,从而影响体内CYP的表达,对稀有鮈鲫幼鱼的代谢水平产生影响.
[1] Sharma D, Ansari B. Effect of the synthetic pyrethroid Deltamethrin and the neem-based pesticide Achook on the reproductive ability of zebrafish, Danio rerio (Cyprinidae) [J]. Archives of Polish Fisheries, 2010,18(3):157-161.
[2] Zheng J, Yu Y, Feng W, et al. Influence of nanomolar deltamethrin on the hallmarks of primary cultured cortical neuronal network and the role of ryanodine receptors [J]. Environmental Health Perspectives, 2019,127(6):067003.
[3] 韩耀宗,朱国念,廖晓兰,等.拟除虫菊酯农药的毒性研究综述[J]. 世界农药, 2008,30(3):34-35.
Han Y Z, Zhu G N, Liao X L, et al. Review on toxicity of pyrethroid pesticides [J]. World Pesticides, 2008,30(3):34-35.
[4] Weston D P, Lydy R J. Urban and agricultural sources of pyrethroid insecticides to the Sacramento-San Joaquin Delta of California [J]. Environmental Science & Technology, 2010,44(5):1833-1840.
[5] Vryzas Z, Alexoudis C, Vassiliou G, et al. Determination and aquatic risk assessment of pesticide residues in riparian drainage canals in northeastern Greece [J]. Ecotoxicology and Environmental Safety, 2011,74(2):174-181.
[6] Feo M L, Ginebreda A, Eljarrat E, et al. Presence of pyrethroid pesticides in water and sediments of Ebro River Delta [J]. Journal of Hydrology, 2010,393(3/4):156-162
[7] 黄群腾.水环境中36种农药残留的同时分析方法及其应用[D]. 厦门:厦门大学, 2008.
Huang Q T. Simultaneously determination method for 36 pesticides in aquatic environment and its application [D]. Xiamen: Xiamen University, 2008.
[8] Xue N, Xu X, Jin Z. Screening 31endocrine-disrupting pesticides in water and surface sediment samples from Beijing Guanting reservoir [J]. Chemosphere, 2005,61(11):1594-1606.
[9] 龚得春.梁滩河流域拟除虫菊酯农药多介质残留和环境行为研究[D]. 重庆:重庆大学, 2013.
Gong D C. Pyrethroids pesticides residues and thier behavior in a multimedium environment of Liangtan River basin [D]. Chongqing: Chongqing Universtiy, 2013.
[10] 赵李娜.珠三角河网水环境中7种拟除虫菊酯类农药残留及风险评价研究[D]. 上海:上海海洋大学, 2014.
Zhao L N. Residue and risk assessment of 7kinds of pyrethroids in water environment in the Pearl River Delta [D]. Shanghai: Shanghai Ocean University, 2014.
[11] 修瑞琴,高世荣,许永香.大型溞生物测试法对农药溴氰菊酯的毒性评价[J]. 卫生毒理学杂志, 1990,(3):15-17,68.
Xiu R Q, Gao S R, Xu Y X. Studies on toxicity of new pesticide deltamethrin water flea Daphnia Magna Straus [J]. Journal of Health Toxicology, 1990,(3):15-17,68.
[12] 周冬仁,盛鹏程,孙博弈,等.氰戊菊酯与溴氰菊酯对凡纳对虾的急性毒性 [J]. 贵州农业科学, 2018,46(7):103-105.
Zhou D R, Sheng P C, Sun B Y, et al. Acute toxicity of fenvalerate and deltamethrin to Penaeus vannamei [J]. Guizhou Agricultural Sciences, 2018,46(7):103-105.
[13] 林 岗,张 倩,饶小珍.吡喹酮、甲苯咪唑、溴氰菊酯对花鳗鲡的急性毒性 [J]. 海洋渔业, 2011,33(4):467-471.
Lin G, Zhang Q, Rao X Z. Acute toxicity of praziquantel, mebendazole and deitamethrin on marbled eel[J]. Marine Fisheries, 2011,33(4):467-471.
[14] 孟立霞,张文华,潘 娟,等.甲氰菊酯和溴氰菊酯对黔东南田鱼(鲤)的急性毒性与安全评价[J]. 安徽农业科学, 2011,39(17):10301- 10302.
Meng L X, Zhang W H, Pan J, et al. Acute toxicity and safety evaluation of fenpropathrin and deltamethrin on field fish of Southeast Guizhou [J]. Journal of Anhui Agricultural Sciences, 2011,39(17): 10301-10302.
[15] 郑盛华,杨妙峰,郑惠东,等.联苯菊酯和醚菊酯对真鲷的急性毒性和安全性评价 [J]. 安徽农业科学, 2017,45(29):86-88.
Zheng S H, Yang M F, Zheng H D, et al. Acute toxicity and safety evaluation of bifenthrin and ethofenprox on Pagrosomus major [J]. Journal of Anhui Agricultural Sciences, 2017,45(29):86-88.
[16] 魏 华,吴 楠,沈 竑,等.溴氰菊酯对克氏原螯虾的氧化胁迫效应[J]. 水产学报, 2010,34(5):733-739.
Wei H, Wu N, Shen H, et al. Oxidative stress of deltamethrin to the liver of crayfish () [J]. Journal of Fishries of China, 2010,34(5):733-739.
[17] 洪宇航.溴氰菊酯对中华绒螯蟹主要免疫指标的影响[J]. 广东农业科学, 2017,44(3):151-157.
Hong Y H. Effects of deltamethrin on main immune parameters of Chinese mitten crab,[J]. Guangdong Agricultural Sciences, 2017,44(3):151-157.
[18] 洪宇航,黄 毅.溴氰菊酯对中华绒螯蟹血细胞DNA的损伤[J]. 水产科学, 2018,37(4):544-549.
Hong Y H, Huang Y. Effects of deltamethrin on DNA damage in hemocytes of Chinese mitten handed crab,[J]. Fisheries Science, 2018,37(4):544-549.
[19] Wu Y Q, Li W H, Yuan M R, et al. The synthetic pyrethroid deltamethrin impairs zebrafish () swim bladder development [J]. Science of the Total Environment, 2020,701:134870.
[20] 熊 力,马永鹏,毛思予,等.五氯酚对稀有鮈鲫胚胎毒性效应研究[J]. 中国环境科学, 2012,32(2):337-344.
Xiong L, Ma Y P, Mao S Y, et al. Toxic effects of pentachlorophenol on the Chinese rare minnow embryos [J]. China Environmental Science, 2012,32(2):337-344.
[21] Zhu B, Liu T Q, Hu X G, et al. Developmental toxicity of 3,4- dichloroaniline on rare minnow () embryos and larvae [J]. Chemosphere, 2013,90:1132-1139.
[22] 赵之德,李海涛,梁 涛.联苯菊酯等3种杀虫剂在茶园茶叶、土壤及降雨径流中的残留[J]. 中国生态农业学报(中英文), 2019,27(8): 1265-1274.
Zhao Z D, Li H T, Liang T. Residues of three insecticides in tea leaves, soil and rainwater runoff [J]. Chinese Journal of Eco-Agriculture, 2019,27(8):1265-1274.
[23] Li M, Liu X Y, Feng X Z. Cardiovascular toxicity and anxiety-like behavior induced bydeltamethrin in zebrafish () larvae [J]. Chemosphere, 2019,219:155-164.
[24] Ullah S, Li Z Q,UI Arifeen M Z, et al. Multiple biomarkers based appraisal of deltamethrin induced toxicity in silver carp () [J]. Chemosphere, 2019,214:519-533.
[25] Du M, Lin L, Yan C, et al. Enantiomer-specific bioaccumulation and depuration of hexabromocyclododecanes in zebrafish () [J]. Journal of Hazardous Materials, 2013,248-249C(1):167-171.
[26] Filby A L, Ortiz-Zarragoitia M, Tyler C R. The vas:: egfp transgenic zebrafish: a practical model for studies on the molecular mechanisms by which environmental estrogens affect gonadal sex differentiation [J]. Environmental Toxicology and Chemistry, 2014,33(3):602-605.
[27] 杜 洁.拟除虫菊酯对斑马鱼内分泌平衡及氧化代谢的扰动效应[D]. 杭州:浙江工业大学, 2016.
Du J. Disturbance Effect of pyrethroids on endocrine and xxidative metabolism in zebrafish () [D]. Hangzhou: Zhejiang University of Technology, 2016.
[28] 张 沛,温海深,迟美丽,等.花鲈三种甲状腺激素受体(TRs)基因克隆及表达分析[J]. 海洋湖沼通报, 2018,(5):91-99.
Zhang P, Wen H S, Chi M L, et al. Cloning and tissue expression analysis of three thyroid hormones receptor genes of spotted seabass () [J]. Transactions of Oceanology and Limnology, 2018,(5):91-99.
[29] Tang X, Liu X, Zhang Y, et al. Molecular cloning, tissue distribution and expression profiles of thyroid hormone receptors during embryogenesis in orange-spotted grouper () [J]. General & Comparative Endocrinology, 2008,159(2):117-124.
[30] Jugan M L, Levi Y, Blondeau J-P. Endocrine disruptors and thyroid hormone physiology [J]. Biochemical Pharmacology, 2010,79(7): 939-947.
[31] 刘小燕,刘 珊,张丽娟,等.六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究[J]. 农业环境科学学报, 2017,36(11):2192-2198.
Liu X Y, Liu S, Zhang L J, et al. Thyroid hormone-disrupting effects of hexabromocyclododecane in zebrafish () [J]. Journal of Agro-Environment Science, 2017,36(11):2192-2198.
[32] 王黎曌,薛永来,高 璐,等.纳米氧化铜对斑马鱼甲状腺系统的干扰效应[J]. 江苏农业科学, 2019,47(14):202-205.
Wang L Z, Xue Y L, Gao L, et al. Interference effect of copper oxide nanoparticles on thyroid system of zebrafish [J]. Jiangsu Agricultural Sciences, 2019,47(14):202-205.
[33] 董怡飞,田 华,王 蔚,等.多氯联苯对褐牙鲆仔鱼变态及幼鱼甲状腺系统的干扰作用[C]//2016年中国水产学会学术年会论文集, 2016,214-214.
Dong Y F, Tian H, Wang W, et al. Inhibition of larvae metamorphosis and disruption of juvenile fish thyroid system by polychlorinated biphenyls in Japanese flounder () [C]. Proceedings of the 2016 Chinese Fisheries Society Annual Conference, 2016:214-214.
[34] 杜 洁,张 怡,洪盼盼,等.拟除虫菊酯对斑马鱼氧化代谢相关基因表达影响[J]. 浙江工业大学学报, 2016,(3):334-339.
Du J, Zhang Y, Hong P P, et al. Effects of pyrethroids on the expression of oxidative metabolism related nuclear receptor genes in zebrafish [J]. Journal of Zhejiang University of Technology, 2016, (3):334-339.
[35] 薄 军,吴世军,李裕红,等.苯并[a]芘(BaP)对真鲷细胞色素P450和芳香烃受体基因表达的影响[J]. 中山大学学报(自然科学版), 2010,(3):98-102.
Bao J, Wu S J, Li Y H, et al. The effects of benzo[a]pyrene(BaP) exposure on the CYP1A1mRNA and AhR2mRNA expression of red seabream () [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010,(3):98-102.
[36] Abdou R, Sasaki K, Khalil W, et al. Effects of several pyrethroids on hepatic cytochrome P450 activities in rats [J]. Journal of Veterinary Medical Science, 2010,72(4):425-433.
[37] 马有宁.三唑锡对斑马鱼生殖内分泌干扰作用及分子机制研究[D]. 杭州:浙江大学, 2016.
Ma Y N. Endocrine disruption by azocyclotin and its potential mechanism in zebrafish () [D]. Hangzhou: Zhejiang University, 2016.
Liu H. Studies on developmental toxicology of dioxin--like PCB126 in zebrafish embryos [D]. Zhanjiang: Guangdong Ocean University, 2012.
[39] Clark B W, Giulio R T D. Fundulus heteroclitus adapted to PAHs are cross-resistant to multiple insecticides [J]. Ecotoxicology, 2012,21(2): 465-474.
[40] Yang Y, Ye X, He B, et al. Cadmium potentiates toxicity of cypermethrin in zebrafish [J]. Environmental Toxicology and Chemistry, 2016,35(2):435-445.
Developmental toxicity and endocrine disrupting effects of deltamethrin on rare minnow () during early life stage.
JIANG Jin-lin*, LYU Jian-wei, CAO Shao-hua, LIU Ren-bin, SHI Jia-qi, LONG Tao, SHAN Zheng-jun
(Key Laboratory of Soil Environmental Management and Pollution Control, Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China)., 2022,42(5):2395~2403
The developmental toxicity and endocrine disrupting effects of decamethrin on rare minnow () during early life stage were studied using semi-static water exposure method. The LOEC (lowest observed effect concentration) of decamethrin to the incubation of rare minnow embryo was above 3.0μg/L. The LOEC and NOEC (no observed effect concentration) of decamethrin to the developmental malformations and death indicators were 1.0 and 0.33μg/L, respectively. Exposure to the lowest concentration of decamethrin (0.04μg/L) could significantly down-regulate the expression of androgen receptor gene (AR) and up-regulate the expression of thyroid homone receptor gene (TRβ) in rare minnow larvae. Exposure to 0.11μg/L decamethrin down-regulated the expressions of AR, estrogen receptor genes (ER1, ER2b) and aromatic hydrocarbon receptor gene (AhR1a) in rare minnow larvae, and up-regulated the expressions of TRβ. Exposure to 0.33μg/Ldecamethrin inhibited the expressions of AR, estrogen receptor genes (ER1, ER2b) and aromatic hydrocarbon receptor genes (AhR1a, AhR1b, AhR2), as well as induced the expression of TRβ in rare minnow larvae. Given that these concentration levels have been in the range of detectable decamethrin concentrations in multiple natural water bodies, more attention should be paid to the endocrine disrupting effects of decamethrin on fish.
decamethrin;rare minnow;early life stage;developmental toxicity;endocrine disruption
X171,Q89
A
1000-6923(2022)05-2395-09
姜锦林(1984-),男,浙江温州人,研究员,博士,主要从事污染生态毒理学和风险评估研究.发表论文40余篇.
2021-10-18
中央级公益性科研院所基本科研业务费资助项目(GYZX220202);国家水体污染控制与治理科技重大专项(2017ZX07602)
* 责任作者, 研究员, jjl@nies.org

