基于拉曼光谱的铅致肝细胞生物分子变化研究
邢 钰,庞伟毅,徐 笠
基于拉曼光谱的铅致肝细胞生物分子变化研究
邢 钰1,2,庞伟毅2,徐 笠1*
(1.北京市农林科学院质量标准与检测技术研究所,北京 100097;2.桂林医学院公共卫生学院,广西 桂林 541199)
利用拉曼光谱技术采集不同铅离子暴露时间(0.5, 1.5, 3, 6, 12, 24h)、暴露浓度(0.05, 0.1, 0.5, 1, 5mg/L)下HepG2细胞的光谱数据,欲探究在不同铅暴露条件下肝细胞的分子变化及其相关机制.研究结果发现,在不同条件下各组细胞的光谱形态基本相同,但部分特征峰的吸光度强度存在差异.经多元统计分析发现,除6h外,同一暴露时间下不同暴露浓度细胞的光谱数据在LD1上均存在离散趋势,并在暴露24h时最明显.细胞内蛋白质、脂质、核酸、类胡萝卜素、碳水化合物等生物分子的特征峰表现出明显差异,但不同类型生物分子发生显著变化的时间并不相同.由此可见铅暴露可损伤肝细胞蛋白质、脂质、核酸、类胡萝卜素的结构并影响其正常功能,这种毒性效应呈剂量-效应关系,且随暴露时间的增加而增加.本研究说明拉曼光谱可以实现铅对肝细胞生物分子变化的相关检测,这不仅为之后的细胞毒理研究提供了新的思路,同时也为环境污染物的安全评价提供了理论依据.
铅;拉曼光谱;肝细胞损伤;生物分子;多变量分析
铅是地壳中含量最丰富的重金属元素之一,在工业生产中广泛使用.也正因如此,铅是人类生活环境中危害最严重的重金属之一,在我国污染程度位居前列,再加上儿童对铅毒性的高敏感性,其对人体危害的影响更是受到广泛关注[1-3].肝脏是机体消化系统中起新陈代谢作用的重要器官,它不仅是铅在机体内代谢的重要场所,也是其毒性作用的靶器官之一.铅在肝脏中蓄积,会引发肝肿大、胆囊壁增厚、肝功能异常等病理变化,甚至还可能诱导癌症发生[4].铅致肝毒性的主要机制包括氧化损伤、超微结构改变、线粒体损伤、DNA损伤等[5].
受方法限制,传统的细胞毒性研究在分析之前需要进行复杂的预处理工作,这往往会破坏细胞结构,无法提供细胞内化学成分的空间位置分布信息.同时,利用传统方法也很难在整体的测量中区分低浓度毒性物质暴露引起的物质成分的微小变化.因此,目前铅对肝细胞内生物分子改变的直观证据还亟待研究.
作为生物医学领域中较为热门的一种技术,拉曼光谱可以通过检测组织、细胞内化学键震动情况提供生物分子构成成分、构象、构型的变化信息[6].通过对组织、细胞样本的光谱数据进行分析可以系统的表征外界刺激胁迫下生物分子的变化情况,进而可以在生物分子水平深入理解并评价其毒性效应.因此,本研究拟通过显微共聚焦拉曼光谱检测研究铅对肝细胞生物分子变化的影响,并探讨其毒性作用机制,为重金属的安全评价提供理论依据.
1 材料与方法
1.1 实验材料
PbCl2(99.999%, Sigma-Aldrich,Germany)为粉末状固体,使用电子天平准确称量0.01g,充分溶解于100μL DMSO(Solarbio,China)中,将溶有PbCl2的DMSO溶液转移至容量瓶内,向容量瓶内加入MEM-EBSS培养基(国家实验细胞资源共享平台,中国)定容至100mL,获得浓度为100mg/L的母液,转移至棕色储液瓶中存放待用.在实验开始后按照实验需求用MEM-EBSS培养基进行梯度稀释,配制暴露液.
1.2 细胞培养与染毒处理
HepG2细胞(国家实验细胞资源共享平台,中国)采用含有10%胎牛血清(Gibco,thermo fisher scientific,USA)、1%非必需氨基酸、1%丙酮酸钠的MEM-EBSS培养基,放置在37℃、5% CO2、相对湿度为95%的CO2培养箱内培养.
本研究按照暴露时间将HepG2细胞分为6组,即0.5h组、1.5h组、3h组、6h组、12h组以及24h组.每个暴露组包含6个暴露浓度,分别为0, 0.05, 0.1, 0.5, 1和5mg/L,每个暴露浓度均设置3个平行样本.实验前,取对数生长期的HepG2细胞以1´106个/瓶的密度接种于底面积为25cm2的培养瓶内,并向每个培养瓶中加入5mL完全培养基,重新置于CO2培养箱中培养.24h后,将原培养基倒除,用1´DPBS清洗2次,加入5mL含不同PbCl2浓度的暴露液(空白对照加入无PbCl2的MEM-EBSS新鲜培养基),重新置于CO2培养箱中培养.既定暴露时间结束后倒除培养基,用1´DPBS清洗2次,用0.05%的胰蛋白酶消化5min,并用完全培养基重悬细胞悬液,1000r/min离心5min,弃上清液,加入10mL固定液(90% DPBS与10%甲醛),摇匀后在4℃冰箱内静置12h.静置后将细胞悬液以2000r/min离心5min,弃上清液,加入1mL超纯水,混匀后以2000r/min离心5min,弃上清液,再次加入1mL超纯水,混匀后以2000r/min离心5min,最后加入100 μL的超纯水吹打混匀滴在铝箔上待其自然风干后进行后续检测.
1.3 拉曼光谱测定
采用激光共聚焦显微拉曼光谱仪(Thermo Fisher Scientific ,USA)采集染毒实验后HepG2细胞的光谱数据.测样前对激光共聚焦拉曼光谱仪进行光路准直、分光计校准与激光器激发波长的校准,以保证每次测量环境相同.实验时采用100倍物镜,激光器波长设置为780nm,激光功率设为16mW,光栅为400lines/mm,采集的拉曼位移区间为500~ 2000cm-1,样品扫描中每个样品均随机选取16个采样点采集光谱数据,每个采样点曝光4次,单次曝光时间为10s,取4次曝光所获数据的平均值作为该点最终光谱数据.采集过程中由OMNIC软件自动对荧光背景与宇宙射线进行修正.
1.4 数据处理与分析
1.4.1 光谱数据预处理 在本实验中,所有原始数据使用Matlab R2020B的内置程序进行预处理,主要包括haar小波去噪、剪切拉曼位移区间至900~1800cm-1、基线校正与矢量归一化[7-8].
1.4.2 统计分析方法 本实验通过Matlab R 2020B软件对经过预处理的数据进行多变量分析[8].由于主成分分析(PCA)是一种无监督的降维方法,仅从PCA的结果很难进一步分析各组的差异[9].因此,在PCA的基础上,运用线性判别分析(LDA)将所获结果进行有监督的降维,体现最好的分类性能.PCA与LDA联用不仅可以降低原始数据维度,提升识别各组间差异的精确性,同时还可改善LDA过度拟合的不足.多变量分析的处理结果最后导入Origin 2021中进行可视化处理,最终以得分图、载荷图显示.运用Graphpad prism 8.0进行Kruskal-Wallis检验与Dunnett’s post hoc tests检验分析各处理组在差异贡献轴(LD)上的差异.
2 结果与讨论
2.1 平均拉曼光谱谱图比较
细胞样品不同采样点的分布可能会影响所测得的光谱数据,为尽可能减少样品不均对光谱数据产生的干扰,本研究采用多点采集分析的方法,即在各组别下,每个暴露浓度均包含3个平行样品,每个平行样品选取16个采样点,共计48个采样点,取48个采样点的平均光谱数据作为最终光谱数据进行预处理及后续统计分析.如图1所示,各个暴露时间下不同铅离子暴露浓度处理的HepG2细胞具有相似走势的平均拉曼光谱,并有多个形态相近的谱峰.
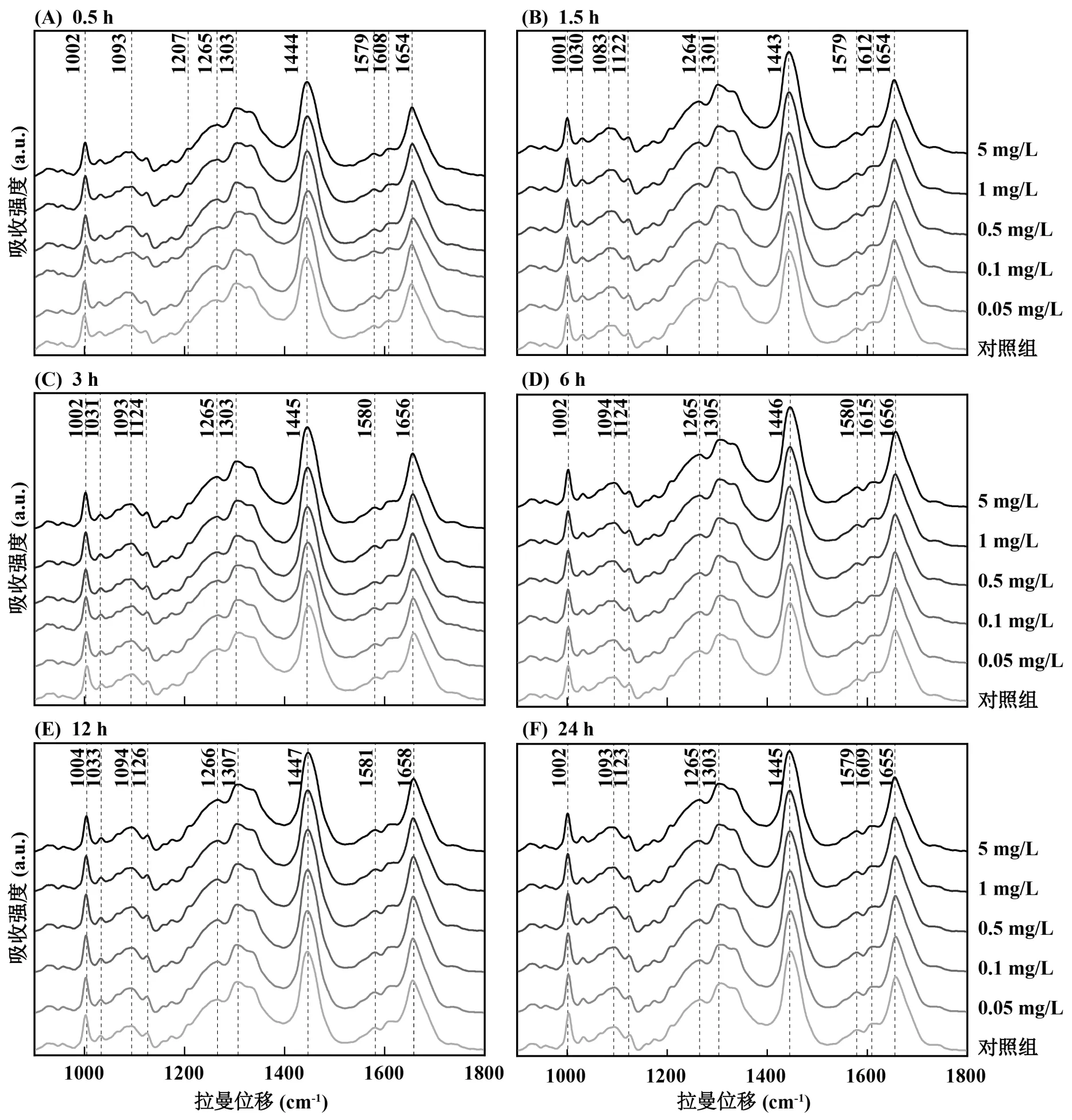
图1 不同条件下HepG2细胞的平均拉曼光谱
2.2 拉曼光谱的多元统计分析
本研究首先对光谱数据进行PCA分析,从每个光谱数据中提取20个主成分(包含原始数据集内95%以上的变量信息,可替代原始变量进行LDA分析),将提取出的主成分数据进行LDA分析.LDA分析所形成的新特征空间内,可以实现不同类(不同浓度处理组)之间的方差最大化,而类内之间的方差最小化,即同一类的数据关系更加紧密,形成一个个集群.而群集与群集之间的距离可代表不同处理组之间相似度的高低.而LDs是降维后新形成的特征变量,对组间差异的贡献从LD1向下逐渐降低.因此往往用LD1与LD2作为主要差异贡献因子进行可视化,以观察不同类别之间的差异.图2A-F分别展示了不同铅离子暴露浓度的HepG2细胞在暴露0.5~24h后光谱数据在LD1与LD2上的得分,即细胞内生物大分子的变化情况.图中每个点代表一个图谱,点的颜色代表其所属的类别[10],按照类别不同绘制不同暴露浓度组的95%置信椭圆.

图2 不同暴露条件下HepG2 细胞拉曼光谱PCA-LDA二维得分
可以观察到除0.5、6h外(图2A、D),随着暴露浓度的增加,各集群与对照组集群之间的离散情况更加明显(图2B、C、E、F),暴露时长为24h时,各集群在LD1上的离散情况最为明显.由此可以推测铅的肝细胞毒性与铅离子处理浓度之间可能存在着剂量-效应关系,以往的研究结果对这一推测提供了有力的证据[11].而6h(图2D)组内不同暴露浓度处理下的HepG2细胞之所以无显著差异可能是由于细胞在应激状态下产生兴奋效应,并进行自我修复的结果[12].此外,还观察到在0.5h组(图2A),暴露浓度为0.05mg/L的细胞与空白对照之间具有较大的重叠部分,其他暴露浓度虽与空白对照完全分离但各组之间存在集群重叠.随暴露时间的增加,暴露浓度为0.05mg/L的细胞与空白对照之间的差异逐渐明显,同时不同暴露浓度下HepG2 细胞之间的差异逐渐增大,并在暴露24h时基本分离(图2F).由此可以推断细胞内生物大分子的变化情况除与铅离子暴露浓度相关外与铅离子暴露时间也存在明显关联,这也与现有的研究结果一致[13].由于LD1是最主要的特征变量,对组间差异的贡献最大,因此,后续将LD1上各组的得分值进行统计学分析,来验证图2中各组的分离,由LD1得分绘制的箱线图如图3A-F所示(不同铅离子浓度处理组均与对照组进行比较,ns表示>0.05,*表示<0.05,**表示<0.01,***表示<0.001).在0.5h(图3A)、1.5h(图3B)、3h(图3C)时最低浓度组(0.05mg/L)虽然已经表现出与对照组的分离趋势,但与对照组之间的差异并无显著性.当暴露时间超过6h时(图3D-F),最低浓度组(0.05mg/L)与对照组之间出现了显著性差异,这说明随着暴露时间的增长,铅离子对肝细胞的损伤作用逐渐增大.而0.5~24h(图3A-F)其他各暴露浓度组与对照组之间均存在极显著的差异,且在1.5, 3, 12, 24h时(图3B、C、E、F)暴露浓度与生物分子变化程度之间具有线性相关的关系.针对各组在LD1得分的分析结果进一步验证了图2中所展示的集群分离结果,通过对LD1载荷的分析可以进一步聚焦不同暴露条件下铅离子对HepG2细胞生物分子的具体影响.LD1载荷的数值大小代表LD1作为新的特征变量时,各个原始变量(光谱的波数)与LD1之间的相关系数.载荷的绝对值越大,代表该原始变量与LD1的相关性越高.图4A-F为不同暴露时间下的LD1载荷图,展示了不同暴露时间下光谱波数对LD1上不同暴露组与对照组之间差异的贡献情况,并标注了对差异贡献最大的前6个特征峰.

图3 不同暴露条件下HepG2 细胞拉曼光谱PCA-LDA一维得分图
如图4A所示,暴露时间为0.5h时,代表不同暴露浓度处理下HepG2细胞差异的特征峰主要归属于蛋白质与DNA,次要归属于脂质,主要包括996cm-1(脱氧核糖)、1006cm-1(对称环呼吸;苯丙氨酸)、1224cm-1(β折叠;酰胺Ⅲ)、1430cm-1(CH2剪切振动;脂质)、1465cm-1(CH3反对称弯曲;脂质)、1646cm-1(无规卷曲;蛋白质);如图4B所示,暴露时间为1.5h时,贡献主要差异的特征峰以脂质相关为主,次要归属于蛋白质与DNA,包括996cm-1(脱氧核糖)、1006cm-1(对称环呼吸;苯丙氨酸)、1129cm-1(C-C拉伸振动;脂质)、1350cm-1(CH3变形振动;脂质)、1430cm-1(CH2剪切振动;脂质)、1463cm-1(CH3反对称弯曲;脂质);如图4C所示,暴露时间为3h时,贡献主要差异的特征峰与1.5h相似,仍以脂质相关为主,次要归属于蛋白质和DNA,包括998cm-1(脱氧核糖)、1008cm-1(对称环呼吸;苯丙氨酸)、1132cm-1(C-C拉伸振动;脂质)、1432cm-1(CH2剪切振动;脂质)、1465cm-1(CH3反对称弯曲;脂质)、1661cm-1(C=O振动β转角;酰胺Ⅰ);如图4D所示,暴露时间为6h时,蛋白质贡献了主要差异,特征峰包括1267cm-1(β转角;酰胺Ⅲ)、1528cm-1(C=C伸缩振动;类胡萝卜素)、1559cm-1(色氨酸)、1605cm-1(酪氨酸)、1633cm-1(β折叠;酰胺Ⅰ)、1659cm-1(C=O振动β转角;酰胺Ⅰ);如图4E所示,暴露时间为12h时,贡献主要差异的特征峰主要归属于蛋白质和脂质,次要归属于DNA,包括999cm-1(脱氧核糖)、1008cm-1(对称环呼吸;苯丙氨酸)、1433cm-1(CH2剪切振动;脂质)、1468cm-1(CH3反对称弯曲;脂质)、1644cm-1(无规卷曲;蛋白质)、1662cm-1(C=O振动β转角;酰胺Ⅰ);如图4F所示,暴露时间为24h时,与12h相似,蛋白质与脂质贡献了主要差异,而DNA贡献的差异较低,特征峰包括998cm-1(脱氧核糖)、1007cm-1(对称环呼吸;苯丙氨酸)、1131cm-1(C-C拉伸振动;脂质)、1432cm-1(CH2剪切振动;脂质)、1466cm-1(CH3反对称弯曲;脂质)、1647cm-1(无规卷曲;蛋白质).综合上述结果,当铅离子对HepG2细胞产生毒性作用时,主要会对HepG2细胞的脂质、蛋白质造成较为严重的影响,其次也会对DNA产生一定损伤作用.但铅离子的毒性作用会因暴露浓度与暴露时间的改变,略有不同.

图4 不同暴露条件下HepG2 细胞LD1载荷
从蛋白质分子来说,任何暴露时间下蛋白质分子受浓度影响变化均较大.在0.5h时,可以看到涉及酰胺Ⅲ的β折叠、蛋白质的无规卷曲以及苯丙氨酸等的特征峰,这些特征峰在之后的暴露时间内也可以观察到.酰胺Ⅲ的折叠结构、蛋白质的无规卷曲结构均与蛋白质的稳定性息息相关.蛋白质分子相关特征峰的出现说明铅离子已经对肝细胞的蛋白质结构产生影响.Belatik等[14]证实铅可通过-OH, -NH2和-SH 等与蛋白质结合,如含有琉基的抗氧化酶、还原型谷胱甘肽等,这不仅会使蛋白质结构产生影响,还会使蛋白质功能异常.其他研究也证实铅离子可改变蛋白酶活性并引起细胞氧化应激反应[15].在暴露6h时(图4D),可以观察到不同铅离子浓度处理组在色氨酸(~1559cm-1)与酪氨酸(~1605cm-1)等氨基酸相关特征峰上与空白对照之间的差异逐渐增大.Dowd等[16]表明较高浓度的铅离子会对色氨酸与酪氨酸的分泌产生抑制作用,这一观点同样在本研究的实验结果中得到证实. 类胡萝卜素在细胞生理活动中具有十分重要的作用,这主要体现在其具有较强的抗氧化作用,能够参与到炎症反应与氧化应激之中.有文献表明,在铅离子的刺激下,细胞为减少氧化活性物质的氧化损伤会增加类胡萝卜素的分泌[17].从图4D中还可以发现6h时出现了类胡萝卜素(~1528cm-1)相关特征峰的显著变化,但在12和24h的暴露中该特征峰变化不再显著.这可说明6h时,细胞抗氧化防御功能发挥到最大值,类胡萝卜素等抗氧化剂分泌增加.随着暴露时间增长,活性氧含量不断上升增加,细胞内核酸、蛋白等生物大分子均出现功能与构象异常,细胞抗氧化能力下降,类胡萝卜素等抗氧化剂的分泌受到抑制.
从脂质分子来说,自暴露0.5h(图4A)开始脂质相关特征峰的吸收强度发生变化,1.5h(图4B)之后脂质贡献的差异增大,主要峰位包括C-C拉伸振动(~1129cm-1)、CH2剪切振动(~1430cm-1)、CH3弯曲振动(~1350cm-1)等.脂质相关振动峰的变化主要与细胞膜的脂质双分子层有关,该特征峰的出现说明在铅暴露下细胞膜脂质双分子层亚甲基链结构有序性随铅离子浓度的增加而受到破坏,细胞膜的流动性降低.既往研究铅离子可激活NADPH氧化酶,增加细胞内活性氧的生成,通过过氧化作用破坏细胞内的脂质分子,从而导致细胞膜与细胞器膜的完整性受损,膜功能出现异常[18].还有研究发现铅离子还可直接与细胞内谷胱甘肽过氧化物酶、超氧化物歧化酶等抗氧化物质结合,消耗细胞内的抗氧化物,从而破坏细胞的抗氧化防御系统,使细胞出现脂质过氧化等异常[19].
从DNA分子来说,暴露0.5h(图4A)及以上时,代表脱氧核糖物质(~996cm-1)的特征峰出现差异,这说明随着暴露浓度的增加,铅离子对细胞遗传物质逐渐产生损伤作用.有研究发现氧化应激可通过修改碱基对与氨基酸序列等途径破坏细胞DNA的分子结构,导致DNA链的断裂[20].此外Shilpa[21]在研究中观察到铅离子可以直接与DNA结合并引起DNA损伤.
3 结论
3.1 利用拉曼光谱对铅暴露导致的肝细胞生物分子改变进行分析发现铅离子对肝细胞生物分子的损伤呈剂量-效应关系,同时与暴露时间呈正相关.
3.2 运用多元统计分析的手段对拉曼光谱数据进行分析发现0.5h时,不同暴露浓度组之间的差异主要在蛋白质与DNA,次要在脂质;1.5 与3h时,不同暴露浓度组之间的差异主要在脂质,次要在蛋白质与DNA;6h时不同暴露浓度组之间的差异主要在蛋白质;12与24h时不同暴露浓度组之间的差异主要在蛋白质与脂质,次要在DNA.
[1] Hou S N, Hua X Y, Ji X F, et al. Pollution characteristics, sources, and health risk assessment of human exposure to Cu, Zn, Cd and Pb pollution in urban street dust across China between 2009 and 2018 [J]. Environment International, 2019,128:430-437.
[2] Dong Z M, Wu S M, Hu J Y,et al. Health risk assessment for children due to lead exposure in some region of China [J]. China Environmental Science, 2011,31(11):1910-1916.
[3] Zou T S, Zhang J L, Chen Y, et al. Contents and distribution characteristics of atmospheric lead in urban China [J]. China Environmental Science, 2015,35(1):23-32.
[4] Kasperczyk S, Blaszczyk I, Dobrakowski M, et al. Exposure to lead affects male biothiols metabolism [J]. Annals of Agricultural and Environmental Medicine, 2013,20(4):721-725.
[5] Labudda M. Lead Hepatotoxicity: selected aspects of pathobiochemistry [J]. Medycyna Pracy, 2013,64(4):565-568.
[6] Xu L, Wei Q, Li J Y, et al. Research progress on toxic effects of pollutants based on spectrum technology [J]. Asian Journal of Ecotoxico1ogy, 2018,13(6):50-60.
[7] Liu Y J, Kyne M, Wang C, et al. Data mining in Raman imaging in a cellular biological system [J]. Computational and Structural Biotechnology Journal, 2020,18:2920-2930.
[8] Trevisan J, Angelov P P, Scott A D, et al. IRootLab: a free and open-source MATLAB toolbox for vibrational biospectroscopy data analysis [J]. Bioinformatics, 2013,29(8):1095-1097.
[9] Kumamoto Y, Harada Y, Takamatsu T, et al. Label-free Molecular Imaging and Analysis by Raman Spectroscopy [J]. Acta Histochemica Et Cytochemica, 2018,51(3):101-110.
[10] Tian D Y, Lu G D, Zhai Z G, et al. Rapid thyroid dysfunction screening based on serum surface-enhanced Raman scattering and multivariate statistical analysis [J]. Laser Physics Letters, 2018,15(1):5.
[11] Li C, Shi L, Peng C, et al. Lead-induced cardiomyocytes apoptosis by inhibiting gap junction intercellular communication via autophagy activation [J]. Chemico-Biological Interactions, 2021,337:8.
[12] Hosseinirad H, Shahrestanaki J K, Moghaddam M M, et al. Protective Effect of Vitamin D3Against Pb-Induced Neurotoxicity by Regulating the Nrf2 and NF-kappa B Pathways [J]. Neurotoxicity Research, 2021,39(3):687-696.
[13] Metryka E, Kupnicka P, Kapczuk P, et al. Lead (Pb) Accumulation in Human THP-1Monocytes/Macrophages In Vitro and the Influence on Cell Apoptosis [J]. Biological Trace Element Research, 2021,199(3): 955-967.
[14] Belatik A, Hotchandani S, Carpentier R, et al. Locating the Binding Sites of Pb(II) Ion with Human and Bovine Serum Albumins [J]. Plos One, 2012,7(5):9.
[15] Cole T R, Erickson S G, Morales K A, et al. Cd(II)- and Pb(II)-Induced Self-Assembly of Peripheral Membrane Domains from Protein Kinase C [J]. Biochemistry, 2019,58(6):509-513.
[16] Dowd T L, Li L, Gundberg C M. The H-1NMR structure of bovine Pb2+-osteocalcin and implications for lead toxicity [J]. Biochimica Et Biophysica Acta-Proteins and Proteomics, 2008,1784(11):1534-1545.
[17] Darwish W S, Ikenaka Y, Nakayama S M M, et al. Constitutive Effects of Lead on Aryl Hydrocarbon Receptor Gene Battery and Protection by beta-carotene and Ascorbic Acid in Human HepG2Cells [J]. Journal of Food Science, 2016,81(1):275-281.
[18] Zhang Y F, Deng B L, Li Z T. Inhibition of NADPH oxidase increases defense enzyme activities and improves maize seed germination under Pb stress [J]. Ecotoxicology and Environmental Safety, 2018,158:187- 192.
[19] Sanchez-Valle V, Valverde M, Carrizales L, et al. A metal mixture induces transformation upon antioxidant depletion in a hepatic cell line [J]. Annals of Hepatology, 2013,12(2):315-324.
[20] Zhang H, Wei K, Zhang M Y, et al. Assessing the mechanism of DNA damage induced by lead through direct and indirect interactions [J]. Journal of Photochemistry and Photobiology B-Biology, 2014,136: 46-53.
[21] Shilpa O, Anupama K P, Antony A, et al. Lead (Pb) induced Oxidative Stress as a Mechanism to Cause Neurotoxicity in Drosophila melanogaster [J]. Toxicology, 2021,462:152959.
Lead-induced alterations in hepatocyte biomolecules based on Raman spectroscopy.
XING Yu1,2, PANG Wei-yi2, XU Li1*
(1.Institute of Quality Standard and Testing Technology, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China;2.School of Public Health, Guilin Medical University, Guilin 541199, China)., 2022,42(5):2387~2394
In this study, we employed Raman spectroscopy to explore the bio-molecular alterations in HepG2cells following exposure to lead with concentrations of 0.05, 0.1, 0.5, 1, 5mg/L, which took different time periods (0.5, 1.5, 3, 6, 12, 24h) respectively. Raman spectra correlated to cellular biological information was collected via Raman microscopy to further investigate the bio-molecular alterations of liver cells community following lead exposure. It showed that although the spectra in each treatment group were similar, certain diversities of the peaks positions and the absorption intensities were observed. Additionally, multivariate analysis was applied to the spectral dataset to determine the biological changes underlying the exposure, and it showed that the spectral data of cellular groups following exposures at different concentrations with the same exposure time showed a discrete trend on LD1, and it was significantly observed in 24-h exposure. The results, as well, indicated that lead exposure can damage the structure of liver cell proteins, lipids, nucleic acids, carotenoids, carbohydrates and affect their normal functions. These cellular responses are dose-related and increases with exposure time. In conclusion, our study suggests that Raman spectroscopy is proper tool with ability to detect the biological molecular changes in liver cells following lead exposure. It can not only provide a new assay in toxicology research, but also provides a theoretical basis for rapid safety evaluation of environmental pollutants.
lead;Raman spectroscopy;hepatocyte damage;biomolecules;multivariate analysis
X503.1
A
1000-6923(2022)05-2387-08
邢 钰(1997-),女,黑龙江七台河人,硕士研究生,主要从事环境污染物的健康效应研究.发表论文2篇.
2021-10-14
北京市优秀人才青年骨干项目(201801001)
* 责任作者, 副研究员, xuliforever@163.com

