猪胸膜肺炎放线杆菌细胞毒素ApxⅡ在谷氨酸棒杆菌中的截短表达
杨术杰,孙曼曼,刘秀霞,2,3,杨艳坤,2,3,白仲虎,2,3*
(1.江南大学粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏 无锡 214122;3.江苏省生物活性制品加工工程技术研究中心,江苏 无锡 214122)
PCP 是由猪胸膜肺炎放线杆菌(Actinobacillus.pleuropneumoniae)引起的高传染性、致死性呼吸道疾病,已成为世界性工业化养猪五大疫病之一。猪胸膜肺炎放线杆菌对抗菌药较敏感[1],但抗菌药长期使用易产生抗药性及药物残留[2]。为响应国家饲料端“减抗”政策,接种疫苗以减少抗生素使用的有效措施。
目前,常用猪胸膜肺炎放线杆菌疫苗是致病性血清全菌体灭活疫苗[3]。猪胸膜肺炎放线杆菌致病性有关毒力因子包括荚膜多糖(CP)、脂多糖(LPS)、外膜蛋白(Omp)、细胞毒素(Apx)、转铁结合蛋白(Tbp)等[4]。其中,Omp、Apx、Tbp 是猪胸膜肺炎放线杆菌保护性抗原,可作为疫苗有效成分。Apx可破坏宿主细胞膜结构,被认为是猪胸膜肺炎放线杆菌致病的主要毒力因子之一[5],其存在被认为是引起组织严重损伤和保障病毒完整毒力前提,例如中和Apx的抗体可减少巨噬细胞或者嗜中性粒细胞坏死,接种Apx疫苗动物对细菌感染具有较好抵抗作用[6]。目前已识别的16种猪胸膜肺炎放线杆菌血清型产生的Apx 毒素主要有ApxⅠ、ApxⅡ、ApxⅢ、ApxⅣ[7-8]。其中ApxⅠ-Ⅲ被认为是主要毒力因子[3],ApxⅡ是绝大部分血清型均表达的一类Apx毒素,被认为是最“有前途”的候选疫苗。目前,一些重组表达ApxⅡ案例已在大肠杆菌(Escherichia coli)和酿酒酵母(Saccharomyces cerevisi⁃ae)中成功表达,王春来等在大肠杆菌BL21中以包涵体形式表达rApxⅡA,但菌体细胞内可能存在内毒素,且无法将Apx 分泌表达[9];Shin 等通过酿酒酵母2805生产ApxⅠ和ApxⅡ,但发酵周期长,生产成本高[10]。
谷氨酸棒杆菌(Corynebacterium glutamicum)是革兰氏阳性菌,自1957年被发现后广泛应用于氨基酸生产,如谷氨酸、苏氨酸等[11]。研究发现,谷氨酸棒杆菌在表达异源蛋白上同样具有优势[12],一是该菌种作为表达系统无内毒素,是一种生物安全菌种,不会影响疫苗质量[13-14];二是该菌种具有较强分泌能力,具有发达蛋白分泌系统(Sec 和Tat分泌途径),可高效分泌重组蛋白[15];三是该菌种胞外蛋白酶少[16],有利于异源蛋白稳定表达;四是培养周期短,发酵过程成本低,下游纯化工艺简单。结合成熟培养工艺和遗传操作技术,可极大缩减工业化生产靶蛋白成本。
本研究首次通过谷氨酸棒杆菌CGMCC1.15647分泌表达截短猪胸膜肺炎重组亚单位疫苗ApxⅡ,并通过筛选pXMJ19载体表达盒中启动子、信号肽提高谷氨酸棒杆菌表达系统分泌表达截短ApxⅡ产量,也采用ELISA方法测定ApxⅡ活性,对谷氨酸棒杆菌作为宿主表达异源重组蛋白疫苗具有重要指导意义。
1 材料与方法
1.1 菌株、生长条件和质粒
大肠杆菌JM109用于构建表达载体;谷氨酸棒杆菌作为蛋白表达宿主,均由实验室保存。氯霉素终浓度在大肠杆菌为30 mg·L-1,在谷氨酸棒杆菌为10 mg·L-1。JM109和CGMCC1.15647在LBB培养基表达重组蛋白(胰蛋白胨10 g,酵母膏5 g,氯化钠10 g,脑心浸出液10 g,水1 L)中培养,温度30 ℃,转速220 r·min-1。选用LBHIS 培养基(胰蛋白胨5 g,酵母膏2.5 g,氯化钠5 g,脑心浸出液18.5 g,山梨醇91 g,水1 L)对CGMCC 1.15647 活化。所用质粒见表1。
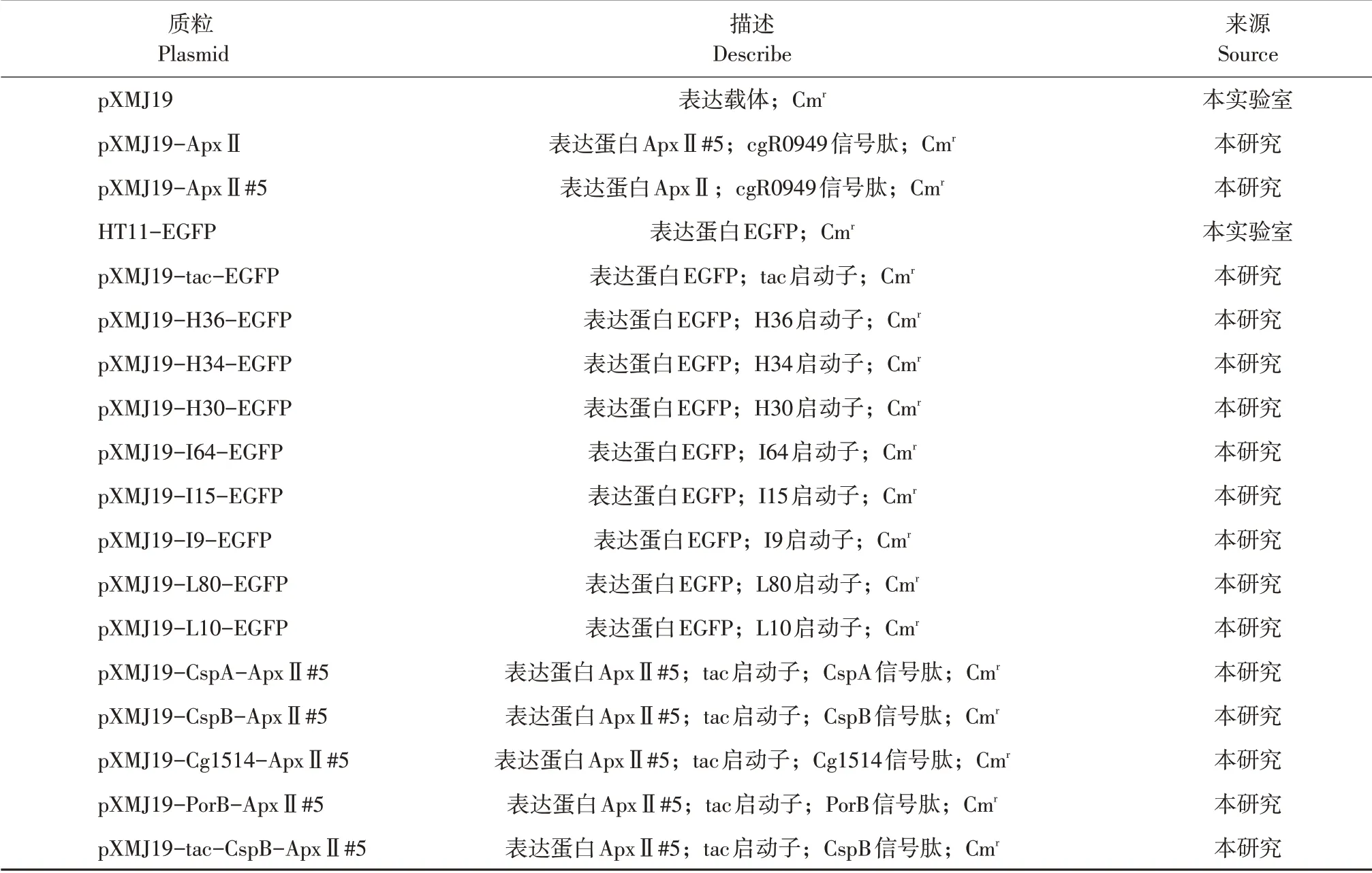
表1 本研究所用质粒Table 1 Plasmid in this study
1.2 主要仪器和试剂
质粒提取试剂盒,胶回收试剂盒及PCR 产物回收试剂盒购自美国Axygen 公司;T4PNK 酶、DNA 连接酶和限制性内切酶购自日本TaKaRa 公司;重组酶购自中国武汉ABclonal 公司;氯霉素购自生工生物工程(上海)股份有限公司;HRPconjugated anti-His购自美国Proteintech公司,显色液购自中国上海Yeason 公司;猪胸膜肺炎抗体阳性血清购自中国武汉纯度生物科技公司;其余试剂为国产或进口分析纯。仪器包括高速冷冻离心机、PCR热循环仪、Synergy H4酶标仪、恒温金属浴、核酸和蛋白电泳仪、凝胶成像系统、紫外分光光度计、荧光分光光度计、纯化仪等。
1.3 引物和基因合成
试验所用引物、猪胸膜肺炎放线杆菌ApxⅡ由苏州金唯智生物科技有限公司构建合成。将文献[6]报道的ApxⅡ全长氨基酸序列,对其优化密码子,在C 端加上His 标签,在两端加上5'BamHⅠ和3'EcoRⅠ酶切位点,由金唯智合成序列。所用引物见表2。

表2 本研究所用引物Table 2 Primers in this study
1.4 表达载体构建
ApxⅡ全长表达载体构建:以BamH Ⅰ和EcoR Ⅰ分别酶切pXMJ19 质粒以及ApxⅡ全长基因,并用T4DNA连接酶连接基因和载体,得到ApxⅡ全长表达载体pXMJ19-ApxⅡ,并在C端添加His-tag以便后续纯化和分析(见图1a)。
截短ApxⅡ#5 表达载体构建:以F-apx-JD 和R-apx-JD为引物,pXMJ19-ApxⅡ为模板扩增截短ApxⅡ#5 基因序列(见图1b)。PCR 产物纯化后经BamHⅠ和EcoRⅠ酶切,T4DNA 连接酶连接至同样经BamHⅠ和EcoRⅠ酶切后pXMJ19 载体上,得到pXMJ19-ApxⅡ#5-His。
启动子筛选表达载体构建:以F-EGFP-0 和R-EGFP-0 为引物,以HT11-EGFP 为模板扩增报告蛋白EGFP基因序列。PCR产物纯化后与经BamH 和EcoRⅠ酶切后pXMJ19 载体用同源重组酶进行同源重组,得到pXMJ19-tac-EGFP(见图1c);以F-H36 和R-H36 为引物,双引物互为模板扩增全合成启动子H36 基因序列。PCR 产物纯化后与经KasⅠ和XhoⅠ酶切后的pXMJ19-tac-EGFP 进行酶切连接,得到pXMJ19-H36-EGFP,剩下的全合成启动子均用上述方法构建。
信号肽筛选表达载体构建:以F-cspB 和RcspB为引物,从谷氨酸棒杆菌基因组中扩增cspB基因序列。PCR 产物纯化后经XhoⅠ和BamHⅠ酶切,与同样经XhoⅠ和BamHⅠ酶切后pXMJ19-ApxⅡ#5 载体上,得到pXMJ19-cspB-ApxⅡ#5(见图1d),剩下的信号肽均用上述方法构建。
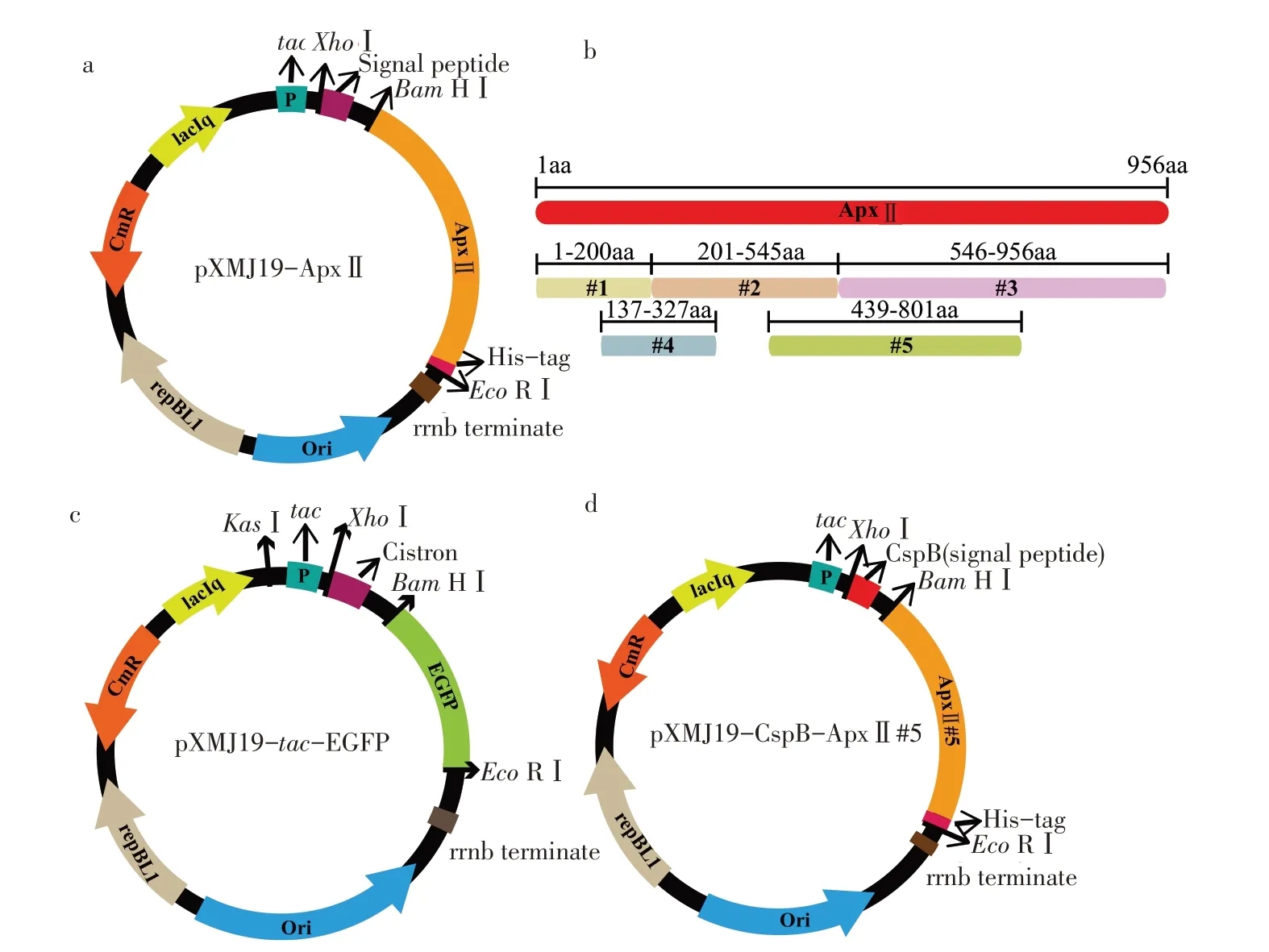
图1 pXMJ19表达载体构建Fig.1 Plasmids construction of pXMJ19
1.5 质粒转化
上述载体通过电转化方法转入谷氨酸棒杆菌CGMCC1.15647[17]。
1.6 荧光强度测定
EGFP 检测不同启动子表达强度。将成功构建具有不同启动子的表达载体转化至谷氨酸棒杆菌中,分别从平板上取3 个转化子将其转染至24 孔板中(每孔含2 mL LBB 培养基)。30 ℃以200 r·min-1培养约12 h,将谷氨酸棒杆菌转接至新24 孔板(每孔含2 mL LBB 培养基),以初始OD600=0.05,二次活化培养2 h后,在含有诱导性启动子的每个孔中添加1 mmol·L-1诱导剂IPTG,添加IPTG 诱导剂后继续培养24 h 后测量荧光强度,组成型启动子中不添加任何诱导剂。
首先用培养基将酶标仪标零,去培养后菌液加入培养基充分稀释,稀释后终浓度OD600=0.4~0.7,利用酶标仪测定菌液OD600浓度并记录,同时利用荧光计测定稀释后菌液荧光强度(激发波长488 nm,发射波长507 nm),计算单位OD600荧光强度以指示不同启动子表达强度。每个载体转化后选取的3个转化子作为生物学重复。
1.7 ApxⅡ#5 纯化分析及SDS-PAGE 和Western blot
将带有质粒pXMJ19-ApxⅡ#5的谷氨酸棒杆菌置于LBB 培养基中,30 ℃过夜培养,然后以1∶50转接至新鲜培养基中,培养3 h 后当OD600为0.6 时加入1 mmol·L-1IPTG。培养24 h 后,通过离心和过滤收集培养上清液。用AKATA 系统中His Trap HP 色谱柱纯化ApxⅡ#5-His 蛋白。蛋白纯度通过SDS-PAGE分析测定,分离胶浓度为12%,浓缩胶浓度为4%。电泳电压为120 V,结束后用考马斯亮蓝染色,脱色后置于凝胶成像仪拍照。Western bolt操作参照文献[18],以HRP-conjugated anti-His为抗体检测。
1.8 BSA蛋白浓度及ELISA活性测定
蛋白浓度测定采用BSA 定量方法,将BSA 标品定量30、40、50、100、200 mg·L-1,利用SDSPAGE 分析蛋白纯度,结束后利用Image J 计算灰度值,根据不同浓度BSA 绘制标准曲线,定量蛋白ApxⅡ#5。取发酵表达ApxⅡ#5 的发酵上清液,严格按照ELISA 说明书操作,检测ApxⅡ#5活性。

续表
2 结果与分析
2.1 ApxⅡ在谷氨酸棒杆菌体系中的表达
将构建好质粒转入谷氨酸棒杆菌CGMCC 1.15647中表达,IPTG 诱导24 h后收集发酵上清液作为胞外分泌表达样品,将离心沉淀菌体作超声破碎,收集破碎上清液和破碎沉淀分别作为胞内可溶蛋白样品及包涵体形式蛋白样品。如图2a 所示,SDS-PAGE和Western blot试验结果表明,与对照组相比,不管是胞外分泌、胞内可溶或胞内包涵体形式,ApxⅡ全长蛋白质(约100 ku)均未在谷氨酸棒杆菌CGMCC 1.15647 中表达。推测可能是谷氨酸棒杆菌内部翻译系统导致全长ApxⅡ并未被完整翻译。针对全长ApxⅡ在谷氨酸棒杆菌中不表达情况,截短全长ApxⅡ。
2.2 截短ApxⅡ在谷氨酸棒杆菌中的分泌表达
针对全长ApxⅡ表达困难问题,对ApxⅡ进行截短,其中文献[6]中报道截短ApxⅡ#5片段具有和全长一样的免疫效果,因此选取ApxⅡ#5片段作分泌表达,如图1b 所示。通过引物和酶切验证pX⁃MJ19-ApxⅡ#5质粒(见图2b),测序正确后将其转化入谷氨酸棒杆菌CGMCC1.15647 中表达,诱导24 h 后收集发酵上清液,破碎上清液和破碎沉淀,如图2c下图,Western blot显示,泳道L4和L7与对照组L1相比,在50 ku出现明显条带,说明截短ApxⅡ可在谷氨酸棒杆菌中分泌表达。同时,SDS-PAGE中泳道L4和L7并无明显条带,说明截短ApxⅡ#5分泌到胞外的产量较低,并不能在SDS-PAGE上直接看出。综上,截短ApxⅡ蛋白大小在50 ku,能成功在谷氨酸棒杆菌中分泌表达,但蛋白产量较低。因此进一步优化表达宿主谷氨酸棒杆菌中表达元件增强pXMJ19载体表达强度,提高ApxⅡ#5产量。
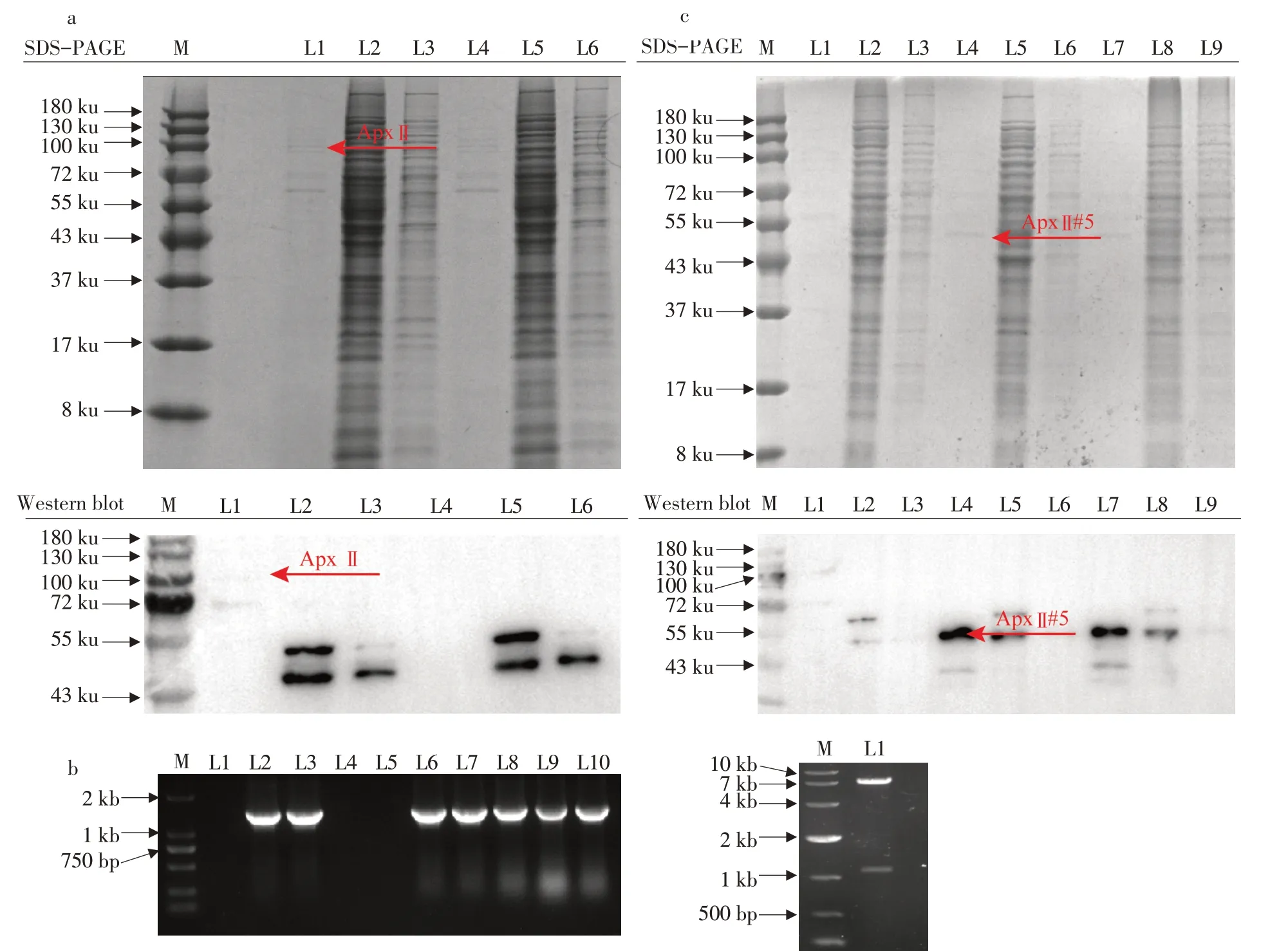
图2 全长和截短ApxⅡ表达Fig.2 Expression of full length and truncated ApxⅡ
2.3 ApxⅡ#5启动子筛选
在谷氨酸棒杆菌CGMCC1.15647成功分泌表达ApxⅡ#5 后,参照文献[19]选取8 种低、中、高不同表达强度全合成组成型启动子(见图3a),与目前表达ApxⅡ#5 所用诱导型启动子tac比较,找到表达强度最强启动子。将不同启动子构建至表达载体pXMJ19-EGFP 中并用KasⅠ和XhoⅠ酶切验证(见图3b)。EGFP检测不同启动子表达强度,将成功构建具有不同启动子的表达载体pXMJ19-EGFP 转化至谷氨酸棒杆菌CGMCC1.15646 中表达。以含pXMJ19的CGMCC 1.15646 转化子作为阴性对照,利用EGFP荧光强度对比不同启动子表达强度。如图3c所示,组成型启动子中,H36荧光强度最高,但与对照组tac启动子相比,组成型H36启动子强度仅为tac启动子63.23%,因此继续选用诱导型tac启动子作为ApxⅡ#5 表达载体中启动子。通过图2c中SDS-PAGE 可见,ApxⅡ#5分泌表达量过少,很难在SDS-PAGE上清晰看出具体条带,为进一步提高ApxⅡ#5分泌表达产量,筛选表达元件中信号肽。

图3 ApxⅡ#5启动子筛选Fig.3 Screening of promoters of the truncated protein ApxⅡ#5
2.4 ApxⅡ#5信号肽筛选
在成功选用tac作为谷氨酸棒杆菌表达载体启动子后,如图4a 所示,挑选谷氨酸棒杆菌基因组中五种不同信号肽Cg1514、CspA、CgR0949、PorB 和CspB 进行蛋白表达强度筛选,并成功构建不同信号肽表达载体pXMJ19-ApxⅡ#5-His。通过对比蛋白质纯度来检测不同信号肽对ApxⅡ#5在谷氨酸棒杆菌中分泌表达的影响。将成功构建具有不同信号肽的表达载体转化至谷氨酸棒杆菌CGMCC1.15647分泌表达。对比不同信号肽表达载体的SDS-PAGE 及Western blot(见图4b),用Im⁃age J进行灰度分析,以相对表达量最低的CgR0949信号肽作为相对表达量为1的对照组,其中相对表达较高的是信号肽Cg1514、CspA及CspB,分泌表达强度分别为对照组4.08、5.03 及5.48 倍。最后,选择信号肽CspB 作为表达载体pXMJ19-ApxⅡ#5-His 信号肽,得到表达载体pXMJ19-tac-CspB-ApxⅡ#5。
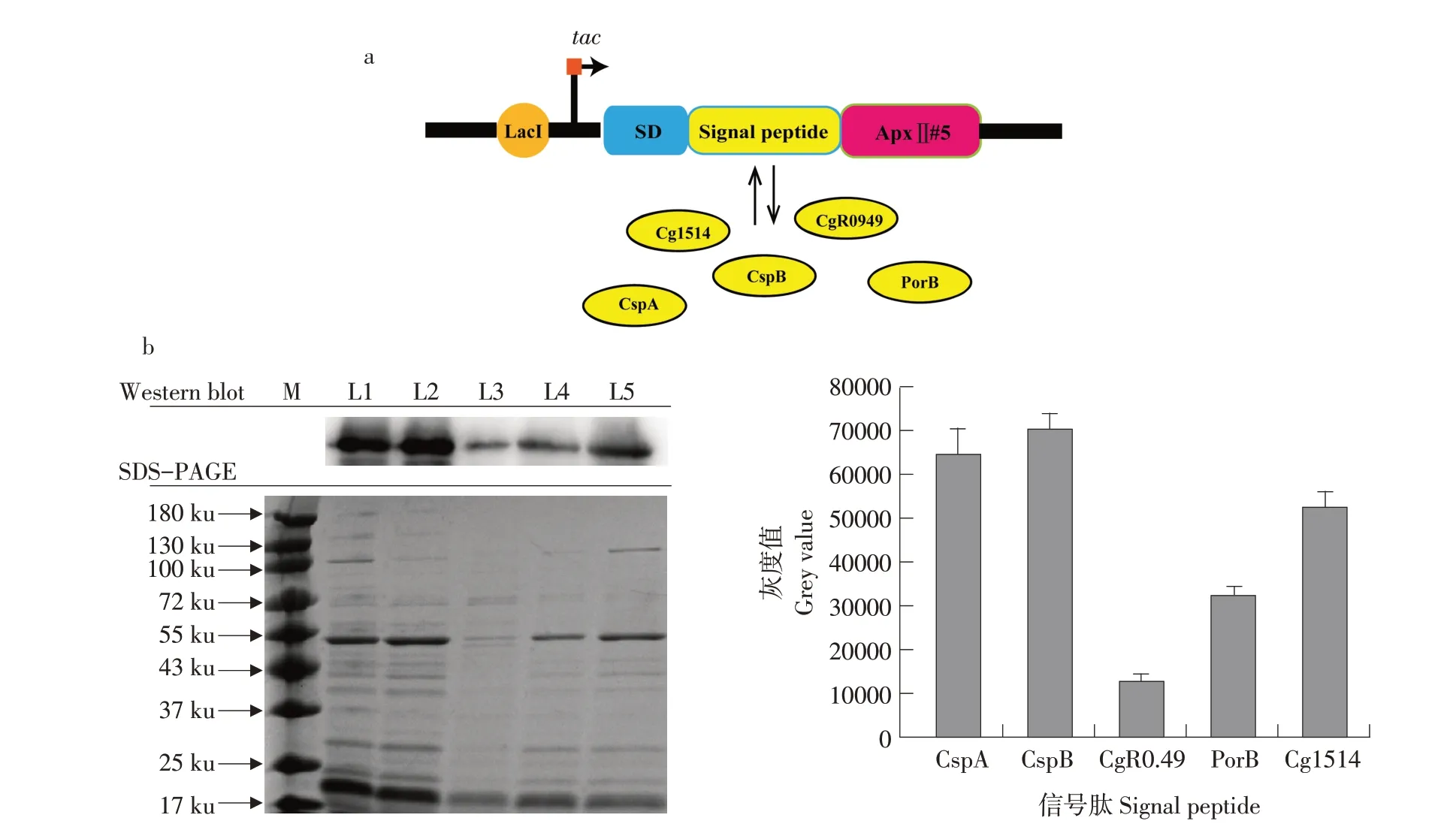
图4 ApxⅡ#5信号肽筛选Fig.4 Screening of the signal peptides of ApxⅡ#5
2.5 ApxⅡ#5 在谷氨酸棒杆菌CGMCC1.15647 的发酵表达及免疫活性
目前具有最强表达能力的载体组合(pXMJ19-tac-CspB-ApxⅡ#5)在摇瓶中发酵表达ApxⅡ#5(50 ku)并检测ApxⅡ#5 免疫活性。纯化结果如图5a 所示,纯化后ApxⅡ#5 蛋白在45 ku 降解,通过在SDS-PAGE 用BSA 标品进行蛋白定量(见图5b、c),ApxⅡ#5在摇瓶中蛋白产量为51.1 mg·L-1。一抗为猪胸膜肺炎抗体阳性血清,二抗为HRP羊抗猪IgG,ELISA检测ApxⅡ#5活性并测量反应后A450吸光值,吸光值(ApxⅡ#5)>2.1吸光值(Control对照),说明ApxⅡ#5具有活性(见图5d、e)。
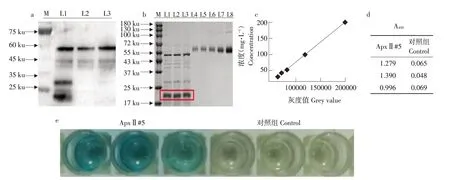
图5 ApxⅡ#5在谷氨酸棒杆菌中胞外分泌表达及活性测定Fig.5 Extracellualr secretion expression and activity of truncated protein ApxⅡ#5 in C.glutamicum
3 讨论与结论
猪胸膜肺炎疫苗主要分为活疫苗、亚单位疫苗和基因工程疫苗。其中灭活疫苗抗体效价低且交叉保护性差,Liao等制作猪胸膜肺炎灭活口服疫苗进行免疫试验,发现灭活口服疫苗组感染概率为40%,且不同血清型之间缺少交叉保护,需根据地区流行性制备多价灭活疫苗[20]。单一亚单位疫苗成本过高,Oishi 等通过测试体外培养猪胸膜肺炎三种血清型制备的抗原,发现其可提供高达90%~100%同源保护率,但体外培养成本较高[21]。基因工程疫苗可将特定抗原表位克隆表达并减少多余片段,最大限度保留亚单位疫苗免疫原性。因此,重组亚单位疫苗结合两者,是工业化不二之选,Seah等通过截取ApxⅠ细胞毒素N端40-388号氨基酸制成重组亚单位疫苗,成功提供免疫保护[22];Wang 等将单个或多个不同的细胞毒素ApxⅠ、ApxⅡ、ApxⅢ和外膜蛋白Omp 制成多组分重组亚单位疫苗,对不同血清型猪胸膜肺炎均具备保护作用[23]。目前,猪胸膜肺炎亚单位疫苗Apx主要由大肠杆菌发酵生产。李鹏通过大肠杆菌BL21生产ApxⅢA和ApxⅣA亚单位疫苗,但得到Apx蛋白样品为包涵体,增加工业化纯化成本[24]。利用谷氨酸棒杆菌分泌表达重组疫苗蛋白ApxⅡ,是一种全新疫苗生产微生物体系。谷氨酸棒杆菌多用于生产氨基酸[25],用于疫苗蛋白生产较少,未充分利用其分泌表达异源蛋白潜力。通过谷氨酸棒杆菌分泌表达猪胸膜肺炎疫苗不仅可规避大肠杆菌表达体系内毒素问题,还可大幅减少疫苗蛋白下游纯化过程,降低疫苗生产成本。
本研究通过谷氨酸棒杆菌分泌表达截短猪胸膜肺炎重组亚单位疫苗ApxⅡ并筛选表达载体中启动子tac和信号肽CspB 提高产量。最终ApxⅡ#5在摇瓶中诱导发酵24 h表达量为51.1 mg·L-1,通过ELISA试剂盒检测到抗原活性。使用谷氨酸棒杆菌生产的猪胸膜肺炎亚单位疫苗ApxⅡ相较大肠杆菌具有无内毒素、胞外分泌等特点,结合成熟培养工艺和遗传操作技术,可快速构建表达高效、生产成本低的猪胸膜肺炎疫苗生产体系。但在研究中发现,ApxⅡ#5 在胞外分泌过程中产生约20 ku蛋白(见图5b),经质谱鉴定,该肽段由ApxⅡ#5降解产生,后续可通过减少ApxⅡ#5降解进一步提高产量。
目前,谷氨酸棒杆菌分泌表达猪胸膜肺炎亚单位疫苗ApxⅡ研究较少,限制猪胸膜肺炎疫苗生产多样性。研究谷氨酸棒杆菌分泌表达截断猪胸膜肺炎亚单位疫苗ApxⅡ,对未来猪胸膜肺炎疫苗研制具有指导意义,为国家疫苗产业提供可用、低成本微生物表达体系。

