AGPAT6在奶牛乳腺上皮细胞乳脂合成中的功能研究
林 叶,刘 灿,江 怡,宫晓庆,刘川萍,杨 洋,侯晓明
(东北农业大学动物细胞与遗传工程黑龙江省重点实验室,哈尔滨 150030)
乳脂是牛奶中重要营养物质,相对于其他脂类更易消化吸收。甘油三酯(Triglyceride,TAG)是乳脂主要成分,在乳脂中约占98%[1]。因此,提高原料乳乳脂率需深入研究奶牛乳腺上皮细胞中TAG 合成调控机制。TAG 合成受多种基因、关键酶调控。陈坤琳等以中国荷斯坦奶牛为试验材料发现奶牛乳腺上皮细胞中TAG 合成受到PPARγ、SREBP1 等转录因子调控[2]。溶血磷脂酸酰基转移酶(Sn-1-acylglycerol-3-phosphate O-acyltransfer⁃ase 6,AGPAT6)是TAG 合成过程中重要酶,催化溶血磷脂酸酰基化形成磷脂酸,随后磷脂酸在二酰基甘油酰基转移酶作用下合成TAG[3]。Beigneux等研究发现AGPAT6 缺陷型小鼠乳腺发育障碍,乳脂合成和分泌明显降低,脂质代谢失调,导致磷脂酸、甘油二酯和TAG 合成减少[4-5]。Lee 等和Lv 等在牦牛和猪乳腺研究中发现AGPAT6 可与其他乳脂合成相关基因协调作用促进TAG 合成[6-7]。Kadegowda 等在奶牛乳腺中证明AGPAT6 的mRNA在泌乳期上调表达[8],提示其可能在泌乳奶牛乳脂合成过程中具有调节作用,但具体功能和调节机制尚不明确。
磷脂酰肌醇-3 激酶(Phosphatidylinositol 3 ki⁃nase,PI3K)可应答外源氨基酸、脂肪酸、激素等营养素刺激[9],通过激活AKT激酶,促进细胞中蛋白质和脂类物质生物合成[10-12]。在乳腺中,PI3KAKT信号通路在乳脂合成调控过程中处于中心枢纽位置。Knudsen 和张娜等研究发现,外源营养素可通过PI3K- AKT 信号促进下游DGAT1、FABP3、LPIN、SLC22A7 等基因表达上调,调控细胞中脂类合成[13-14]。Li等在泌乳的山羊乳腺中已证明短链脂肪酸可通过PI3K-AKT-SREBP-1c信号通路促进乳脂合成[15]。Li等研究发现短链脂肪酸也激活牛乳腺上皮细胞中GPRC6A-PI3K-FABP5 信号通路,促进乳脂合成[16]。然而在泌乳奶牛乳腺上皮细胞中,AGPAT6 与PI3K-AKT 信号通路之间关系尚不清楚,AGPAT6 调节乳脂合成是否通过PI3K-AKT介导,还需通过试验验证。
本研究以不同生理时期奶牛乳腺组织为原料,采用荧光定量PCR 和Western blot 技术首先研究AGPAT6在奶牛乳腺组织中表达模式,随后利用乙酸诱导具有乳脂合成能力的奶牛乳腺上皮细胞模型,研究AGPAT6过表达或抑制对乳脂合成的调节以及AGPAT6与PI3K-AKT-mTOR信号通路激活和乳脂合成之间关系,旨在阐明AGPAT6在奶牛乳腺乳脂合成中的调控作用。
1 材料与方法
1.1 主要试剂和仪器
主要试剂:Ⅰ型胶原酶(购自上海Sigma),DMEM/F 12(购自美国Life technology),细胞总RNA微量抽提试剂盒(购自广州美基生物科技有限公司),反转录试剂盒(购自思科捷生物技术有限公司),TAG检测试剂盒(购自北京普利来基因技术有限公司),BCA 浓度检测试剂盒(购自大连TaKaRa),EcoRⅠ和HindⅢ限制性内切酶(购自美国Ther⁃mo),Lipofectamine 2000(购自美国Invitrogen),siRNA-mate、AGPAT6 siRNA(购自上海吉玛基因),AGPAT6 抗体(购自美国Proteintech),β-ACTIN 抗体(购自武汉ABclonal),AKT、mTOR、P70S6K、4E-BP1、p-AKT、p-mTOR、p-P70S6K、p-4E-BP1(购自美国Cell Signaling Technology)。
主要仪器:CO2细胞培养箱(购自美国Ther⁃mo),DFC280 倒置显微镜(购自德国Leica),PCR仪(购自美国Eppendoff),Real Time PCR system(购自美国Applied Biosystems),酶标仪(购自美国Thermo),化学发光成像系统(购自北京赛智生物制品有限公司)。
1.2 奶牛乳腺组织获取
取健康新鲜青春期12月、泌乳90日以及干奶30日奶牛乳腺组织,75% 乙醇消毒后,反复清洗;在无菌环境下去除结缔组织和脂肪组织,剪成约1 cm3小块置于液氮中速冻,-80 ℃保存,用于后续RNA和蛋白提取。
1.3 荧光定量PCR检测乳腺组织中AGPAT6表达
将乳腺组织用液氮研磨至粉末,利用组织/细胞RNA 微量提取试剂盒提取不同时期乳腺组织RNA,反转录成cDNA。利用荧光定量PCR方法检测AGPAT6 mRNA在不同生理时期表达情况。所用AGPAT6和β-ACTIN基因引物如表1所示。
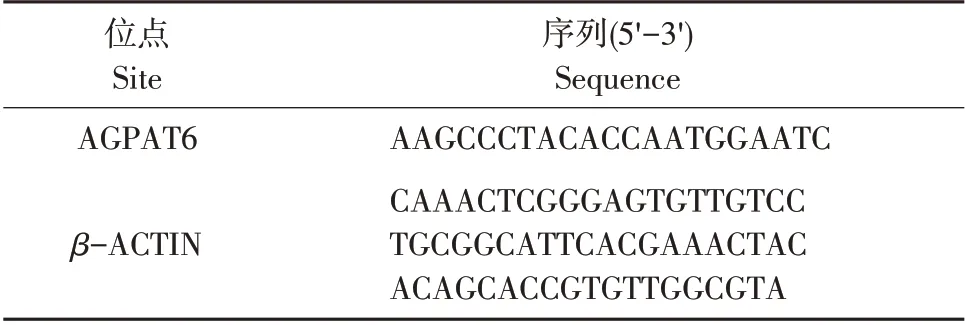
表1 荧光定量PCR引物序列Table 1 Sequences of quantitative PCR primer
反应循环条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸34 s,共40 个循环,以β-ACTIN 的CT 值为内参,AGPAT6 基因表达量计算方法为2-ΔΔCT,ΔCT=CTAGPAT6-CTβ-ACTIN。
1.4 奶牛乳腺上皮细胞培养、纯化与鉴定
采用胶原酶消化法从健康泌乳期奶牛乳腺实体组织中分离乳腺上皮细胞[17]。将剪碎的乳腺组织用胶原酶在37 ℃下消化3 h,过滤后室温下1 000 g离心3次,每次10 min。将原代细胞置于含10% 胎牛血清DMEM/F12 培养液中,同时添加青霉素(100 U·mL-1)、链霉素(100 μg·mL-1),放置在5%CO237 ℃培养箱中培养。待单层细胞铺满培养皿后用胰蛋白酶消化,传代3次后即可获得纯化乳腺上皮细胞。
将1×105个纯化后细胞接种至3.5 cm 培养皿中,用4%多聚甲醛固定后加入5%BSA 的PBST 溶液进行封闭,然后用角蛋白18(Keratin 18,CK18)抗体(兔源,1∶50 稀释)4 ℃孵育过夜,清洗一抗后用FITC 标记山羊抗兔的二抗(1∶200 稀释)孵育1 h,用1 μg·mL-1DAPI 染细胞核,激光共聚焦显微镜观察CK18在细胞中表达。将纯化的乳腺上皮细胞接种于6 孔板中,待细胞生长至70% 融合单层用无脂无血清培养液饥饿过夜,然后更换新的含12 mmol·L-1乙酸钠无脂无血清培养液培养,诱导细胞中脂类合成后用于后续试验。
1.5 AGPAT6表达载体构建
设计AGPAT6 基因特异性引物(见表2),以牛cDNA 为模板扩增牛AGPAT6 基因。将扩增序列和pcDNA3.1载体分别作EcoR Ⅰ和HindⅢ双酶切后连接构建重组体pcDNA3.1-AGPAT6,并转化感受态细胞。构建重组体送至哈尔滨擎科生物公司测序,利用DNAMAN软件与NCBI数据库中序列作比对。

表2 PCR引物序列Table 2 Sequences of PCR primer
1.6 转染
当细胞中AGPAT6 过表达时,将2×105个乳腺上皮细胞接种到6 孔板中,待其密度接近70%时采用Lipofectamine 2000 将2.5 μg pcDNA3.1-AG⁃PAT6 载体转染至细胞中,以pcDNA3.1(+)作为对照;当AGPAT6 过表达同时抑制PI3K 时,在转染pcDNA3.1-AGPAT6 的细胞中加入50 μmol·L-1LY294002,对照组中加入等量DMSO,48 h进行后续检测;当干扰细胞中AGPAT6表达时,利用siR⁃NA-mate将6 μL siAGPAT6(20 μmol·L-1)转染至细胞中,以Negative control(20 μmol·L-1)为对照,转染后细胞继续在37 ℃、CO2培养箱中培养48 h作后续检测;AGPAT6 siRNA干扰片段序列见表3。

表3 干扰片段序列Table 3 Sequences of interfering fragments
1.7 Western blot 检测AGPAT6 及相关信号通路分子表达
收集奶牛乳腺组织,用液氮研磨至粉末状态后,加入适当裂解液低温充分裂解混匀组织,12 000 r·min-1离心10 min,取上清备用;对不同处理奶牛乳腺上皮细胞,采用适当细胞裂解液低温裂解细胞,12 000 r·min-1离心10 min,取上清备用。采用BCA 浓度测定试剂盒测定乳腺组织或乳腺上皮细胞总蛋白浓度,然后将20 μg蛋白经10%SDS-PAGE凝胶电泳分离,并转移至NC膜。NC膜用含5%脱脂乳、0.1%(V/V)Tween-20的Tris缓冲液封闭2 h,然后与AGPAT6、AKT、mTOR、P70S6K、4E-BP1、p-AKT、p-mTOR、p-P70S6K、p-4EBP1特异性抗体(所有抗体皆为兔源,1∶1 000稀释)4 ℃孵育过夜。将NC 膜用TBST 冲洗3 次后,用FITC标记的山羊抗兔IgG 37 ℃下孵育1 h。TBST洗涤NC膜,采用增强化学发光检测系统检测印迹。
1.8 TAG 含量测定
裂解液低温处理细胞约10 min,短暂离心后收集上清,普利莱TAG 检测试剂盒测定不同处理牛乳腺上皮细胞TAG 含量;相应细胞样品蛋白浓度由BCA 浓度检测试剂盒测定,每个处理重复3 次,最终结果由细胞中总TAG 含量(mg)除以细胞总蛋白(mg)含量表示。
1.9 数据处理与统计分析
试验所用PCR 引物由PREMIER 5.0 软件设计;Western blot 条带使用Image-Pro Plus 6.0 灰度扫描;试验数据以平均值±标准误表示,采用GraphPad Prism 6 软件统计分析数据。使用t-检验方法比较2组数据;使用单因素方差分析以及Bon⁃ferroni 多重比较方法分析3组以上数据。
2 结果与分析
2.1 AGPAT6在奶牛乳腺组织中表达
为比较AGPAT6基因在奶牛不同生理时期乳腺组织中表达,本试验首先通过荧光定量PCR方法检测青春期、泌乳期及干奶期奶牛乳腺组织中AGPAT6基因mRNA 水平表达变化。结果如图1A 所示,AGPAT6 mRNA在泌乳期奶牛乳腺组织中表达极显著高于青春期和干奶期(P<0.01)。随后采用Western blot方法检测不同生理时期奶牛乳腺组织中AGPAT6蛋白水平表达变化,以β-ACTIN为内参。结果显示AGPAT6在泌乳期奶牛乳腺组织中表达极显著高于青春期和干奶期(见图1B、C,P<0.01)。
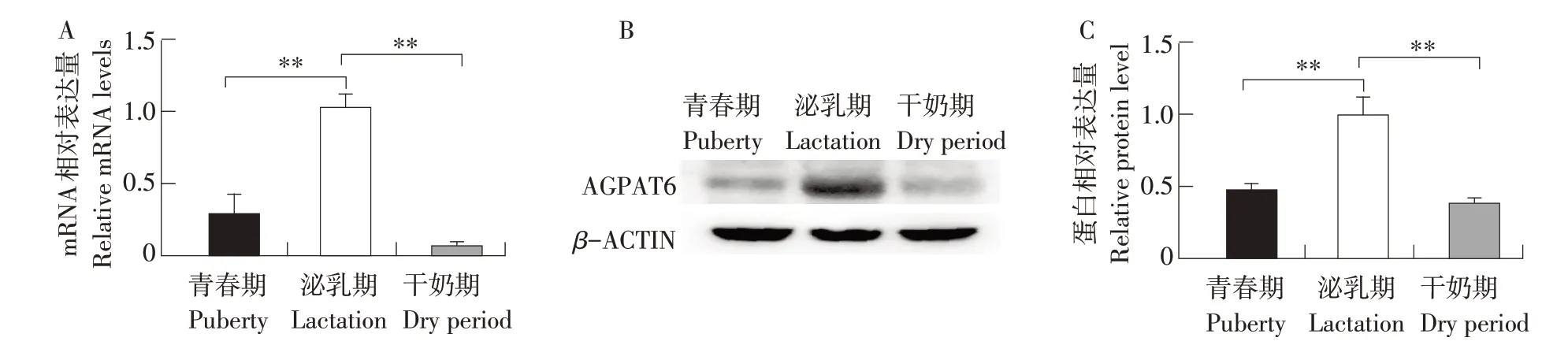
图1 奶牛乳腺组织中AGPAT6的表达Fig.1 Expression of AGPAT6 in mammary tissues of dairy cows
2.2 奶牛乳腺上皮细胞培养与鉴定
本研究采用胶原酶消化法获得原代奶牛乳腺上皮细胞。图2A 显示相差显微镜下观察到的细胞形态呈现岛屿状。由于CK18是奶牛乳腺上皮细胞标志性表达蛋白,所以采用免疫荧光方法检测是否纯化出奶牛乳腺上皮细胞,结果显示细胞核呈蓝色(见图2B-a),绿色标记的CK18分布于细胞质中(见图2Bb),表明该细胞为已纯化的奶牛乳腺上皮细胞(见图2B)。用12 mmol·L-1乙酸钠作用于奶牛乳腺上皮细胞,Western blot结果显示12 mmol·L-1乙酸钠处理细胞中AGPAT6表达比对照组高约52%(见图2C、D),细胞中TAG含量也极显著增加(见图2E;P<0.01),提示乙酸钠可诱导奶牛乳腺上皮细胞中AGPAT6表达上调及TAG 合成,因此这种细胞模型可用于AGPAT6对奶牛乳腺上皮细胞乳脂合成的调节研究。

图2 奶牛乳腺上皮细胞培养鉴定及乙酸钠对乳脂合成的影响Fig.2 Identification of mammary epithelial cells of dairy cows and the effect of sodium acetate on AGPAT6 expression and milk fat synthesis
2.3 AGPAT6 基因对奶牛乳腺上皮细胞乳脂合成的影响
为研究AGPAT6基因对奶牛乳腺上皮细胞乳脂合成影响,本研究将牛pcDNA3.1-AGPAT6 质粒转染至乙酸钠处理的奶牛乳腺上皮细胞,以pcD⁃NA3.1(+)作为阴性对照。Western blot 结果显示pcDNA3.1-AGPAT6 转染的奶牛乳腺上皮细胞中AGPAT6 表达极显著高于对照组(见图3A、B;P<0.01);AGPAT6 过表达极显著提高细胞中TAG 含量(见图3C;P<0.01)。相反,将AGPAT6 siRNA片段转染至乙酸钠处理的奶牛乳腺上皮细胞中,AGPAT6 siRNA 极显著降低细胞中AGPAT6 表达(见图3D、E;P<0.01)以及乙酸钠诱导的TAG合成(见图3F;P<0.01)。以上结果表明AGPAT6正向调节奶牛乳腺上皮细胞中乳脂合成。

图3 AGPAT6对奶牛乳腺上皮细胞中乳脂合成的影响Fig.3 Effect of AGPAT6 on milk fat synthesis in mammary epithelial cells of dairy cows
2.4 AGPAT6 通过PI3K-AKT-mTOR 信号通路调节乳脂合成
为研究AGPAT6调节乳脂合成的信号通路,本研究将pcDNA3.1-AGPAT6载体转染至12 mmol·L-1乙酸钠处理的奶牛乳腺上皮细胞。结果显示AG⁃PAT6过表达对AKT、mTOR、p70S6K及4E-BP1表达无影响,但极显著提高细胞中p-AKT、p-mTOR、p-P70S6K、p-4E-BP1表达(见图4;P<0.01)。

图4 AGPAT6过表达对PI3K-AKT-mTOR信号通路的影响Fig.4 Effect of AGPAT6 overexpression on PI3K-AKT-mTOR signaling pathway
为进一步确定AGPAT6 是否通过激活PI3KAKT-mTOR 信号通路调节乳脂合成,本研究采用50 μmol·L-1LY294002(PI3K-AKT 信号通路抑制剂)处理AGPAT6 过表达奶牛乳腺上皮细胞。结果显 示LY294002 降 低AGPAT6 对p- AKT、 pmTOR、p-P70S6K 以及p-4E-BP1 激活作用(见图5A,B;P<0.01);与AGPAT6 过表达但未添加LY294002 处理细胞比较,LY294002 使AGPAT6 诱导TAG合成下降约57%(见图5C)。
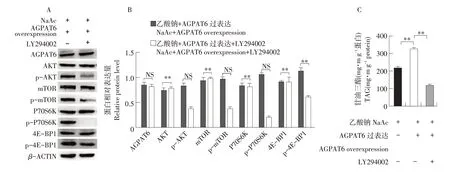
图5 抑制PI3K信号通路降低AGPAT6对乳脂合成的诱导作用Fig.5 Effect of PI3K inhibition on AGPAT6-induced milk fat synthesis
该结果表明在奶牛乳腺上皮细胞中AGPAT6通过激活PI3K-AKT-mTOR信号通路调节奶牛乳腺上皮细胞中TAG合成。
3 讨 论
AGPAT6 是脂类合成相关基因。Beigneux 等在水牛中研究发现,AGPAT6主要在棕色脂肪组织和乳腺组织中表达[4],Vergnes 等研究发现在小鼠中,AGPAT6 缺陷导致雌鼠乳腺发育障碍、体重下降,不会发生高脂饲料诱导以及基因诱导的肥胖现象,表明AGPAT6介导乳腺和脂肪组织中脂类合成过程[17]。本研究通过荧光定量PCR 和Western blot方法研究奶牛不同生理时期乳腺组织中AGPAT6表达,结果显示AGPAT6 mRNA和蛋白质水平在泌乳期奶牛乳腺组织中表达均极显著高于青春期和干奶期,进一步提示AGPAT6可在奶牛乳腺泌乳过程中发挥调控作用。
前期研究表明,AGPAT6 基因促进小鼠脂肪合成相关组织中脂类合成代谢[17-19]。Nagle 等在AGPAT6敲除的小鼠中发现白色脂肪组织、棕色脂肪组织、肝脏以及乳腺上皮细胞中TAG 含量显著降低[5]。在奶山羊中,AGPAT6被He等考虑作为泌乳性状筛选候选基因[19]。金鑫等在泌乳奶牛乳腺中发现,短链脂肪酸可促进乳脂合成[20-22]。本试验采用乙酸钠处理体外培养的奶牛乳腺上皮细胞,结果显示乙酸钠可极显著提高细胞中AGPAT6表达和TAG 合成。因此本研究以12 mmol·L-1乙酸钠作为牛乳腺上皮细胞外源刺激物,研究AGPAT6 对奶牛乳腺上皮细胞中乳脂合成的影响,结果显示AG⁃PAT6 过表达极显著提高细胞中TAG 含量,而AG⁃PAT6基因沉默后TAG 含量极显著降低。这些结果表明,在泌乳期奶牛乳腺上皮细胞中AGPAT6可正向调节乳脂合成。
PI3K-AKT信号通路是细胞内物质代谢核心通路,其可应答激素、氨基酸等外源营养物质促进细胞中脂类和蛋白质合成[23-24]。Chen 等研究表明PI3K-AKT 激活后促使mTOR 发生磷酸化,继而激活下游调控蛋白[25]。本研究通过Western blot方法证明AGPAT6过表达促进AKT、mTOR、p70S6K、4EBP1 蛋白磷酸化水平;当细胞中添加PI3K 抑制剂LY294002 后,在添加乙酸钠的乳腺上皮细胞中即使过表达AGPAT6,TAG合成也不再提高,进一步明确AGPAT6通过PI3K-AKT-mTOR通路,促进牛乳腺上皮细胞乳脂合成。本试验在细胞水平上明确AGPAT6在奶牛乳腺乳脂合成中作用,为进一步深入研究乳脂合成调控机制提供理论支持。
4 结 论
研究发现AGPAT6基因在泌乳期奶牛乳腺组织中高表达,在奶牛乳腺上皮细胞中正向调控乳脂合成;AGPAT6基因通过激活PI3K-AKT-mTOR 信号通路调节乳脂合成。

