转运RNA衍生片段在甲状腺癌发病机制中的作用
彭妙官,赖英荣
(1.广州医科大学附属第三医院内分泌科,广东广州 510150;2.中山大学附属第一医院病理科,广东广州 510080)
甲状腺癌(thyroid cancer,TC)是最常见的内分泌恶性肿瘤,发病率在世界范围呈上升趋势,已成为全球成年女性中第五大常见癌症,其中最常见的病理类型是甲状腺乳头状癌(papillary thyroid cancer,PTC)[1]。大多数患者预后良好,但仍有患者预后较差。microRNA 表达的改变是甲状腺癌进展和发展的重要调控因子[2]。tsRNA(tRNA-derived small RNA)以类似microRNA的方式参与RNA干扰而发挥生物学作用[3]。tsRNA与癌症的关系引起研究者广泛的关注,其中,tRNA 衍生片段(tRFs)3'tiR_026_GlnCTG(n)(命名来自数据库MINTbase v2.0,https://cm.jefferson.edu/MINTbase/,名称:tRF-41-XEKJ5R5N2E489B3RB,序 列:TGAATCCAGCGATCCGAGTTCAAATCTCGGTGGAACCTC -CA,来源于tRNAGln-CTG 的一个3'tRNA),参与调控肿瘤细胞的增殖、转移、进展和生存,在对抗肿瘤方面具有巨大的临床潜力,有望作为诊断和判别癌症预后的生物标志物或作为精确治疗的靶点[4]。tRFs 在多种恶性肿瘤中上调并促进肿瘤增殖和转移,但tRFs 在PTC 的致癌作用尚不清楚。本研究旨在阐明tRFs 的生物学功能及其在PTC 中调节MEK/ERK/p90RSK 信号通路中的作用。因此,tRFs可能成为甲状腺癌的潜在治疗靶点。
1 材料与方法
1.1 研究对象
纳入2019 年10 月至2020 年10 月确诊为甲状腺乳头状癌并接受手术治疗的患者,术前均未接受相关治疗,其临床与病理资料完整。诊断经病理医生确认。排除标准:结节性甲状腺肿、滤泡状甲状腺癌、髓样癌、未分化癌。本研究纳入58 例患者,均经组织病理学明确诊断。收集癌组织及邻近正常甲状腺组织标本,并立即保存于-80 ℃冰箱中。同时收集患者的临床信息,包括年龄、性别、肿瘤大小,是否多中心性,是否甲状腺外浸润、淋巴结浸润、远处转移,TNM 分期等。本研究经机构研究伦理委员会批准(医伦专审[2021]第312 号),所有患者均已签署知情同意书。
1.2 甲状腺癌细胞系
选择人PTC 细胞系:KTC1 和BCPAP。PTC 细胞培养于Dulbecco's modified Eagle's 培养基(DMEM;Invitrogen)。细胞系在10 g/L 胎牛血清中培养(FBS;Gibco,Gaithersburg,MD)。培养环境保持在37 ℃,5%CO2,100%湿度。RNA 寡核糖核苷酸肽段(广州锐博生物技术有限公司)参照制造商的说明书,使用Lipofectamine 3000(Invitrogen)转染。
1.3 实验和检测方法
1.3.1 tRNA 衍生片段芯片检测 从两例PTC 患者的肿瘤组织和邻近的甲状腺组织中提取总RNA,使用nrStarTM Human tRF&tiRNA PCR 芯片进行检测(Arraystar,Lnc.Rockville,MD 20850 USA.Cat#:AS-NR-002-1)。样品制备和微阵列芯片检测方法遵循Arraystar标准方案。
1.3.2 细胞转染 细胞以每孔2×105的数量在6 孔板中铺板,瞬时转染浓度为50 nmol/L。根据制造商的说明书指引,使用Lipofectamine®3000 转染试剂盒(Invitrogen)转染mimic 和阴性对照(NC)。Mimic 和NC 由广州锐博生物帮助合成。3'tiR_026_GlnCTG(n)Mimic 和NC 的目标序列如下:5’-UGAAUCCAGCGAUCCGAGUUCAAAUCUCGGUG -GAACCUCCA-3’。转染48 h 后,收集细胞并用于进一步的检测。
1.3.3 RNA 提取及qRT-PCR 分析 总RNA 是利用Trizol(Invitrogen)按照制造商的说明进行分离的。通过260 nm(A260)光吸光度和(A260/A280)比值测定RNA 浓度和质量。3'tiR_026_GlnCTG(n)通过定量逆转录-PCR(q-RT-PCR)方法,以U6 为内参进行定量。专门针对3'tiR_026_GlnCTG(n)的Bulge-Loop™tRFs q-RT-PCR 引物组(每组一个RT引物和一对qPCR引物)由广州锐博生物设计。3'tiR_026_GlnCTG(n)RT引物(miR8005394)、miR-反向引物(ssD089261711)和3'tiR_026_GlnCTG(n)正向引物(miR8005395)的序列是特异的。tRFs用PrimeScriptTM tRFs RT-PCR Kit(TaKa-Ra)逆转录,用SYBR Premix ExTaqTM(TaKaRa)通过qRT-PCR 进行定量。PCR 循环参数如下:50 ℃2 min,95 ℃10 min;95 ℃15 s,60 ℃1 min 进行40个循环。MEK/ERK 特异性抑制剂PD98059(产品编号:S1805),配置浓度25 µmol/L(江苏碧云天生物技术公司)。
1.3.4 Transwell细胞迁移实验 转染48 h后,用胰酶消化细胞,用无血清DMEM培养液重悬细胞并调整细胞密度。在Transwell 培养板下室中加入600µL 含10%胎牛血清的完全培养基,将小室置于培养板中,注意排出上下室接触面的气泡,取200 µL 重悬细胞液,加入上层小室中。于培养箱培养24 h 后,弃去小室中的培养基,用棉签轻轻拭去上层小室里的细胞。将小室置于40 g/L 多聚甲醛中,室温固定20 min,用质量分数0.1%结晶紫溶液染色30 min,自来水漂洗多余染料,用倒置显微镜进行拍照,随机选取5个视野进行细胞计数。
1.3.5 Transwell 细胞侵袭实验 将Matrigel 从-80 ℃冰箱中取出,于4 ℃冰箱过夜溶解,将Matrigel与无血清DMEM 培养基按照1:8 比例混匀,将装有稀释混合液的EP 管置于冰上,每个小室中加入50µL 稀释混合液进行包被,避免小室上层底部产生气泡,于37 ℃培养箱中静置1 h 使Matrigel 凝固;余步骤同Transwell细胞迁移。
1.3.6 划痕实验 通过划痕实验来评估细胞的运动性。将细胞接种在6 孔板中。待细胞生长至90%~95%的融合度时,使用10µL小枪头借助直尺制造细胞划痕,使划痕方向与标记线垂直。用PBS冲洗培养孔2~3 次,充分洗去漂浮细胞并更换培养基为无血清DMEM培养基;用显微镜观察并拍照记录0 h及24 h划痕区细胞迁移情况。
1.3.7 细胞增殖实验 采用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)(Sigma-Aldrich,St.Louis,MO)比色法测定细胞活力。转染24 h后,以每孔5 000个细胞的密度,把细胞接种在96 孔板中。MTT 法测定细胞接种后24 h、48 h 和72 h 的细胞存活率。移去培养基后,每孔加入200µL 二甲亚砜(DMSO)(Amresco Inc.,Solon,OH,USA)。然后振荡30 min,使用多功能酶标仪(Tecan)测定490 nm 处的吸光度。每个样本分析3次,一式3份。
1.3.8 蛋白免疫印迹 蛋白免疫印迹(Western Blotting,WB)的实验方法参考既往文献报道[5]。用于免疫印迹的一抗(Phospho-Erk1/2 Pathway Sampler Kit#9911)购买自Cell Signaling Technology(CST)公司。这些抗体分别如下:rabbit anti-human Phospho-MEK1/2(Ser217/221)(Cell Signaling Technology,Beverly,MA#9154),rabbit anti-human Phospho-p44/42 MAPK(Erk1/2)(Thr202/Tyr204)(#4370),rabbit anti-human Phospho-p90RSK(Ser380)(#11989),Anti-rabbit IgG(#7074)。用含有质量分数5%脱脂奶粉的PBS 封闭1 h,然后与一抗在4 ℃孵育过夜。第二天,膜在室温下用二抗(Anti-rabbit IgG(#7074))孵育2 h。使用Super Signal West Pico 化学发光底物(Thermo Fisher)检测蛋白带。GAPDH(中国武汉三鹰生物技术有限公司)或αtubulin(Sigma-Aldrich,St.Louis,Missouri)作为内参。
1.4 统计学分析
计量资料均采用GraphPad Prism 8.0.1 软件进行数据分析和作图。符合正态分布的计量资料以均数±标准差()表示,P<0.05为差异有统计学意义。每对引物(目的基因)在每个模板中设置3个重复,Ct 值取复孔的平均值;每个目的基因的Ct值减去其相对应的内参基因(U6)的Ct 值,可得到ΔCt值。PTC 组的ΔCt值减去邻近正常甲状腺组织组的ΔCt 值,得到ΔΔCt,2-ΔΔCt的值作为PTC 组目的基因的相对表达量。2-ΔΔCt算式=2-[Ct(PTC组目的基因-PTC组内参基因)-Ct(邻近正常甲状腺组织组目的基因-邻近正常甲状腺组织组内参基因)]。3'tiR_026_GlnCTG(n)表达量通过SPSS 25.0 计算中位值来区分为高表达组和低表达组。临床资料分析及划痕愈合率的比较采用卡方检验。
2 结果
2.1 芯片筛选在PTC组织中显著上调的tRFs
我们通过nrStarTM Human tRF&tiRNA PCR 芯片检测2 例人PTC 和邻近正常甲状腺组织中tRFs的表达量,差异达2 倍以上排名前10 的tRFs 包括:3'tiR_037_ArgCCG(n)、TRF353、tiRNA-5030-GlnTTG-3、5028/29B、tiRNA-5035-GluCTC、TRF533/534、3002B、TRF205、3'tiR_026_GlnCTG(n)和3009B(图1)。分别比较该2 例患者PTC 与邻近正常甲状腺组织中tRFs 的表达量差异,发现在这2 例患者PTC 和邻近正常甲状腺组织中3'tiR_026_GlnCTG(n)的表达量均升高2倍以上,分别为3.74和2.29倍(表1)。

图1 差异倍数前10的tRF&tiRNAFig.1 Top ten tRF&tiRNA expression up-fold changes

表1 分别比较2例患者PTC与邻近正常甲状腺组织中tRFs的表达量差异Table 1 The expression levels of tRFs in PTC and adjacent normal thyroid tissues of 2 patients were compared respectively
2.2 通过定量聚合酶链反应验证转运RNA 衍生片段的表达量
芯片的结果提示3'tiR_026_GlnCTG(n)、3002B、5028/29B 和TRF323/324/326的表达量在2例患者中的变化倍数之和位于前4。故在芯片结果基础上,我们在10 例患者的PTC 和邻近正常甲状腺组织中分别验证了3'tiR_026_GlnCTG(n)、3002B、5028/29B 和TRF323/324/326的表达量。Ct值取qPCR 3 复孔的平均值,并据此计算基因表达量(图2 A-D)。表达量经正态性检验,符合正态分布且方差齐性。其中有6 例患者在PTC 中的3'tiR_026_GlnCTG(n)表达量高于邻近正常甲状腺组织(图2A),且升高倍数最为明显。接着,扩大样本量,在46 例患者的PTC 和邻近正常甲状腺组织中通 过qPCR 验 证3'tiR_026_GlnCTG(n)的表达量(图3)。

图2 RNA衍生片段在10例患者的PTC和邻近甲状腺组织中的表达差异Fig.2 Different expression of RNA derived fragment between PTC and adjacent tissue in 10 patients

图3 3'tiR_026_GlnCTG(n)在46例患者的PTC和邻近甲状腺组织中的表达差异Fig.3 Different expression of 3'tiR_026_GlnCTG(n)between PTC and adjacent tissue in 46 patients
2.3 转运RNA 衍生片段的表达水平与甲状腺乳头状癌患者临床特征的相关性
根据3'tiR_026_GlnCTG(n)表达水平的中位数将患者分为高表达组与低表达组,进一步分析3'tiR_026_GlnCTG(n)表达水平与46 例患者临床特征的关系。3'tiR_026_GlnCTG(n)表达水平与年龄、性别、TNM 分期、T 分期、甲状腺外侵犯及多灶性等临床特征的关系差异没有统计学意义,P值>0.05。考虑目前入组患者数量有限,后续研究仍需加大样本量进行临床特征分析(表2)。

表2 3'tiR_026_GlnCTG(n)的表达水平与临床特征的关系Table 2 Relationship between expression level of 3'tiR_026_GlnCTG(n)and clinical features
2.4 过表达转运RNA 衍生片段促进甲状腺乳头状癌细胞迁移及侵袭能力
构建过表达3'tiR_026_GlnCTG(n)的KTC1 细胞与BCPAP 细胞,并分别转染空白对照(negative control,NC),利用qPCR 实验验证转染效率。如图4A,4B 所示,KTC1-3'tiR_026_GlnCTG(n)和BCPAP-3'tiR_026_GlnCTG(n)细胞中3'tiR_026_GlnCTG(n)的表达水平明显高于各自对照组细胞(KTC1-NC 与BCPAP-NC),表明过表达3'tiR_026_GlnCTG(n)细胞株构建成功。图4A与图4B组间比较差异没有统计学意义(t=-0.049,P=0.963)。
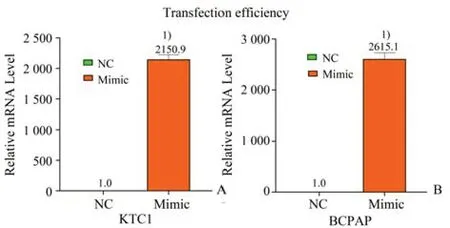
图4 KTC1和BCPAP的转染效率Fig.4 Transfection efficiency of KTC1 and BCPAP
通过Transwell 实验与划痕实验评估过表达3'tiR_026_GlnCTG(n)对PTC 细胞迁移及侵袭能力的影响。在Transwell 迁移实验中,过表达3'tiR_026_GlnCTG(n)的KTC1 细胞及BCPAP 细胞较其对照组细胞迁移能力明显升高(图5)。KTC1细胞:t=-47.038,P=0.000;BCPAP 细 胞:t=-71.250,P=0.000。用MEK/ERK 通路特异性抑制剂PD98059处理细胞后,观察到KTC1 细胞及BCPAP 细胞较其对照组细胞迁移能力明显降低(图6)。KTC1 细 胞:t=35.152,P=0.000;BCPAP 细 胞:t=13.228,P=0.000。

图5 过表达3'tiR_026_GlnCTG(n)的KTC1细胞及BCPAP细胞迁移能力升高Fig.5 Overexpression of 3'tiR_026_GlnCTG(n)promotes human PTC cell migration

图6 用MEK/ERK通路抑制剂处理后KTC1细胞及BCPAP细胞迁移能力降低Fig.6 The MEK/ERK pathway inhibitor decreases human PTC cell migration
我们进一步使用基质胶包被的Transwell 小室进行侵袭实验检测,得到相似的结果。图7 表明,过表达3'tiR_026_GlnCTG(n)的PTC 细胞穿过基质胶的细胞数较对照组显著增加,即其侵袭能力增强。KTC1 细胞:t=-15.517,P=0.000;BCPAP 细胞:t=-52.664,P=0.000。用MEK/ERK 通路特异性抑制剂PD98059 处理细胞后,观察到KTC1 细胞及BCPAP 细胞较其对照组细胞侵袭能力明显降低(图8)。KTC1 细胞:t=26.949,P=0.000;BCPAP 细胞:t=19.087,P=0.000。
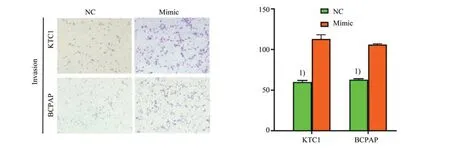
图7 过表达3'tiR_026_GlnCTG(n)的KTC1细胞及BCPAP细胞侵袭能力升高Fig.7 Overexpression of 3'tiR_026_GlnCTG(n)promotes human PTC cell invasion

图8 用MEK/ERK通路抑制剂处理后KTC1细胞及BCPAP细胞侵袭能力降低Fig.8 The MEK/ERK pathway inhibitor decreases human PTC cell invasion
划痕实验(图9,10)同样证实过表达3'tiR_026_GlnCTG(n)的PTC 细胞,其划痕愈合能力较对照组细胞明显增强,提示过表达3'tiR_026_GlnCTG(n)可以增加PTC 细胞迁移。KTC1 细胞:χ2=4.523,P=0.033;BCPAP细胞:χ2=4.227,P=0.040。KTC1 细胞与BCPAP 细胞组间比较差异没有统计学意义,χ2=0.179,P=0.864。用MEK/ERK 通路特异性抑制剂PD98059 处理细胞后可以降低PTC 细胞迁移能力。KTC1 细胞:χ2=4.207,P=0.040;BCPAP细胞:χ2=5.227,P=0.022。组间比较差异没有统计学意义,χ2=1.212,P=0.271。

图9 划痕实验评估3'tiR_026_GlnCTG(n)对KTC1细胞及BCPAP细胞迁移能力的影响Fig.9 The wound-healing assay was used to assess the biological function of 3'tiR_026_GlnCTG(n)on cell migration of KTC and BCPAP cells
过表达3'tiR_026_GlnCTG(n)能促进PTC 细胞的增殖能力;阻断MEK/ERK 通路能抑制PTC 细胞的增殖能力(图11)。KTC1 细胞:Mimic 与NC 相比,48 ht=5.372,P=0.005;72 ht=3.181,P=0.031;MEK/ERK 通路抑制剂与NC 相比:48 ht=-2.837,P=0.044;72 ht=-3.283,P=0.028;BCPAP 细胞:Mimic与NC 相比,48 ht=5.372,P=0.005;72 ht=3.181,P=0.031;MEK/ERK 通路抑制剂与NC 相比:48 ht=-4.469,P=0.010;72 ht=-2.825,P=0.045。

图11 过表达3'tiR_026_GlnCTG(n)和MEK/ERK通路抑制剂对PTC细胞增殖能力的影响Fig.11 Effects of overexpression of 3'tiR_026_GlnCTG(n)and MEK/ERK pathway inhibitors on proliferation of PTC cells
2.5 蛋白免疫印迹检测MEK/ERK/p90RSK 信号通路的表达水平
为了进一步验证3'tiR_026_GlnCTG(n)在PTC 细胞中具体通过什么信号通路调控了PTC 的发生发展,我们在成功转染了Mimic 和NC 的KTC-1和BCPAP细胞系中进行了WB检测。在PTC发生发展中最重要的是AKT 和ERK 通路的激活,于是检测了磷酸化AKT和ERK,而发现MEK、ERK 及其下游p90RSK 激酶的磷酸化被显著激活。3'tiR_026_GlnCTG(n)过表达时,MEK、ERK 和p90RSK的磷酸化水平均上调(图12)。使用Image J 对蛋白条带进行灰度分析,并使用GraphPad prism 8.0.1 绘制柱状图进行展示(图13)。经正态性检验,目的蛋白/α-tubulin 资料呈正态性分布,且方差齐性,组间比较采用t检验。KTC1 细胞系:比较MEK1/2 蛋白差异,t=-4.481,P=0.011;比较ERK1/2 蛋白差异,t=-2.879,P=0.045;比较p90RSK 蛋白差异,t=-4.214,P=0.014;BCPAP 细胞系:比较MEK1/2 蛋白差异,t=-3.508,P=0.025;比较ERK1/2蛋白差异,t=-3.564,P=0.006;比 较p90RSK 蛋白差异,t=-4.202,P=0.014。

图12 WB检测KTC1和BCPAP细胞中MEK/ERK/p90RSK信号通路的蛋白表达水平Fig.12 Western blotting analysis was performed to detect the protein expression levels of the MEK/ERK/p90RSK signaling pathway in the KTC1 and BCPAP cells

图13 WB检测灰度分析Fig.13 Western blot gray value analysis
3 讨论
tRFs 在癌症的发病和进展中起着至关重要的作用[6]。tsRNA 是来自转运RNA(transfer RNA,tRNA)的裂解片段,是随着高通量测序技术发展而被新发现的小非编码RNA(sncRNA)。tsRNA 来源于tRNA 前体或成熟tRNA,根据裂解位置的不同可分为两大类:tRNA 半分子和tRNA 衍生片段(tRNA-derived fragments,tRFs)。tRNA 半分子通常在胁迫条件下产生,也称tiRNA(tRNA-derived stress-induced fragment)[7]。tRFs 根据位置来源不同进一步分为:①tRF-5,对应成熟tRNA 的5’端,切割发生在D-loop;②tRF-3,对应成熟tRNA 的3’端,包含CCA 部分,切割发生在T-loop;③tRF-1,源自前体tRNA 的3’尾部序列,3’末端含有多聚U序列;④i-tRF,主要来自成熟tRNA 的中间区域[8]。tiRNA 主要包括5’tiRNA 和3’tiRNA 两个亚类,切割发生在成熟tRNA 反密码子环处。不同亚类的tRFs 均被证实参与调控癌症的基因表达。大量研究表明,tRFs来源于精确切割的tRNA,具有特定的生物学功能。在肿瘤患者的尿液、唾液和血清中检测到tsRNA,表明它们可以作为肿瘤诊断的分子标志物[9];乳腺癌患者血液样本中tsRNA 水平与病理特征密切相关[10];研究发现一种激素依赖性的tsRNA 在乳腺癌和前列腺癌细胞系中大量存在,能增强癌细胞的增殖[11]。tRF-1如ts-53和ts-101,可作为miRNAs 和piRNAs 与Ago 和PiwiL2 蛋白结合,调节转录前基因表达[12]。tRF-3s 可与Ago3、Ago4互作,增强翻译沉默功能[13],结合Twi12 蛋白增强核糖体蛋白表达[14]。tRF-5s 通过抑制翻译延长来抑制蛋白的翻译,这说明tRFs 可能通过靶向翻译机制来影响蛋白的翻译[15]。此外,tRFs 调节肺癌、结直肠癌、前列腺癌、乳腺癌、卵巢癌、B 细胞淋巴瘤、慢性淋巴细胞白血病等癌症的发生发展[16-17]。tRFs通过不同的机制发挥生物学作用,如调节基因表达、调节细胞周期、与蛋白质或mRNA 的相互作用、染色质修饰和表观遗传[18]。可见,tRFs 在生物活动中发挥重要作用,例如影响基因表达,调节蛋白质翻译,改变免疫信号通路等[19]。基础和临床研究表明,使用miRNA 模拟物和抑制剂(anti-miRs)的靶向治疗可能成为治疗疾病的新治疗方法[20]。在我们的研究中,我们通过转染tRFs-Mimics 和Negative Control来观察细胞功能的变化。Transwell实验与划痕实验均显示过表达3'tiR_026_GlnCTG(n)能够促进PTC 细胞的迁移及侵袭能力。3'tiR_026_GlnCTG(n)mimics 可以促进PTC 细胞系的生物学行为,MEK/ERK 通路抑制剂能够抑制PTC 细胞的增殖、迁移和侵袭功能,提示3'tiR_026_GlnCTG(n)可能通过MEK/ERK 通路参与PTC 的发生发展。然而,在我们的临床病例中,并未观察到PTC 中3'tiR_026_GlnCTG(n)表达水平与患者的TNM 分期、T 分期、甲状腺外侵犯及多灶性等临床特征相关,考虑是因为目前观察的病例数量不足,在将来的研究中,需要纳入更多的患者分析它们的关系。
tRFs 在癌症的多种信号通路已到了验证。研究发现tiRNATyr-GTA通过过氧化物酶体增殖物激活受体信号通路负反馈调控上皮细胞凋亡是其在结直肠癌中的主要作用机制[21]。tRF/miR-1280抑制了维持肿瘤干细胞样细胞功能的Notch 信号通路,抑制了结直肠癌的生长和转移[22]。这些发现可能有助于开发结直肠癌的潜在治疗靶点。在肺癌中,tRFLeu-CAG通过调节Wnt/β-catenin 和PI3K/Akt 信号通路诱导上皮细胞向间充质细胞的转变而促进肿瘤转移[23]。MEK/ERK 通路是最经典的MAPK 信号通路之一,据报道,在大约1/3 的人类癌症中,存在MEK/ERK 信号通路失调。MAPK 通路是调控细胞基本生命活动过程的关键激酶通路,包括生长、增殖、分化、迁移和凋亡[24]。为了探究3'tiR_026_GlnCTG(n)促进PTC 癌变和进展的机制,我们在KTC-1 和BCPAP 细胞系中通过裂解细胞,提取蛋白,并进行了蛋白质印迹检测。我们重点关注最经典的MEK/ERK 通路,并证实了3'tiR_026_GlnCTG(n)促进了PTC 中MEK、ERK 及其下游靶蛋白p90RSK的激活。本研究结果表明,3'tiR_026_GlnCTG(n)的Mimics 通过激活PTC 细胞系中的MAPK 信号通路,从而促进PTC 细胞的生物学行为。因此,3'tiR_026_GlnCTG(n)可能成为PTC 特别是侵袭性PTC的治疗提供一种新的思路。

图10 过表达3'tiR_026_GlnCTG(n)增强KTC1细胞及BCPAP细胞划痕愈合能力及使用MEK/ERK通路抑制剂处理后降低划痕愈合能力Fig.10 Overexpression of 3'tiR_026_GlnCTG(n)promotes and the MEK/ERK pathway inhibitor impairs the closure of the wound in KTC1 and BCPAP cells
综上所述,本研究结果证实,3'tiR_026_GlnCTG(n)在PTC 组织中高表达,过表达3'tiR_026_GlnCTG(n)促进了PTC 细胞系的侵袭、迁移能力。这些影响可能通过通过激活MEK/ERK/p90RSK 信号通路得以实现。这些发现可能为PTC 治疗中潜在的靶向治疗提供了新的见解。

