“抗”“感”苜蓿品种对豌豆蚜适应性及体内酶活的影响
魏江文,刘 磊,王森山, 陈丽霞,蒋明君,王庚浩,徐亨昊
(甘肃农业大学植物保护学院/甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
紫花苜蓿(MedicagosativaL.)属于豆科苜蓿属,是一种多年生草本植物。由于其种植历史悠久、营养价值极高、易消化,被称为“牧草之王”,在欧亚大陆和世界各国广泛种植[1]。紫花苜蓿近年来被大量种植,已被选育出多个品种,‘甘农5号’为紫花苜蓿抗豌豆蚜高抗品种,作为我国第一个抗虫(高抗蚜虫、兼抗蓟马)的苜蓿品种,其在多地表现出适应性强、生产性能高、产草量高、品质好的特点,具有潜在的推广价值,适宜于在甘肃灌区大面积推广应用[2-3]。‘猎人河’为紫花苜蓿感虫品种,它的突出优点是再生快、叶量大、产草量高,比一般紫花苜蓿增产15%~60%[4-6]。但是,随着畜牧业的发展和苜蓿种植面积的扩大,苜蓿病虫害的问题也越来越多。
危害苜蓿的蚜虫主要是苜蓿蚜(Aphiscraccivora)、豌豆蚜(豆无网长管蚜,Acyrthosiphonpisum)和苜蓿斑蚜(Therioaphismaculata)[2,7]。豌豆蚜有苜蓿型豌豆蚜和豌豆型豌豆蚜,近年来豌豆蚜已经成为危害苜蓿的主要害虫。甘肃种植苜蓿的面积占我国苜蓿种植总面积的70%,豌豆蚜的为害面积近100%,而且豌豆蚜作为生态学研究的模式昆虫,具有复杂的生活周期、多样的生殖方式、发育历期短、世代重叠严重、极易适应环境等特点[7],因此,研究“抗”“感”两苜蓿品种对豌豆蚜的影响,结合生理及生化两方面去研究豌豆蚜,培育优良的抗蚜苜蓿品种是防治豌豆蚜理想的手段。
昆虫在维持正常的生理生化代谢过程中,保护酶和解毒酶发挥着重要作用。超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和过氧化氢酶(Catalase,CAT)共同构成昆虫体内保护酶系,这3者能互相协调一致,避免超氧阴离子或其他活性氧自由基对细胞膜的防御系统造成伤害,能维持昆虫体内自由基平衡。已有研究报道昆虫在受到外界刺激或不利的条件下体内保护酶的活性如果受到抑制会对虫体造成毒害作用,进而抑制昆虫的生长发育,但如果虫体内保护酶活性升高则会促进昆虫的生长发育[8-10]。细胞色素P450s(Cytochrome P450s,P450s)、谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)和羧酸酯酶(Carboxylesterase,CarE)等解毒酶在分解代谢农药、植物次生物质等外源毒素和维持昆虫正常生理生化活动等方面起到至关作用[9-13]。丁杰[14]将灰飞虱接到五种寄主植物后测定了CarE,GST和多功能氧化酶(Multifunction oxidases,MFO)三种解毒酶的变化趋势,结果表明在72 h之内,体内的羧酸酯酶和多功能氧化酶活性变化整体呈现先上升后下降再上升的趋势,GST的活性变化呈现先上升后下降的趋势。郅军锐等[15]发现二斑叶螨取食西花蓟马为害的菜豆(PhaseolusvulgarisL.)能诱导二斑叶螨(Tetranychusurticae)和西花蓟马(Frankliniellaoccidentalis)成虫体内的保护酶和解毒酶活性,5 h时变化趋势相同,但在5 h之后和不同虫态下酶活性的变化趋势不同,说明这2种昆虫对同一寄主植物生理适应性不完全相同。杨玉婷[16]选取4种寄主植物[韭菜(AlliumtuberosumRottlerexSprengel)、生菜(Lactucasativavar.romana)、大葱(Alliumfistulosumvar.gigante-umMakino)和马铃薯(olanumtuberosumLinn.)]饲养韭蛆,并分别测定不同寄主饲养后韭蛆的三大保护酶系,研究发现取食大葱的幼虫POD活性最高,取食韭菜的幼虫CAT活性最高,显著高于取食其他寄主,表明在韭菜迟眼蕈蚊的生长发育与寄主植物有一定的关联,寄主植物不同,韭蛆体内保护酶系的活性也不尽相同。
基于以上研究分析,“抗”“感”两个苜蓿品种可能会影响豌豆蚜生长发育及豌豆蚜的生理生化指标。为了明确不同苜蓿品种对豌豆蚜存活率及对豌豆蚜体内酶活的影响,本研究以蚕豆(ViciafabaL.)叶片上扩繁的绿色型豌豆蚜和“抗”“感”2个苜蓿品种为供试材料,通过测定豌豆蚜在不同时间3种保护酶(SOD,POD和CAT)和3种解毒酶(P450s,GST和CarE)活性的变化,探讨“抗”“感”两个苜蓿品种对豌豆蚜的适应性,以期为科学防治豌豆蚜,培育优良的抗蚜苜蓿品种提供理论依据。
1 材料与方法
1.1 供试材料
供试植物材料:紫花苜蓿播种于育苗杯(土壤∶草炭∶蛭石=3∶2∶1)中育苗(育苗杯直径10 cm,高14 cm,育苗50杯,每杯保苗3株);在人工气候箱中进行(温度:25℃,相对湿度:70%,光照:16 h/8 h)育苗,挑选生长发育一致的40 d龄的苜蓿植株进行试验。
供试虫源:绿色豌豆型豌豆蚜(虫源为单头豌豆蚜在室内盆栽蚕豆上扩繁),饲养条件为光照培养箱(温度:25℃,湿度:70%,光照:16 h/8 h)。挑选成虫在离体叶片饲养(同等饲养条件),待产蚜后剔除成蚜,选取3 d龄若蚜用于试验。
1.2 研究方法
1.2.12个苜蓿品种对豌豆蚜存活的影响 试验设置CK,LF和GF共3组。CK代表接虫到蚕豆上的豌豆蚜;LF代表接虫到‘猎人河’感虫苜蓿品种上的豌豆蚜;GF代表接虫到‘甘农5号’抗虫苜蓿品种上的豌豆蚜。每个处理3次重复,每个重复接100头蚜虫。将离体叶片上饲养的3 d龄的豌豆蚜分别接种到蚕豆、“抗”“感”2个苜蓿品种上。24 h后统计并计算其有翅蚜率,分别于0 h,12 h,24 h,36 h,48 h,60 h和72 h(0 h为CK)计算其存活率。
1.2.22个苜蓿品种对豌豆蚜保护酶活性的分析 接种处理及样品收集:试验设置同1.2.1,每处理设3个重复,每个重复接160头豌豆蚜,处理0 h,12 h,24 h,48 h和60 h(0 h为CK)后取样,共收集45个样品。每个样品取样10头。挑取的豌豆蚜经液氮处理10 min后保存于—80℃冰箱以备酶活性测定。
2个苜蓿品种对豌豆蚜保护酶活性分析:SOD,POD和CAT活性测定参考袁伟宁等的测定方法[17]。
1.2.32个苜蓿品种对豌豆蚜解毒酶活性的分析 CarE活性测定:羧酸酯酶的活性测定参照王常清等的测定方法[18]。
GST活性测定:GST活性测定参照王常清[18]等文献的方法并略有改进,接种处理及样品收集同1.2.2。
酶原液制备方法如下:将—80℃冰箱中取出的样品置于1.5 mL离心管中加入600 μL 66 mmol·L-1(pH=7.0)的磷酸缓冲液中,在冰上匀浆,在4℃,8 000 g下离心10 min,吸取上清液用于后续测定。
酶标板提前预热30 min,300 μL的反应体系:将240 μL 66 mmol·L-1(pH=7.0)的磷酸缓冲液,30 μL 50 mmol·L-1GSH,10 μL 30 mmol·L-1的2,4-二硝基氯苯和20 μL酶液按先后顺序加入96孔板,在37℃下保温反应20 min。用30 mmol·L-12,4-二硝基氯苯作底物,经GSTs作用,与还原型谷胱甘肽反应生成硫醇尿酸衍生物,在340 nm处测OD值,记录10 s和310 s吸光度为A1和A2。将不添加酶液的缓冲液代替酶原液作为阴性对照。
计算公式:GST比活力(mol·min-1·g-1)=[(A2—A1)/(ε×d×V反总×106)]/(W×V样/V样总)/T=0.536×(A2—A1)/W
V反总:反应体系总体;W:样本质量;ε:产物摩尔消光系数,9.6×103L·mol-1·cm-1;d:96孔板光径,0.5 cm;V样:样本体系;V样总:样本总体系。
细胞色素P450 s酶活性测定:参照王康[19]的方法,略有改进,接种处理及样品收集同1.2.2。
酶原液制备方法如下:将—80℃冰箱中取出的样品置于1.5 mL离心管中加入200 μL预冷的0.1 mol·L-1(pH 7.5)的磷酸缓冲液(含1.0×10-3mol·L-1EDTA)冰上研磨充分后再加入800 μL缓冲液,在4℃,15 000 g条件下离心10 min,吸取上清液为酶液,用于后续测定实验。
酶标仪预热30 min,把波长调到405 nm,用磷酸缓冲液把对硝基苯甲醚稀释到2 mmol·L-1(现配现用);在96孔酶标板中分别加入2 mmol·L-1的对硝基苯甲醚180 μL和10 μL酶液以及10 μL 9.6 mmol·L-1的还原型辅酶Ⅱ后启动反应。30℃水浴中反应2 h,在酶标仪中测定405 nm下的吸光值。用不添加还原型辅酶Ⅱ的缓冲液代替酶源液来做阴性对照。测定结束之后,根据对硝基苯酚标准曲线、蛋白含量、所测OD值计算细胞色素P450 s酶比活力。
1.3 数据处理
采用Microsoft Excel 2016统计处理试验数据,整理后的数据使用SPSS 23.0软件进行数据统计分析,用单因素方差分析来显著性检验,用Duncan’s新复极差法进行多重比较,全部数据均为平均值±标准误,以P<0.05作为差异显著性标准,作图软件使用Origin 2018。
2 结果与分析
2.1 2个苜蓿品种对豌豆蚜存活的影响
豌豆蚜取食不同苜蓿品种后存活率结果见表1。“抗”“感”苜蓿品种对豌豆蚜的存活有显著影响(P<0.05)。LF,GF的存活率随着时间均显著降低,GF的存活率降低更明显。接虫6 h,CK和LF,GF之间存活率差异不显著;但接虫12 h之后,CK,LF,GF三者之间存活率差异显著(P<0.05)。接虫24 h时,GF的存活率显著低于CK和LF处理(P<0.05),为46.7%;在72 h,GF的存活率最低,为6.7%。24 h时,GF的有翅蚜率最高,为14.3%。CK,LF,GF三者之间的有翅蚜率差异显著(P<0.05)。

表1 2个苜蓿品种对豌豆蚜存活的影响Table 1 Effects of two alfalfa varieties on the growth and development of pea aphid
2.2 2个苜蓿品种对豌豆蚜保护酶活性的影响
豌豆蚜取食“抗”“感”2个苜蓿品种后其保护酶活性测定结果见下图。
由图1可知,除24 h的POD活性被抑制之外,其他处理时间豌豆蚜POD活性均增加,12 h,48 h和60 h的LF与GF处理的POD活性均高于CK。随着取食苜蓿后时间的延长,豌豆蚜LF和GF的POD活性呈现先上升后降低的趋势。24 h时,CK的POD活性最高。在48 h时,CK,LF,GF三者间的POD活性差异显著(P<0.05)。

图1 2个苜蓿品种对豌豆蚜POD活性的影响Fig.1 Effects of two alfalfa varieties on POD activity of pea aphid注:不同字母表示差异显著(P<0.05),下同Note:Different letters indicate significant differences at the 0.05 level,the same as below
由图2可知,随着取食苜蓿后时间的延长,CK,LF和GF的SOD活性呈现先上升后降低的趋势。豌豆蚜取食不同品种苜蓿后,在12 h时,LF的SOD活性显著高于CK与GF处理(P<0.05);在24 h时,CK,LF,GF的SOD活性差异显著(P<0.05),GF的SOD活性最高;取食48 h后,LF的SOD活性被抑制;到60 h时,LF和GF的SOD活性均被抑制。
由图3可知,LF的CAT活性在不同时间段呈现先下降后上升的趋势,GF的CAT活性呈现先下降后上升再下降的趋势。LF的CAT活性在12 h明显被抑制。24 h和60 h时,CK,LF,GF三者CAT活性差异显著(P<0.05)。在取食后48 h,GF的CAT活性显著高于CK和LF(P<0.05)。
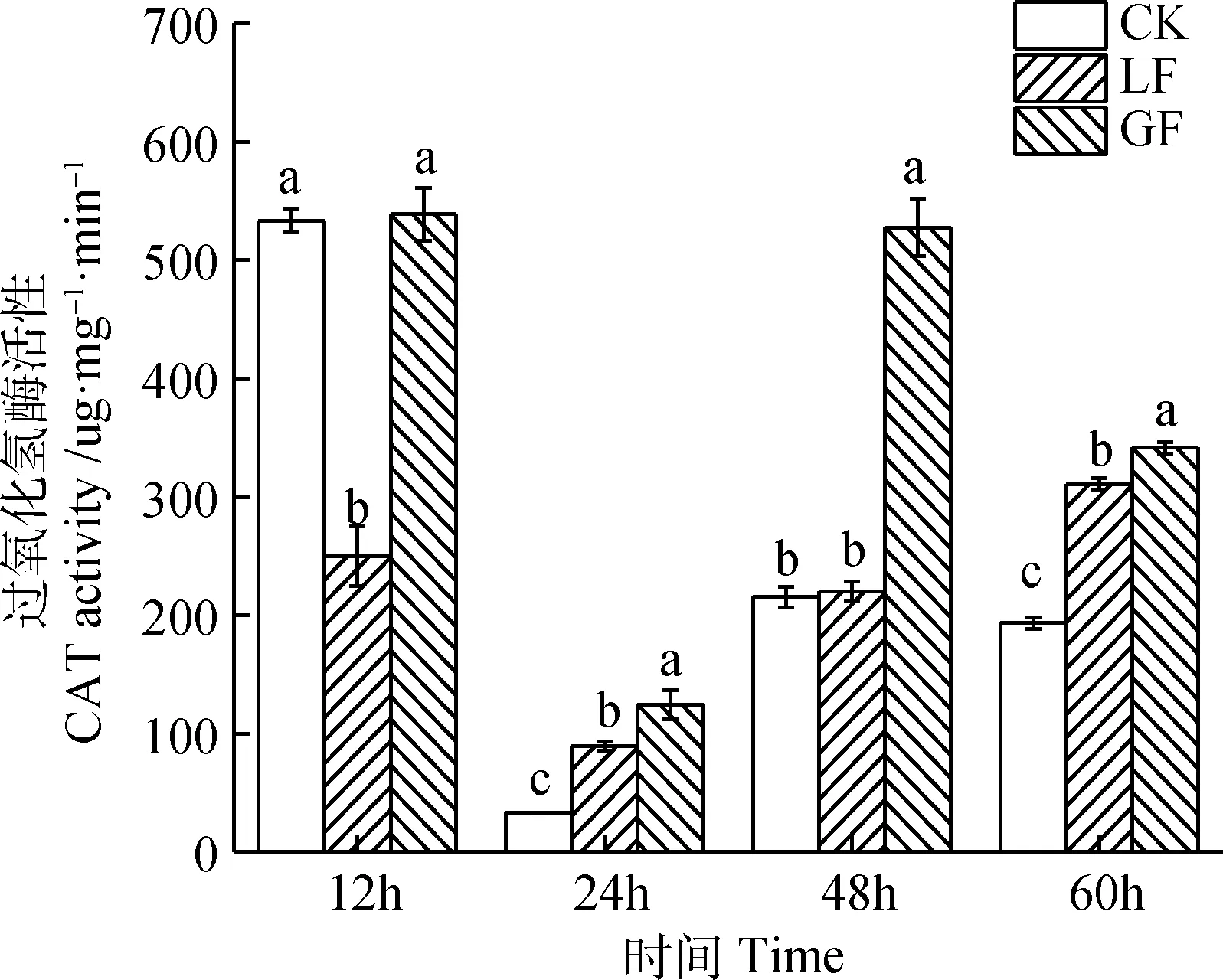
图3 2个苜蓿品种对豌豆蚜CAT活性的影响Fig.3 Effects of two alfalfa varieties on CAT activity of pea aphid
2.3 2个苜蓿品种对豌豆蚜解毒酶活性的影响
豌豆蚜取食“抗”“感”2个苜蓿品种后其解毒酶活性测定结果见下图。
由图4可知,CK和LF的CarE活性呈现先上升后降低的趋势。豌豆蚜取食不同苜蓿品种后,除48 h GF的CarE活性被抑制,其余时间的CarE活性均增加。在12 h和60 h时,CK,LF和GF的CarE活性差异显著(P<0.05);取食24 h,LF和GF的CarE活性显著高于CK(P<0.05);在48 h,LF的CarE活性与CK和GF处理差异显著(P<0.05)。
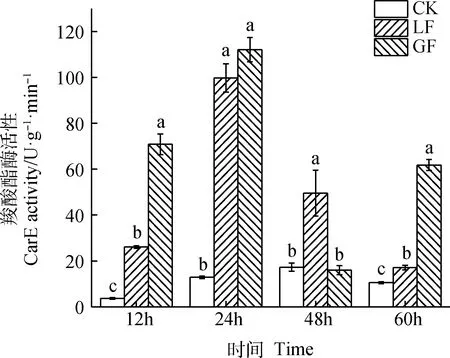
图4 2个苜蓿品种对豌豆蚜CarE活性的影响Fig.4 Effects of two alfalfa varieties on CarE activity of pea aphid
由图5可知,LF的GSTs活性在48 h内基本保持不变,在60 h有上升的趋势,GF的GSTs活性呈现先上升后下降的趋势。在12 h,24 h和48 h时,GF的GSTs活性显著高于CK(P<0.05)。60 h时,CK,LF和GF三者间的GSTs活性差异显著(P<0.05)。
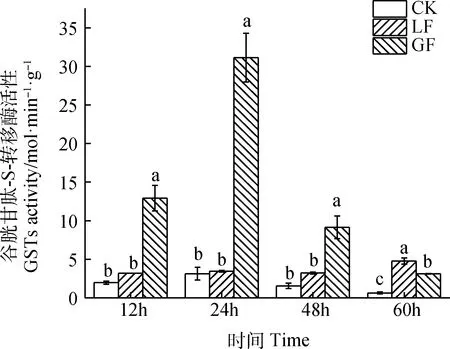
图5 2个苜蓿品种对豌豆蚜GSTs活性的影响Fig.5 Effects of two alfalfa varieties on GSTs activity of pea aphid
由图6可知,GF的P450s活性呈现先上升后下降的趋势。CK,LF的P450s活性在不同时间段趋势不明显。GF的P450s活性在12 h,24 h和48 h时显著高于CK(P<0.05)。在60 h,CK,LF和GF三者间P450活性差异不显著。
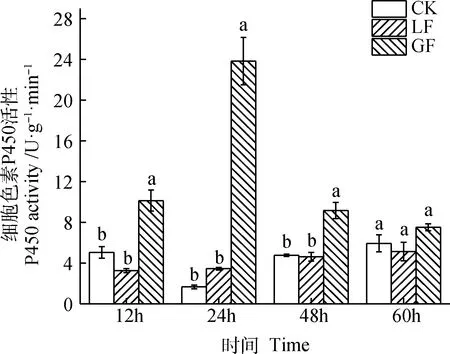
图6 2个苜蓿品种对豌豆蚜P450s活性的影响Fig.6 Effects of two alfalfa varieties on P450s activity of pea aphid
3 讨论
在进行不同苜蓿品种对豌豆蚜存活影响试验时发现,豌豆型豌豆蚜不能尽快适应紫花苜蓿,可能是由于豌豆型豌豆蚜体内缺乏相应的效应因子或体内消化酶和解毒酶调控力度不够,也可能与2种苜蓿受到豌豆蚜刺激产生的次生物质相关[20-22]。原二亮[20]认为,染料木黄酮能够刺激豌豆蚜取食,使其大量摄入植物次生物质,从而降低其存活率。Sanchez-Arcos等[21-22]使用了基于质谱的非目标代谢组学方法来鉴定在不同寄主植物中不同的化合物,研究结果表明寄主转换可能会产生黄酮类、皂苷类、非蛋白源性氨基酸和肽类等化合物,从而影响豌豆蚜存活率。有翅蚜的形成是由环境条件和豌豆蚜自身基因型共同决定的,温度、光周期以及种群密度和天敌是诱导翅型分化的主要原因[23-24],表1结果表明,有翅蚜的多少可能还与不同的寄主有关。本文以紫花苜蓿2个苜蓿品种为寄主,发现紫花苜蓿抗虫品种‘甘农5号’能使豌豆蚜存活率从100%降到6.7%(在72 h),而感虫品种‘猎人河’使豌豆蚜存活率从100%降到66.0%(在72 h),表明抗虫苜蓿品种体内含有某种次生物质,能使豌豆蚜存活率显著下降[20-22]。后期基于代谢组学的方法鉴定豌豆蚜取食过的2个苜蓿品种体内的次生物质,可能会找到豌豆蚜存活率低的原因。
当昆虫在搜寻到新的寄主进食的时候,植物由于受到刺激产生的次生物质会连同植物组织一同进入虫体,次生物质会对昆虫的机体产生胁迫作用,破坏昆虫细胞内的自由基产生与清除系统,导致昆虫体内有毒物质积累,从而对昆虫产生毒害作用[25]。昆虫可以通过改变体内酶活性来适应寄主的变化,不同酶对于新寄主环境的反应速度也不同[26-28]。从本试验的结果可以看出,取食2个苜蓿品种的豌豆蚜,体内保护酶和解毒酶的活性也被不同程度的诱导或抑制,取食抗虫品种的豌豆蚜酶活性总体上高于取食感虫品种的豌豆蚜酶活性。尤其在豌豆蚜取食24 h时最明显,取食2个苜蓿品种的豌豆蚜体内POD活性均被抑制,SOD,CarE,GSTs和P450s这4个酶都被激活,说明此时豌豆蚜不能及时将H2O2分解成H2O和O2,对豌豆蚜造成毒害作用,而此时起调控作用的是SOD,CarE,GSTs和P450s[16]。结合表1取食抗虫苜蓿品种的豌豆蚜的存活率在24 h急剧下降,24 h之后存活率下降不明显,24 h之后,豌豆蚜体内的酶活性也渐趋稳定,说明在24 h时豌豆蚜体内的酶被最大程度的激活,调控不同苜蓿品种的次生物质或有毒物质对豌豆蚜所带来的影响[20,28-30]。24 h之后其他酶活性下降,POD酶活性显著升高,说明24 h后豌豆蚜体内起主要调控作用的酶是POD,但结合豌豆蚜的存活率,说明这6种酶并不能代谢抗虫苜蓿品中对豌豆蚜造成的毒害作用;而取食感虫品种苜蓿的豌豆蚜存活率下降不明显,POD,SOD和CarE活性呈现先上升后下降的趋势,CAT活性呈现先下降后上升的趋势,结合豌豆蚜的存活率说明这6种酶可能会调控感虫苜蓿品系使豌豆蚜引起的不良反应。在不同的时间段内,取食两苜蓿品种的豌豆蚜CarE活性相比CK显著升高,表明CarE在适应两苜蓿品种时起到重要的调控作用。由此可以看出,豌豆蚜受到不同种类次生物质或不同浓度同种次生物质胁迫后,体内保护酶和解毒酶活性的变化是一个复杂的过程,去适应外界环境条件的变化。也有相关研究[26-27,31]表明,消化酶(脂肪酶、胃蛋白酶和α-淀粉酶)、乙酰胆碱酯酶等酶在适应新寄主中可能发挥重要作用,后期可以进行试验。从本试验可以看出,2个品种的苜蓿对豌豆蚜存活和酶活的影响相对较大,而且抗虫品种的影响大于感虫品种的影响,进一步验证紫花苜蓿‘甘农5号’抗蚜性较好。后期可将取食不同品种苜蓿的豌豆蚜进行转录组测序,进行验证在取食前后豌豆蚜体内不同酶活性的变化,然后定量分析几种酶基因表达量的变化,筛选出关键基因,用RNAi技术验证关键基因的基因功能,进一步完善豌豆蚜对不同苜蓿品种的适应机制。
4 结论
本试验将豌豆蚜接种到“抗”“感”2个苜蓿品种上,通过测定豌豆蚜体内生理酶活性和存活率来进一步比较豌豆蚜对2个苜蓿品种适应性,结果表明感蚜紫花苜蓿品种‘猎人河’对豌豆蚜的存活率及酶活性影响相对较小,一段时间之后豌豆蚜可能会在‘猎人河’品种上定殖。抗蚜品种‘甘农5号’对豌豆蚜的存活率及酶活性影响相对较大,不适于豌豆蚜定殖。豌豆蚜在受到有毒物质或次生物质胁迫时,会通过各种酶系共同维持机体内的代谢平衡,以适应外界环境条件的变化。

