藏北高寒草原典型植物根际土壤细菌群落结构多样性及根系特征分析
付莉娇,李雪琴,范继辉,鲁旭阳,鄢 燕*
(1.中国科学院、水利部成都山地灾害与环境研究所山地表生过程与生态调控重点实验室,四川 成都 610041;2. 中国科学院大学,北京 100049)
土壤微生物是土壤中物质转化的动力[1],作为陆地生态系统中的重要组成成分,参与土壤有机质的分解、元素循环、土壤矿物质分解等地球化学循环过程,不仅在土壤的形成、发育和维持生态系统平衡等方面发挥着重要作用,对于改善根际土壤质量也尤为关键。植物依靠根系吸收土壤中的养分和水分,在植物根系周围生活的土壤微生物为植物提供氮素等矿质营养元素以及有机酸等有机元素,从而促进植物的生长发育。同时,植被的生长发育也会对土壤微生物群落结构产生影响[2]。植物和土壤微生物的协同发展是互惠的[3],二者皆长期受益。根际作为直接接受植物根系和分泌物影响的土壤区域,直接制约着植物对营养物质的吸收与利用。另外,根际也是微生物最活跃的区域,根际微生物通过自身代谢活动将土壤中的营养物质转化为植物可吸收利用形态,对植物生长和抗逆性具有重要作用[4-6]。根际土壤微生物群落结构除受自身状况(植物种类、发育阶段、营养状况等)影响以外,还受土壤理化性质(土壤类型、水分、pH、矿质元素和温度等)影响[6-8]。例如,在盐碱胁迫下的土壤pH和含盐量比非盐碱土壤高,土壤含盐量对土壤微生物群落的结构、多样性以及活性存在显著的影响。在过去的研究中,人们对植物不同物候期[9]、不同季节[10]、干旱胁迫或盐碱胁迫下[11]以及不同物种间[12]的根际土壤微生物群落结构多样性展开了大量研究,也发现了物候、季节和盐碱胁迫等会对植物群落结构和根际土壤微生物产生或多或少的影响。
本研究区域的季节性流水带属于坡面薄层水流,受地表状况和降水强度等诸多因素影响,形成了一种特殊的水流形态。草地植被的覆盖可以降低坡面流流速[13],减缓坡面侵蚀进程。张圆圆等[14]通过对石羊河中下游不同河岸类型区植被和土壤的调查发现,随着石羊河中下游部分河段的季节性断流,植被发生了明显退化,当水分条件和生态环境发生改变时,土壤也逐渐退化。流水带的长期断流和短期水蚀造成的生境变化改变了植被群落结构,造成地上部分植被单一,草地植物物种多样性发生变化。那么对于植被地下部分,即对根系形态和根际土壤微生物群落结构又会有怎样的影响?
16S核糖体RNA(16S rRNA)基因测序技术是一种能同时对样品中所有微生物进行检测并获取微生物群落组成以及它们之间的相对丰度的高通量技术[15],因其通量大、时间短、信息量丰富和精确度较高等特点,在微生物群落多样性的研究方面应用愈来愈广泛[16-18]。基于此,本研究采用高通量测序技术对流水带内外不同植物根际土壤微生物的16S rRNA基因V3-V4片段进行扩增测序,研究流水区与对照区不同植物根际土壤细菌群落多样性及其与土壤理化性质之间的关系,并对根系部分进行形态差异比较,以期为藏北高寒草原退化草地的修复提供一种新思路。
1 材料与方法
1.1 研究区概况
本研究在中国科学院申扎高寒草原与湿地生态系统观测试验站(30°57′ N,88°42′ E,海拔4 675 m)的永久样地内展开。样地紧靠山地,地势北高南低,形成一个缓坡地带。气候属高原亚寒带半干旱季风气候区,空气稀薄,且寒冷干燥,年均温0.4℃,年日照时数为2 915.5 h,霜期持续天数为279.1 d,常年干旱少雨且分布不均,年降水量为298.6 mm,年蒸发量约为年降水量的9倍,而绝大部分降雨发生在每年的6—8月,在此期间由于降雨偏多和山雪融化的原因,雨水和雪水沿着地势从高往低形成流水带。因此本研究以该流水带为试验区(图1),非流水带为对照区。
样地内植被类型属高寒草原,土壤类型为高寒草原土,优势种为紫花针茅(Stipapurpurea)、青藏苔草(Carexmoorcroftii)和早熟禾(Poaannua),伴生有昆仑蒿(Artemisiananschanica)、狼毒(Stellerachamaejasme)、二裂委陵菜(Potentillabifurca)、矮火绒草(Leontopodiumnanum) 和小叶棘豆(Oxytropismicrophylla)等。经过样方调查后发现,紫花针茅、青藏苔草和早熟禾的植株平均高度在流水带内分别为12.27 cm,3.5 cm和20.13 cm,对照区内分别为6.18 cm,3.0 cm和8.88 cm;植被群落盖度在流水带为20.67%,对照区26.67%;紫花针茅在对照区更丰富,青藏苔草和早熟禾在流水带更常见。流水带上的植被呈现出个体长势茂盛、整体稀疏的特征,而流水带外的植被虽个体弱小却数量多。流水带内外植被的地上生物量相近,而在流水带外的地下生物量约为流水带内的2倍。流水带0~30 cm土层的土壤含水率为8.25%,对照区为7.89%,实验地地处藏北,蒸发量大,土壤具有明显的粗骨性特征,表层土壤含有91%的沙粒[19],渗水速度快,保水性能差,导致流水带内外0~30 cm土层土壤含水率差距不明显。
1.2 样品采集
在申扎试验站高寒草原样地流水带内和流水带外围区域平缓地带分别选取3种典型植物群落,青藏苔草、早熟禾和紫花针茅群落。样方规格为3 m×3 m,挑选长势相近且健康的植株个体10株,用铁锹围绕植株垂直挖取全株样,采用“抖根法”[20]抖去多余的大块土壤后,用刷子扫取附在根系表面的土壤(厚度约为1 mm),混合均匀作为根际土壤样品。将土壤样品放置在具有隔热效果的自封袋内带回实验室,冰箱冷藏保存用于微生物群落多样性分析,同时,全株样样品也置于密封袋内带回实验室测定根系物理性质。样品编号为SJC、SJP、SJS、SCKC、SCKP、SCKS(中间字母J和CK分别代表流水区和对照区;末尾字母C代表青藏苔草,P代表早熟禾,S代表紫花针茅)。另外,在同一样方内利用五点取样法采取0~30 cm土壤混匀作为一个土壤样品,带回实验室测定土壤理化性质,样品编号同上。根际土壤每个样品设置3个重复,根系形态特征每个样品5次重复,共计得到18个根际土壤样品、30个根系样品和6个土壤样品。

图1 研究区位置图(A)申扎站地理位置图;(B)申扎站高寒草原观测样地谷歌卫星图;(C)流水带实拍图Fig.1 Location map of the study area (A) Geographical location map of Shenzha Station;(B) Google satellite map of alpine grassland observation sample plot of Shenzha Station;(C) Actual picture of running water zone
1.3 分析方法
土壤养分测定方法如下。土壤有机质(SOM)含量采用重铬酸钾容量法进行测定,全氮(TN)含量采用重铬酸钾-硫酸硝化法测定,全磷(TP)含量采用氢氧化钠熔融-钼锑抗比色法测定,碱解氮(AN)含量的测定采用碱解扩散法,速效磷(AP)含量的测定采用碳酸氢钠浸提-钼锑抗比色法,土壤含水量采用烘干法测定。
根系性状测定:根系总根长、平均直径、总表面积、总体积、根尖数等性状采用根系扫描仪(Epson Perfection V850 Pro)测定。
根际土壤微生物群落结构多样性测定。利用土壤DNA提取试剂盒(Mobio Soil DNA Isolation Kit)从1 g土壤样本中提取基因组DNA,DNA提取步骤按照试剂盒说明书进行,并将提取好的DNA样本在―80℃至―20℃冷冻保存待用。使用分光光度计(NanoDrop)检测DNA浓度后,取1 μL DNA样本进行PCR扩增,PCR产物使用1.5%琼脂糖凝胶电泳检测其目的条带大小。将PCR扩增产物送至深圳海一时代基因科技有限公司进行测序分析。
1.4 数据分析
采用Excel 2019对土壤养分、根系性状、根际土壤微生物等数据进行前期处理。用QIIME软件进行各样品细菌多样性(α多样性)及各组间多样性(β多样性)比较分析。使用wilcoxon检验方法进行物种差异检验分析,用MRPP分析方法比较组间群落结构差异是否显著。各处理下的根系形态特征指标利用WinRHIZO根系图像分析系统软件进行分析,并运用SPSS 25.0统计软件进行t检验,分析3种植物在流水带内外的根系形态特征差异(显著性水平设为0.05)。以根际土壤微生物群落在门水平上的相对丰度数据作为物种数据,以土壤理化因子作为环境因子数据,使用Canoco 5.0版本软件进行冗余分析(RDA)。并通过Pearson相关分析来探讨根系形态与根系土壤微生物之间的关系。
2 结果与分析
2.1 不同植物根际土壤菌群总体情况
根据门水平Top 15物种相对丰度柱形图(图2),将相对丰度排名低于十五的细菌归为Others后,流水区与对照区3种不同植物根际土壤细菌排名前十五的门类分别是:Acidobacteria(酸杆菌门)、Proteobacteria(变形菌门)、Thaumarchaeota(奇古菌门)、Actinobacteria(放线菌门)、Gemmatimonadetes(芽单胞菌门)、Bacteroidetes(拟杆菌门)、Planctomycetes(浮霉菌门)、Chloroflexi(绿弯菌门)、Verrucomicrobia(疣微菌门)、Firmicutes(厚壁菌门)、Nitrospirae(硝化螺旋菌门)、Tectomicrobia(护微菌门)、Saccharibacteria(单糖菌门)、Cyanobacteria(蓝藻细菌)、FBP。其中,Acidobacteria(酸杆菌门)为丰度最大的门类,是所有样本中的优势细菌,占所有门类的25%左右,在6个根际土样本中的分布规律为SJS>SJP>SCKC>SCKS>SCKP>SJC。Firmicutes在SCKC根际土组中丰度最大,约为SCKS根际土组的26倍。

图2 门水平Top 15相对丰度柱形图Fig.2 Relative abundance histogram of Top15 species at phylum level
使用wilcoxon检验方法对门水平Top 15物种进行差异检验分析(表1),结果显示,每种植物的根际土壤微生物门类在流水带内外没有显著差异。
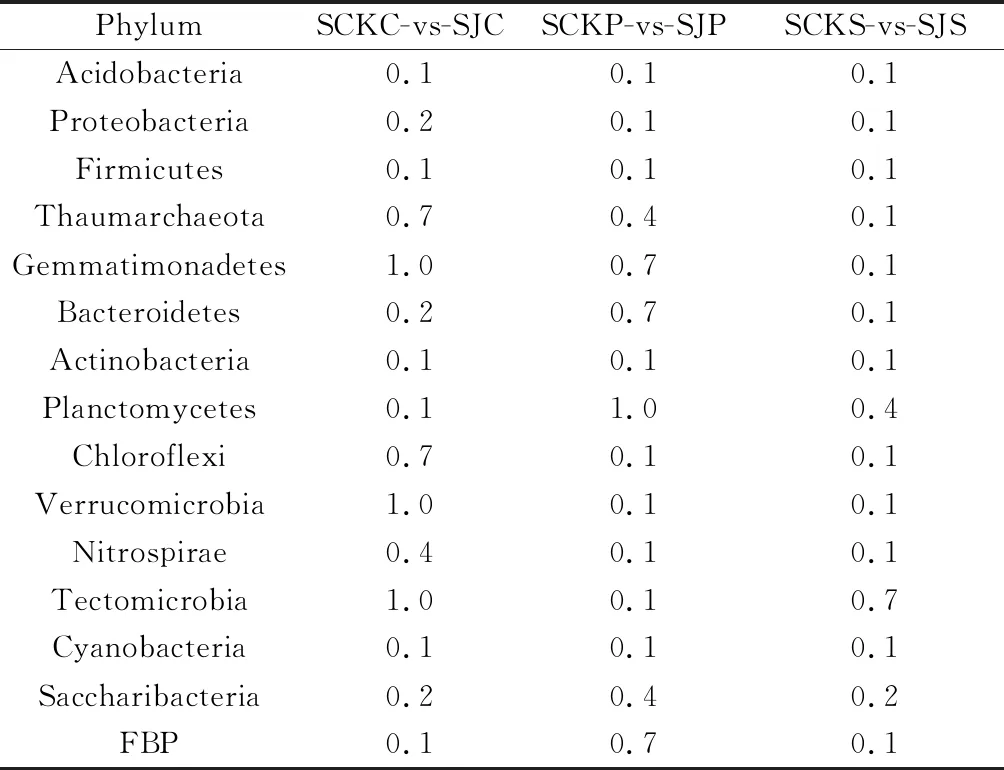
表1 门水平Top15物种间wilcoxon检验表Table 1 Wilcoxon test of Top15 species at phylum level
2.2 不同植物根际土壤的生物多样性差异分析
2.2.1α多样性 基于Shannon指数、Chao 1指数、物种丰富度指数和谱系多样性指数绘制的Alpha多样性小提琴图(图3),SJC根际土组样本生物多样性高于SCKC根际土组样本;SJP根际土组样本生物多样性高于SCKP根际土组样本;而SJS根际土组样本生物多样性低于SCKS根际土组样本。并且SJC与SCKC、SJP与SCKP、SJS与SCKS土壤细菌之间差异均显著(P<0.05)。综上,流水带紫花针茅和青藏苔草根际土组的细菌多样性和丰富性均高于对照组,而流水带早熟禾根际土组的细菌多样性和丰富性是低于对照区的。
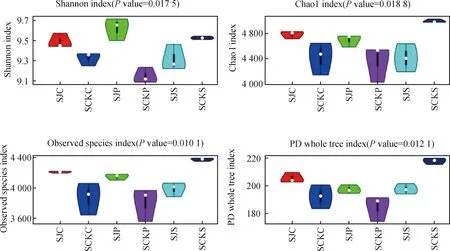
图3 α多样性小提琴图Fig.3 α Violin Pictures of Diversity
2.2.2β多样性 基于OTU水平的主坐标分析(PCoA,Principal Co-ordinates Analysis)显示(图4),与根际土壤细菌相关的2个主成分累计贡献率达53%,PC1和PC2分别可解释总变异量的36%和17%。SJC、SCKC与SJS位于同一象限内且距离较近,距离较近代表它们的细菌群落结构相似;SJP和SCKP距离也较近,说明其群落结构相似;而SCKS距离其他5个样本距离较远,因而表明SCKS的细菌群落结构与其余5个样本存在较大差异。每组样品的细菌群落都位于同一象限内且距离很近,说明每组样品具有很强的聚类性,组内微生物群落结构差异相对较小。
2.2.3组间群落结构差异显著性分析 基于组内和组间差异的MRPP(multi response permutation procedure)分析显示(表2),流水带内外青藏苔草组、早熟禾组和紫花针茅组的expect delta值均大于observe delta值,表明组间差异均大于组内差异,但都不显著。
2.3 土壤养分与根际土壤微生物群落结构的相关分析
根据所有解释变量(包括土壤含水量、有机质SOM、全氮TN、全磷TP、碱解氮AN、速效磷AP)的前向选择结果,选择部分环境因子(SOM、TP、AP)与流水带内外3种典型植物根际土壤微生物群落结构之间的关系进行冗余分析(Redundancy analysis,RDA,图5)。环境变量对响应变量总解释率为65.7%,其中RDA1和RDA2对响应变量的贡献率分别为48.21%和12.82%,物种和环境因子的相关性分别为0.935和0.779。SJC与SCKC之间根际土壤微生物群落结构差异不显著,SJS与SCKS、SJP与SCKP之间微生物群落结构差异较大,且3种植物种间的根际土壤微生物群落结构差异显著。环境因子AP对根际土壤微生物群落结构有显著影响(P<0.05),TP和SOM对微生物群落结构影响不显著。AP与Bacteroidetes、Firmicutes有较强的正相关关系,与Verrucomicrobia和Nitrospirae呈显著负相关关系;TP与Saccharbacteria、Proteobacteria、Thaumarchaeota、Acidobacteria呈负相关,而与Chloroflexi呈正相关;SOM与Gemmatimonadetes、Planctomycetes、Nitrospirae、Actinobacteria呈正相关关系。

图5 根际土壤微生物群落结构与环境因子的RDA分析Fig.5 Redundancy analysis of rhizosphere soil microbial community structure and environmental factors注:SOM,土壤有机质;TP,全磷;AP,速效磷Note:SOM,soil organic matter;TP,total phosphorus;AP,available phosphorus
2.4 流水带内外植物根系形态差异
流水带内外3种植物间的总根系形态特征存在一定差异(表3)。在青藏苔草组中,流水带组与对照组在根尖数上存在差异,SCKC显著高于SJC(高80.18%),根尖数达到409个,而在总根长、总表面积、平均直径和根系总体积之间差异不显著;早熟禾组中,总表面积、平均直径和根系总体积都表现出SJP>SCKP,分别为15.04 cm2,0.82 mm,0.32 cm3,而根尖数表现为SCKP>SJP,为282个;在紫花针茅组中,总根长与根尖数表现一致为SCKS显著高于SJS,分别高出77.26%,29.52%,平均直径则表现为SJS显著高于SCKS(高37.21%)。此外,根尖数在青藏苔草、早熟禾和紫花针茅中都表现为对照组显著高于流水带组(P<0.05)。
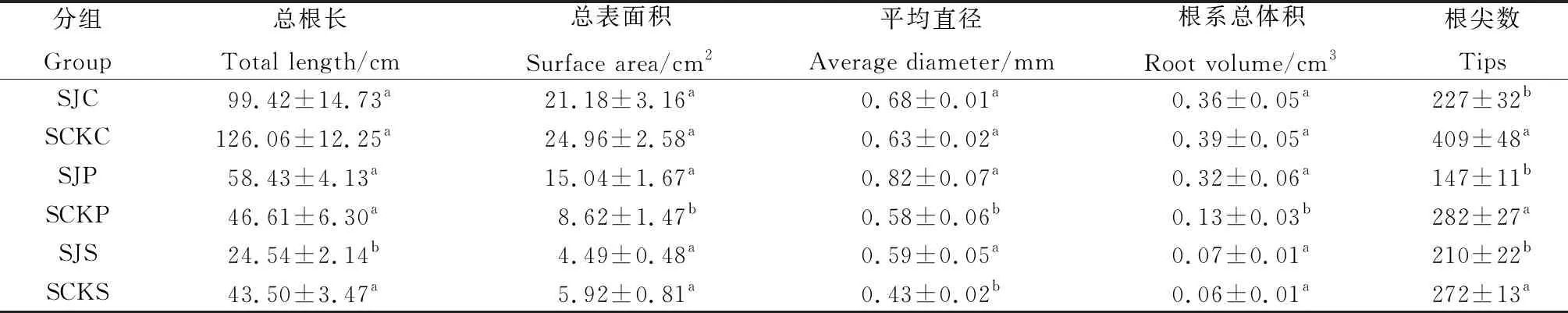
表3 流水带内外3种植物根系形态特征比较Table 3 Comparison of root morphological characteristics of three plants inside and outside the running zone(mean±SE)
2.5 根系形态与根际土壤微生物群落结构的相关分析
Pearson相关分析结果(表4)表明,Gemmatimonadetes与总根长和根系总表面积、Planctomycetes与总根长之间呈显著正相关关系(P<0.05),Actinobacteria与根尖数呈显著负相关关系(P<0.05),且相关系数均大于0.8,表明这些指标之间存在极强的相关关系。
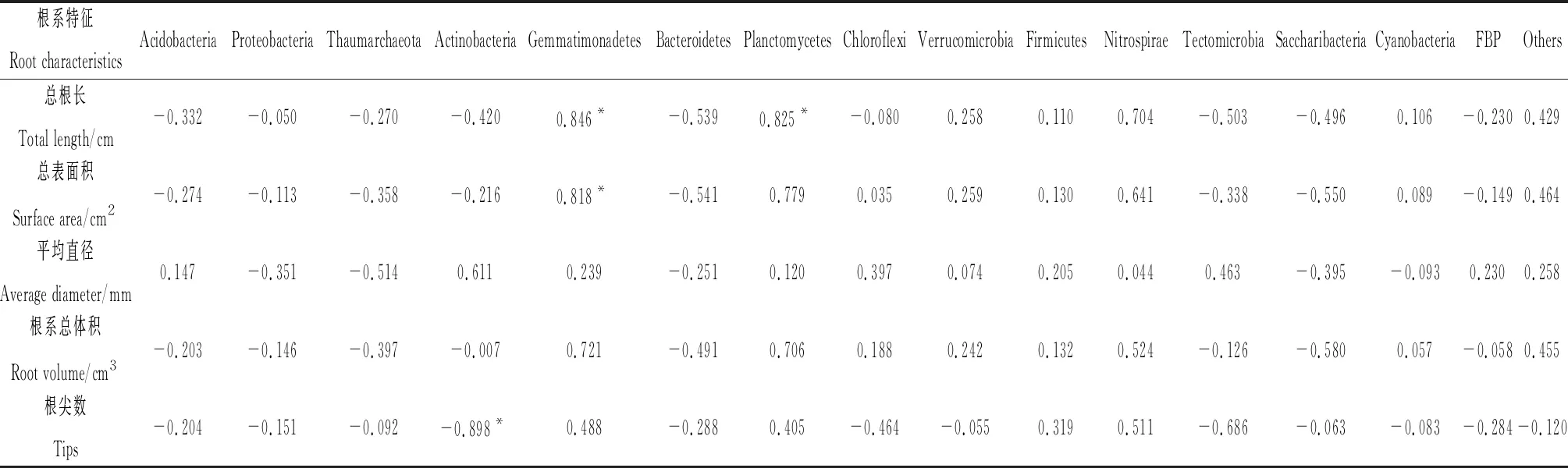
表4 根系形态与根际土壤微生物的Pearson相关分析Table 4 Pearson correlation analysis between root morphology and rhizosphere soil microorganisms
3 讨论
3.1 根际土壤细菌群落结构差异分析
根际是在不同植物种类、土壤和环境条件下形成的土壤-根系-微生物互作微区域,这一微生态系统中的许多化学变化和生物化学过程不同于普通的土体土壤,这些过程对植物的生长发育、营养物质的吸收与利用、微生物的生存等有直接影响作用[21]。本研究位于常年围封的永久样地内,未受到放牧和人为干扰,对流水带内外3种典型植物的根际微生物群落进行测序分析之后发现,在门水平上,Acidobacteria(酸杆菌门)的丰度最大,达到25%左右,这与Liles等[22]的研究结果一致,其次是Proteobacteria(变形菌门)(图2)。有研究表明[23],当森林土壤被扰动后,变形菌门的丰度大于酸杆菌门,而在未受扰动的原始森林土壤中,酸杆菌门的丰度大于变形菌门。这与本研究结果相似,不同之处在于Ward等[23]的研究对象为森林土壤,而在本研究中为草原土壤。Smit等[24]的研究发现,当酸杆菌门与变形菌门的比值大于1时,土壤中的养分处于一个较低水平。因此,推测酸杆菌门丰度大于变形菌门的原因可能是由于酸杆菌门生长缓慢,一旦土壤结构发生改变,土壤营养随之变化,此时生长较快的微生物便会取代寡营养生长方式的酸杆菌门。在本研究中,相对丰度排名靠前的酸杆菌门、放线菌门和变形菌门在Fierer等[25]的研究中被认为是贫营养型细菌,主要负责分解深层土壤中的顽固性碳。
影响根际土壤微生物多样性的因素是多元的,包括草地不同利用方式[26]、土壤类型[27-28]、植物类型等等。在本研究中,wilcoxon物种差异检验结果表示3种植物组内没有显著差异(表1),并在PCoA分析中得到验证,即组内微生物群落结构差异较小。MRPP分析结果显示3种植物组间差异大于组内差异,但是不显著(表2),推测组内差异和组间差异不显著的原因可能是由于生物学重复样本量不足造成的。可见,在本研究中造成3种典型植物组内微生物群落没有显著差异且组间差异大于组内差异最可能的原因是由于植物种类的不同,而不是不同的采样区。
3.2 根际土壤微生物群落结构与环境因子的关系
研究表明[29-30],土壤理化性质的变化,例如土壤pH、有机质、全氮、全磷、速效钾、速效磷等含量的改变,会引起植物根际区域微生态环境的改变,对植物根际土壤微生物群落结构多样性和植物的生长发育产生影响。磷(P)是植物生长和进行主要代谢过程所必需的大量营养元素,也是影响植物生产力的限制性因子[31]。在本研究中,影响根际土壤微生物群落结构及其多样性的关键因子是AP(图5)。张永亮等[32]的研究发现牧草的生长会消耗土壤较多的速效磷,而土壤中较低的速效磷水平往往是植物生长的主要限制因素[33]。紫花针茅和早熟禾在流水带外的根际速效磷含量高于流水带内,推测可能是由于雨季径流的冲刷和渗透作用将养分带向下游流水带或更深的土层[34],而AP含量在青藏苔草组表现为流水带内大于流水带外,推测可能是因为植物类型的不同。不同的植物对土壤速效磷的需求量不同,同时对根际微生物的“招募”作用可能存在物种偏好性[35]。这在本研究中得到了验证,AP与Bacteroidetes呈显著正相关关系,Bacteroidetes相对丰度与AP含量规律一致,表现为SJC>SCKC,SJP 根系作为连接土壤与植物的载体,其形态特征的变化直接关系着植物对土壤养分和水分的吸收与利用,还会影响植物向地下生态系统输入有机物[38-39]。在本实验中发现,流水带内的植物根系形态与流水带外相比差异较为显著。紫花针茅流水带外的根系长度显著高于流水带内,根系平均直径则表现为显著低于流水带外,可能是由于流水带外表层土壤水分含量较低,植物根系需要主动吸收深层土壤中的水分用以维持其生命活动[40]。此时根系长度增加[41],根系直径减小,根系吸水阻力随之减小,植物能够最大程度的获得深层土壤中的水分用以维持生长。丁红等[42]认为在干旱的生境下,较长的根系和较大的根系体积和表面积更有利于植物大范围的吸收与利用土壤中的水分和养分。韩志顺等[43]对不同品种的紫花苜蓿进行干旱胁迫控制实验发现,干旱胁迫下植物通过改变根系长度、直径、表面积、体积等形态特征来提升自身的抗旱性。3种植物的根系平均直径均表现为流水带内大于流水带外,推测根系直径越小其活力越高,使得植株耐旱性更强。Fitters等[44]的研究表明,相对湿润条件下的植物会通过提高光合作用来提高净初级生产力,这也会向根系输入更多的碳,进一步使根系直径变大。而根尖数与根系直径截然相反,均表现为流水带外显著高于流水带内,推测在相对干旱的生境条件下,根系的基础代谢功能增强,诱发根系生长出大量的侧根和根毛,迫使植物通过增大与土壤的接触面积来获取生长所需的水分[45]。另外,根系不仅与植物有直接联系,还能对根际微生物产生作用,并通过根际分泌物诱导菌群繁殖和抑制致病菌的生长[46]。Pearson相关分析显示,根尖数与Actinobacteria显著负相关,推测根尖可能会分泌某些物质抑制Actinobacteria的生长。因此,如果想要对根际微生物与根系形态之间的关系有更全面的了解,还需要进一步探究根际分泌物对根际土壤微生物的影响机制。 本研究通过对流水带内外3种典型植物的细菌群落与根系形态特征进行分析,主要得出以下结论:3种植物的根际土壤微生物门类在流水带内外没有显著差异,Acidobacteria(酸杆菌门)为所有样本中的优势菌门,并且组间差异均大于组内差异,但不显著,在一定程度上说明了不同类型的植物是造成根际土壤微生物群落结构差异的原因。流水带内外3种植物间的总根系形态特征存在一定差异,根系平均直径一致表现为流水带组大于对照组,根尖数则表现为对照组显著高于流水带组,说明植物会通过各自独特的生存策略来调整根系形态以适应不同的生境条件。在测定的土壤环境因子中,速效磷是影响根际土壤微生物群落结构及其多样性的关键因子,因此,速效磷可以作为预测藏北高寒草原上根际土壤微生物群落结构与功能的关键指标。3.3 流水带内外植物根系形态分析
4 结论

