两种电泳法分析丁香提取物对猪肌原纤维蛋白氧化位点的控制
陈洪生,马金明,潘德胤,杨裕如,韩 齐,刁静静
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江省中加合作食品研究发展中心,黑龙江 大庆 163319;3.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319)
在肉类加工中,香辛料通常被加入到产品中以抑制脂肪和蛋白的氧化。近年来,在肉类加工中添加丁香提取物(clove extract,CE)改善肉制品品质已有部分研究。Zhang Huiyun等研究发现,CE可通过抑制脂质过氧化和清除自由基抑制广式香肠中脂质氧化产物含量的增加和蛋白质羰基的生成。Armenteros等研究发现,在冷藏过程中CE可以抑制熟火腿中蛋白质发生氧化。前期研究发现,CE具有较好的抑制猪肌原纤维蛋白(myofibrillar protein,MP)氧化的作用。
电泳法在肌肉蛋白质的研究中早已得到了广泛应用,双向电泳法也已成为肉品科学领域的主要研究方法之一。在宰后肌肉代谢方面,Lametsch等最早应用蛋白质组分析了宰后猪肌肉的变化情况,其中15 个蛋白质点在宰后发生了显著的变化。Zhou Changyu等研究金华火腿蛋白质组学特征及感官特性发现肌球蛋白、肌动蛋白和肌钙蛋白是影响金华火腿口味中最重要的标记蛋白。在肉品贮藏加工方面,Zhang Muhan等对鹅肌肉保水能力相关蛋白进行了蛋白组分析,鉴定出21 个差异蛋白,包括结构蛋白、代谢酶、抗氧化酶与应激反应蛋白质。
本课题组前期研究表明CE可以显著降低猪肉饼的脂质氧化和蛋白氧化水平;CE能够有效抑制羟自由基氧化诱导的MP结构和功能性变化,且氧化3 h时,CE对各项指标控制明显。在此基础上,本实验拟采用胰凝乳蛋白酶将氧化后的MP水解为肌球蛋白的头部(S1)和尾部(Rod),进一步确定CE抑制蛋白氧化的具体部位,并结合双向电泳法分析氧化3 h以及CE的添加对差异蛋白的影响,确定羟自由基氧化影响的主要氨基酸部位。蛋白质功能性的提高能够通过抑制或控制蛋白氧化实现,这种方法在肉制品加工贮藏中具有重要意义,也为MP与CE的互作机理研究提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
猪背最长肌和丁香香辛料购于黑龙江大庆新玛特超市。
丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、,’-甲叉双丙烯酰胺、牛血清白蛋白、Tris碱、四甲基乙二胺(tetramethylethylenediamine,TEMED)、过硫酸铵(ammonium persulfate,APS)、1,4-哌嗪二乙磺酸(1,4-piperazine diethanesulfonic acid,PIPES)、乙腈 美国Sigma-Aldrich公司;-巯基乙醇 美国Amersco试剂公司;SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)标准蛋白 宝生物工程(大连)有限公司;三氯乙酸、溴酚蓝 天津化学试剂一厂。试剂均为分析纯。
1.2 仪器与设备
DELTA320 pH计 美国Mettler Toledo公司;AL104精密电子天平 梅特勒-托利多仪器(上海)有限公司;Allegra 64R台式高速冷冻离心机 美国贝克曼库尔特有限公司;等电聚焦电泳仪 美国Amersham公司;5800 MALDI-TOF质谱仪 美国AB SCIEX公司。
1.3 方法
1.3.1 猪肌肉蛋白质提取
猪背最长肌垂直于肌纤维方向切成80~120 g的肉片,根据Park等方法提取MP并稍作修改,提取液和洗液需要冷却至4 ℃使用最佳,MP的提取在4 ℃环境下完成。
1.3.2 蛋白含量测定
根据Chan等的双缩脲法测定蛋白质含量,标准曲线方程:=5 192+0.015 1,=0.999。
1.3.3 CE制备
根据Sun Qinxiu等的方法醇提CE,并稍作修改。将丁香置于40 ℃烘箱中干燥4.5 h并研碎成粉末,取5 g加入50 mL乙醇在超声波细胞粉碎机中提取7 h,过滤。滤渣再用同样方法提取12 h。滤液2 500 r/min离心15 min,取上清液进行蒸发浓缩,冷却待用。
1.3.4 MP氧化
采用丁安子等的方法稍作修改。以10 µmol/L FeCl、100 µmol/L的抗坏血酸、10 mmol/L HO作为猪MP的氧化体系。用含0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25)将提取的MP质量浓度稀释为20 mg/mL。在前期实验的基础上,选择CE质量浓度为1.0 mg/mL,使用氧化体系于4 ℃分别氧化0、1、3、5 h。最后通过添加1 mmol/L的水溶性VE(Trolox)终止氧化反应。未加氧化剂但含有Trolox的蛋白溶液作为对照。
1.3.5 MP水解
经氧化和CE处理后的MP用含0.1 mol/L NaCl和1 mmol/L乙二胺四乙酸的Tris-HCl缓冲液(pH 7.5、20 mmol/L)稀释成质量浓度4 mg/mL,加入胰凝乳蛋白酶(酶∶底物=1∶500)于25 ℃水解60 min,然后用0.5 mmol/L苯甲基磺酰氟终止反应。
1.3.6 一维电泳实验
采用SDS-PAGE对未氧化、氧化和添加CE后再氧化的MP进行分析,具体过程依据Chen Hongsheng等方法进行,按照表1配制分离胶和浓缩胶。电泳凝胶板为1 mm;上样量为12 μL;开始电泳时电压为80 V,待样品进入分离胶后电压为120 V;取出胶片用考马斯亮蓝染色0.5 h(染色液包括50%甲醇、6.8%冰醋酸和1 mg/mL考马斯亮蓝),用甲醇-冰醋酸脱色液洗脱至透明(脱色液组成包括5%甲醇和7.5%冰醋酸)。最后将电泳胶片置于天能凝胶成像仪摄像。
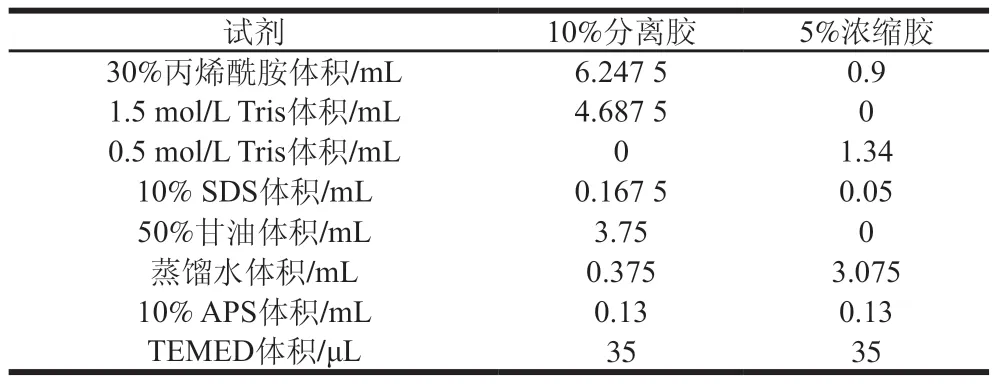
表1 分离胶和浓缩胶的组成Table 1 Composition of separating and stacking gels used for SDS-PAGE
1.3.7 双向凝胶电泳实验
双向电泳选用1.3.1节和1.3.4节中制得的蛋白样品进行,分别为未氧化的MP、氧化3 h的MP和加CE后氧化3 h的MP三个样品做双向电泳研究。用SDS-PAGE对氧化和未氧化的MP进行分析,具体过程依据Görg等的方法稍作修改。将上述得到的3 个样品离心,去上清液,重复2 次。加入400 μL的2D电泳细胞裂解液,功率100 W条件下冰浴超声破碎10 s(间歇15 s,共10 次),13 400 r/min离心5 min后分装,-80 ℃保存。各组样品进行等电聚焦电泳。根据蛋白浓度检测结果的计算,将一定含量的蛋白样品与一定量的水化上样缓冲液充分混匀,使上样总溶液体积达到200 μL,上样量80 μg;电泳条件为13 cm、pH 3~10的非线性胶条;等电聚焦条件和程序为30 V、12 h,500 V、1 h,1 000 V、1 h,8 000 V、8 h,500 V、4 h;将聚焦好的胶条放入平衡管中,加入平衡缓冲液缓慢摇动13 min;在进行第二向电泳前将冷凝水开启,温度达到15 ℃时,安装垂直电泳仪;SDS-PAGE为12.5%的胶(15 mA胶30 min,再30 mA胶至溴酚蓝离胶下沿0.5 cm停止电泳)。
1.3.8 双向电泳凝胶的图像分析
为了将双向电泳凝胶中的蛋白质点实现可视化,本实验参照Yan等方法,用UMax Powerlook 2110XL对银染胶进行扫描,并采用ImageMaster 2D Platinum 5.0软件对双向电泳图谱进行分析。3 个样品各3 个重复,共9 块胶。差异蛋白点检测设置:两组间同一蛋白点的相对丰度之比大于1.5 倍(检验,<0.05),判定该点为差异表达蛋白点,当一组胶中某个蛋白点丰度高于另一组的1.5 倍时记为上调,反之记为下调。
1.3.9 双向电泳凝胶切点胰蛋白酶消化和脱盐
将标记的蛋白点切下呈粒状,然后将胶粒切碎后转入离心管中,加入200~400 μL含100 mmol/L NHHCO和30%丙烯腈(acrylonitrile,ACN)的脱色液(银染时:加入30~50 μL的30 mmol/L KFe(CN)-100 mmol/L NaSO(1∶1,/)的脱色液),清洗脱色至透明,吸弃上清液,加入100 mmol/L NHHCO,室温孵育15 min。吸弃上清液并冻干,加入5 μL质量浓度为2.5~10 ng/μL测序级胰蛋白酶溶液(酶与被分析蛋白的质量比一般为1∶20~1∶100),37 ℃条件下反应过夜(20 h左右)。吸出酶解液,转移至新离心管中;在原管中加入100 μL含0.1%三氟乙酸(trifluoroacetic acid,TFA)的60% ACN,超声15 min,吸出并合并酶解液,冻干;若有较多盐分,则用微孔膜进行脱盐。
1.3.10 串联飞行时间质谱鉴定蛋白点
取2 μL 20%乙腈溶液复溶冻干后的酶解样品。取1 μL溶解样品,直接点于样品靶上。待溶剂自然干燥后,取0.5 µL过饱和-氰基-4-羟基肉桂酸基质溶液(溶剂为含0.1% TFA的50% ACN),点至对应靶位上并自然干燥。样品靶经氮气吹净后放入仪器进靶槽,并用5800型串联飞行时间质谱仪进行测试分析,激光波长为355 nm,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据,一级质谱扫描范围为800~4 000 Da,选择信噪比大于50的母离子进行二级质谱分析,每个样品点上选择8 个母离子,二级质谱累计叠加2 500 次,碰撞能量为2 kV。质谱测试原始文件用Mascot 2.2软件检索相应的数据库,最后得到鉴定的蛋白质结果。
1.4 数据处理
所有实验至少重复3 次,利用Tanon软件分析凝胶图像、UMax Powerlook 2110XL软件扫描银染胶、Sigmaplot 12.5软件作图、ImageMaster 2D软件分析二维电泳、PDQuest软件分析二维电泳之间的差别。
2 结果与分析
2.1 CE对不同氧化时间MP的SDS-PAGE及影响部位
如图1所示,两块胶中的肌球蛋白重链(myosin heavy chain,MHC)含量均随氧化时间的延长而逐渐减少并消失;但氧化1 h后,两块胶中未添加CE组的MHC条带迅速消失,而添加CE组还有一定的MHC存在,这个结果与Chen Hongsheng等的结果一致。同时,两块胶中的Rod和S1含量均随氧化时间的延长而逐渐减少;未添加CE组氧化5 h后,Rod和S1均全部消失,说明长时间的氧化使蛋白质结构充分展开(或肽链断开),水解后形成大量的碎片,这些碎片表现为凝胶底部出现明显条带,说明氧化会使大分子蛋白减少,形成小的碎片。然而,添加CE组中,随氧化程度的增加Rod也逐渐减少,但氧化5 h后并未完全消失;S1虽然也有一定程度的减少,但条带依然很浓,说明CE对S1部位的保护作用更加明显;由于Ca-ATPase存在于S1部位,前期研究表明CE控制了Ca-ATPase的氧化失活。尽管CE对Rod也有一定的保护作用,但与S1部位相比较,作用并不明显,说明CE主要保护了S1部位的氧化损失。有趣的是,不管是否添加-巯基乙醇,未添加CE样品的S1条带都随氧化时间的延长,而逐渐变淡;而肌动蛋白条带随氧化时间的延长,逐渐变浓。这说明氧化使S1分解成部分小的碎片,并且这些碎片与肌动蛋白发生交联,形成了较大的分子聚集体,氧化5 h后S1彻底分解为碎片而消失,而此时肌动蛋白条带也达到最粗(浓),并且下方又生成了几个明显的条带;说明Rod和S1分解成小的片段后,一部分与肌动蛋白结合形成了大的聚集体,另一部分没有与肌动蛋白结合的片段,在凝胶底部形成了较明显的条带。
然而,CE的添加彻底地改变了这种氧化修饰模式。由图1可知,随氧化时间的延长,S1并没有显著减少,同时肌动蛋白也没有显著变粗。添加-巯基乙醇后,肌动蛋白下方出现了一个明显的条带,同时肌动蛋白条带显著变淡,这说明Rod和S1分解生成的小片段主要是通过二硫键与肌动蛋白发生的交联。

图1 MP氧化和CE处理后经胰凝乳蛋白酶水解为S1和Rod的SDS-PAGE模式Fig.1 SDS-PAGE patterns of S1 and Rod after MP oxidation and CE treatment by chymotrypsin hydrolysis
Ooizumi等研究鸡肉的肌球蛋白氧化时,发现随氧化程度的增加,S1显著减少。Xiong等发现猪肌球蛋白随氧化程度的增加,Rod和S1损失明显,当HO浓度超过5 mmol/L时Rod和S1基本消失,同时在它们的上方产生了一个新的条带。这些结果与本研究结果基本一致。因此,CE的添加在一定程度控制了Rod的氧化损失,更大程度保护了长时间氧化下S1部位的裂解。
2.2 未氧化MP与氧化蛋白的双向电泳图谱及差异蛋白分析
扫描图2中两组双向电泳图谱后,得到了未氧化猪MP点1 453 个,氧化后得到蛋白点1 412 个。两组样品对比发现27 个差异蛋白点,做柱形图进行丰度对比分析。如图3可知,经羟自由基氧化后,差异点1815、1060、1968、1846和1049等10 个蛋白点的丰度显著下降,蛋白点1060氧化后几乎消失,说明这些蛋白对氧化应激的敏感性最强,氧化后最容易发生肽链的断裂,分解成蛋白亚基或肽类,蛋白损失最为严重。从图2可以更直观地看出,氧化后方框内的蛋白丰度显著下降。氧化后丰度显著增加的点有942、1417、1398和1491等17 个蛋白点,推测这些蛋白可能是肌球蛋白或肌动蛋白等的亚基或碎片。这与前面S1和Rod部位的研究结果一致。
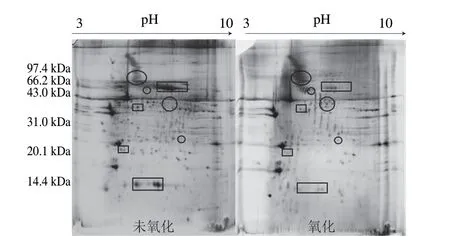
图2 未氧化与氧化MP的双向电泳对比模式图Fig.2 2-DE profiles of non-oxidized and oxidized MP
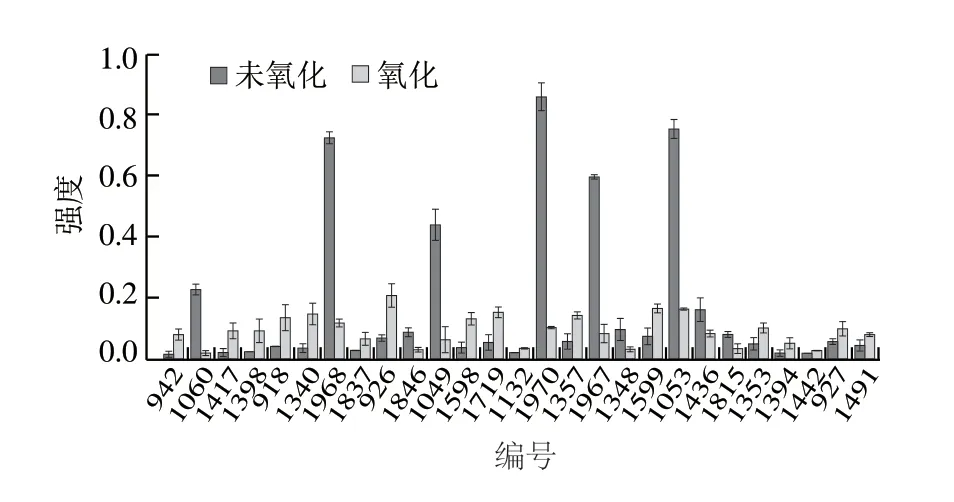
图3 未氧化与氧化MP的差异表达蛋白强度对比图Fig.3 Spot intensity of differentially expressed proteins between nonoxidized and oxidized MP
2.3 氧化MP与添加CE后氧化蛋白的双向电泳图谱及差异蛋白分析
为研究CE添加对氧化后蛋白组学变化模式的影响,研究将添加CE后氧化的样品进行双向电泳实验。从添加CE组的双向电泳图谱中得到蛋白点1 548 个、差异蛋白点18 个。
由图4 可知,在M P 中添加C E 后氧化,差异点1564、1994、1836和1535等15 个蛋白点的丰度显著下降(<0.05)。由前期研究可以初步推断这些蛋白可能是肌球蛋白或肌动蛋白等MP主要蛋白的亚基或蛋白碎片,这可能是未添加CE氧化没有得到有效控制,使许多蛋白的肽链发生断裂,形成了较多的蛋白碎片或亚基。从图5可以更直观地看出,添加CE后方框内的蛋白丰度显著下降。这一假设还需要后续的质谱鉴定作为进一步的支持。添加CE后氧化的样品中,丰度显著增加的蛋白点只有1181、1795和1900三个蛋白点(图4),从图5也可以清晰地看到这些蛋白质氧化后强度明显增加,推断这些蛋白可能是构成MP结构中天然的、没有被分解的蛋白,并且由于受到了CE的抗氧化保护而得以较完整地存在。这个假设同样需要质谱鉴定作为进一步的支持。
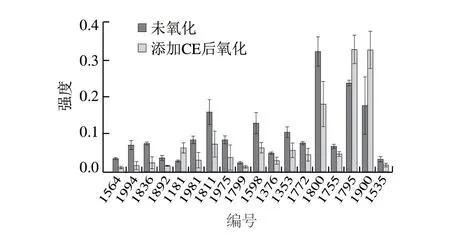
图4 氧化MP与添加CE后氧化MP的差异表达蛋白强度对比图Fig.4 Spot intensity of differentially expressed proteins of oxidized MP versus oxidized MP after addition of CE
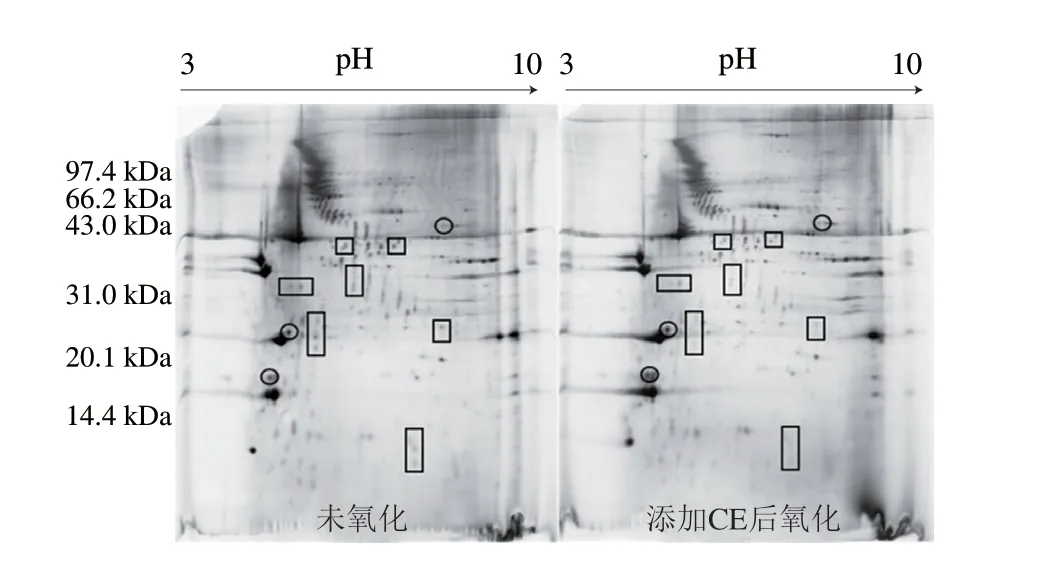
图5 氧化MP与添加CE后氧化MP的双向电泳对比模式图Fig.5 2-DE proflies of oxidized MP versus oxidized MP after addition of CE
2.4 猪MP氧化及添加CE后氧化的差异蛋白点的鉴定与分析
根据上述实验结果,选择差异显著的蛋白点进行鉴定,共筛选23 个蛋白点进行质谱鉴定,鉴定成功的蛋白点共计18 个,如表2所示。
如图3、表2和图6所示,氧化后丰度明显增加的点942和1340鉴定为猪肌球蛋白重链-4(MHC-4),点1417、1132和1357鉴定为类猪肌球蛋白重链-2(MHC-2),点1398鉴定为猪肌球蛋白重链-1(MHC-1),这些蛋白都属于猪骨骼肌MHC的一部分,但一维SDS-PAGE中,MHC的含量是随氧化程度的增加而减少的,与此结果相矛盾。分析表2中的分子质量不难发现,这些蛋白点的实际分子质量远小于理论分子质量,从而断定这些蛋白点并不是完整的MHC,而是MHC断裂后产生的碎片,这些碎片在氧化后大量增加。这与Malheiros和Poleti等采用蛋白质组学方法对蛋白质氧化损伤的研究结果一致。点1837鉴定为钙调节磷酸酶结合蛋白-1,该蛋白是-肌动蛋白素和-细丝蛋白结合的一种蛋白,存在于骨骼肌的Z线上,被氧化后会显著增加,说明氧化可能促进了该蛋白与小的蛋白碎片发生聚合,从而增加了强度。点926鉴定为猪肌球蛋白连接蛋白H亚型X1。点1598和1599鉴定为猪-肌动蛋白帽化亚基的异构体X3,是肌动蛋白结构中的一部分,被氧化后显著增加。点1719鉴定为MHC碎片,该蛋白点的增强充分说明了氧化导致了MHC肽链的断裂,导致MHC碎片的积累,这与经胰凝乳蛋白酶水解后MP一维电泳的结果一致。
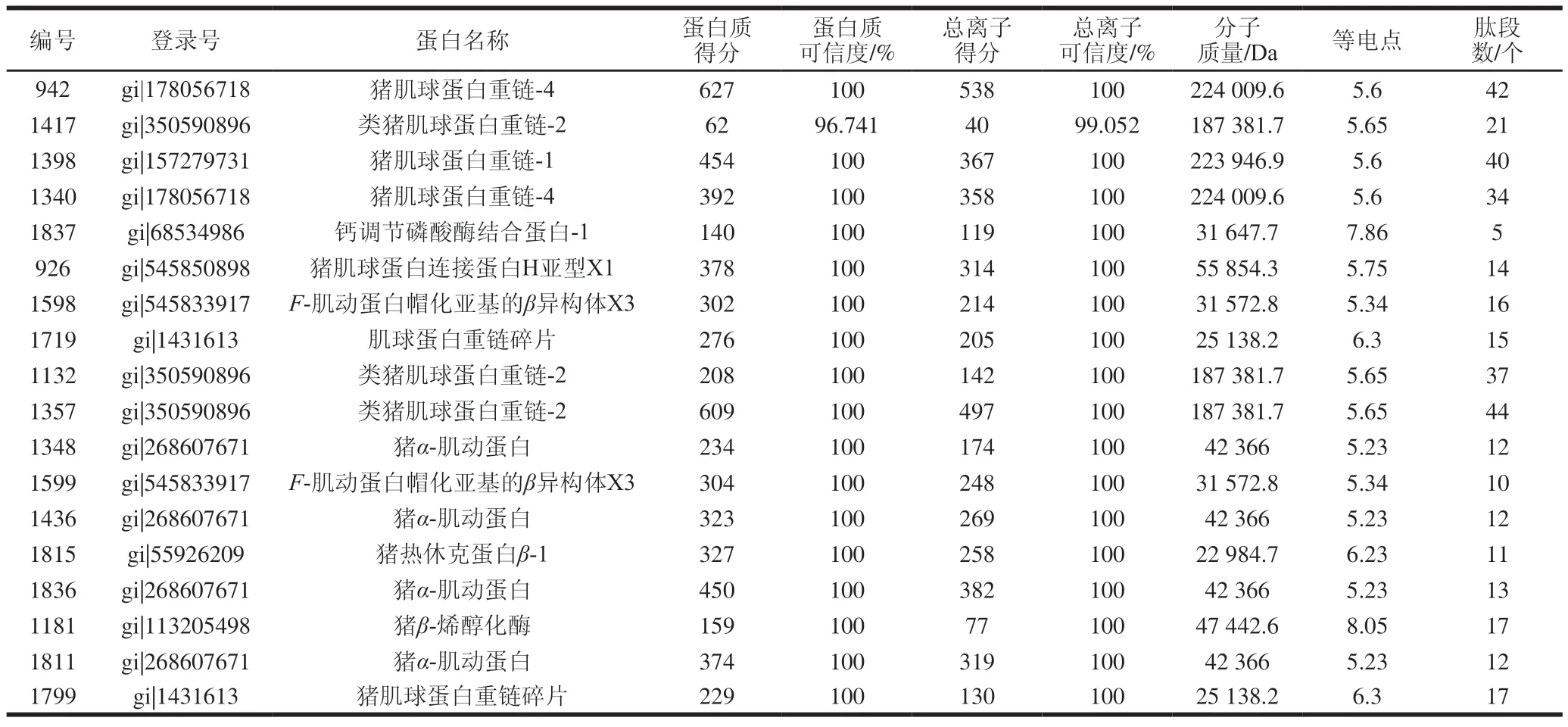
表2 质谱鉴定成功的蛋白质点及相关信息Table 2 List of identified protein spots by MALDI-TOF-MS

图6 未氧化MP的2-DE图谱中鉴定成功的蛋白点Fig.6 MS Identified spots in 2-DE protein proflie of non-oxidized MP
如图4、图7和表2所示,添加CE后氧化的MP中,丰度下降明显的蛋白点包括1836和1811,鉴定为猪-肌动蛋白。从图6和图7可以明显地看到,虽然1348和1436也鉴定为猪-肌动蛋白,但这两个蛋白点的实际分子质量远大于点1836和1811的分子质量,表明1836和1811并不是完整的-肌动蛋白,而是-肌动蛋白产生的碎片,这说明CE有效地抑制了-肌动蛋白的氧化损失,印证了前面的假设。1799鉴定为猪MHC碎片,这也印证了前面的假设,说明CE有效地抑制了MHC中肽键的氧化断裂,从而降低了MHC碎片的氧化积累。在添加CE后氧化的MP中,丰度显著增加的点很少,已鉴定的只有1181一个蛋白点,为猪-烯醇化酶,属于糖酵解途径中的酶类,说明CE能够保护-烯醇化酶,使其免受氧化作用而损失掉。鉴定到的-烯醇化酶分子质量与实际分子质量差异不大,因此确定其为完整的蛋白。蛋白点1815鉴定为猪热休克蛋白-1。双向电泳的结果也进一步证实了,CE能够通过控制完整蛋白的氧化损失抑制MHC等大分子蛋白碎片的增加。

图7 氧化MP的2-DE图谱中鉴定成功的蛋白点Fig.7 MS identified spots in 2-DE protein profile of oxidized MP
表3是MHC-4中部分肽段的质谱鉴定结果,可以清晰地发现,羟自由基诱发的MP氧化主要修饰的氨基酸部位是甲硫氨酸和半胱氨酸,这种修饰也代表了本研究中其他蛋白残基的修饰方式。氧化后,半胱氨酸主要形成二硫键,甲硫氨酸主要形成亚砜甲硫氨酸,这与Park等采用羟自由基氧化猪MP的结果一致。
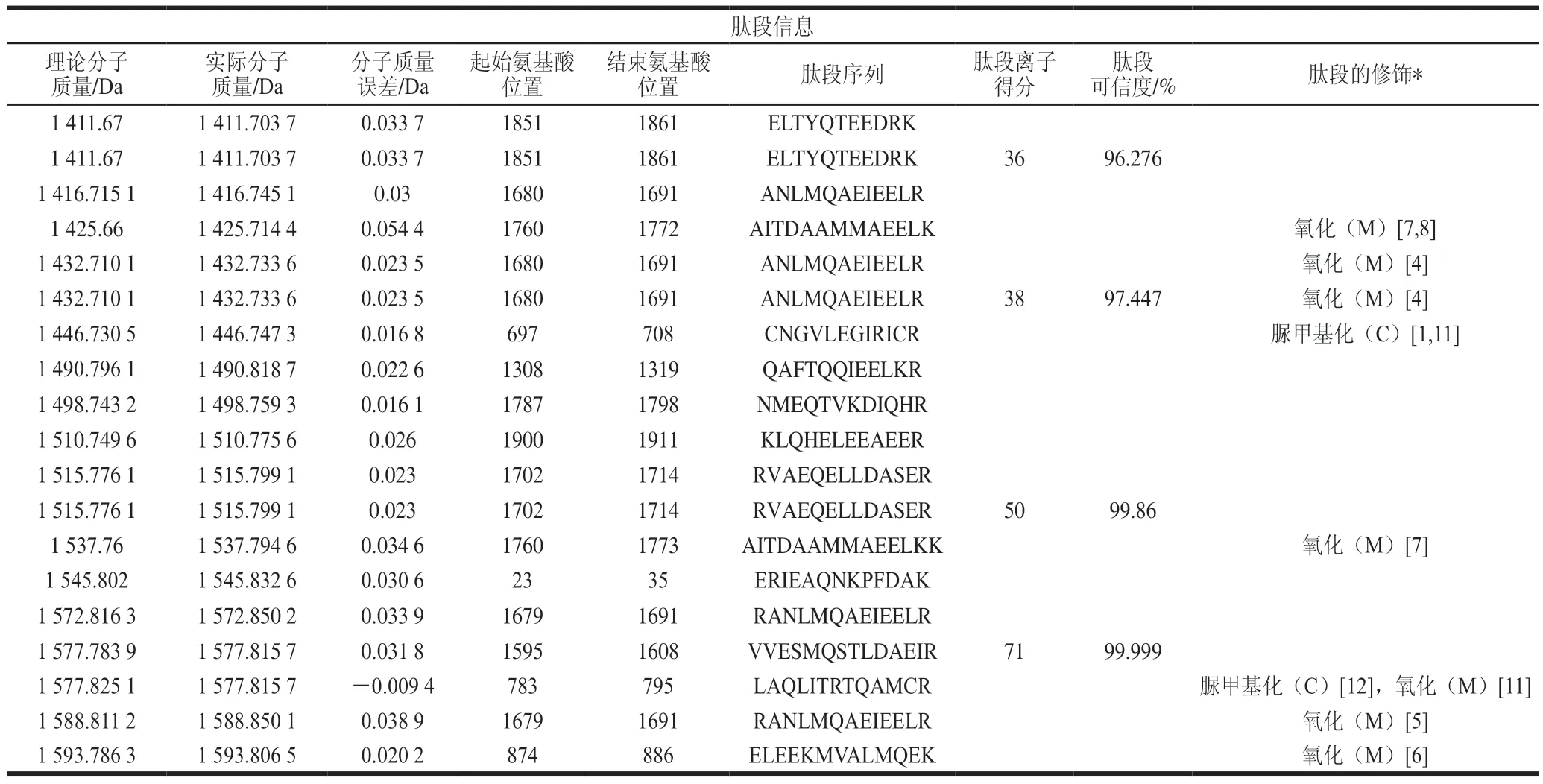
表3 质谱鉴定中MP氧化的主要修饰部位和氨基酸Table 3 Main modification sites and amino acids of oxidized MP identified by MS
3 结论
一维电泳结果表明,CE的添加显著地抑制了肌球蛋白头部和尾部的氧化损失,而CE对S1部位的保护作用更加明显;另外,肌动蛋白含量随氧化程度的加强而增加,主要是通过二硫键与Rod和S1的片段交联而形成。双向电泳和质谱鉴定结果显示,氧化后丰度明显下降的点1815鉴定为猪热休克蛋白-1,说明该蛋白受羟自由基氧化非常敏感;氧化后丰度增加的蛋白主要是MHC和肌动蛋白的碎片,CE的添加显著抑制蛋白碎片的产生,显著提高-烯醇化酶等完整蛋白的丰度。肽段的质谱鉴定结果显示,羟自由基诱发的MP氧化主要修饰的氨基酸部位为甲硫氨酸和半胱氨酸,氧化后半胱氨酸主要形成二硫键,而甲硫氨酸主要形成亚砜甲硫氨酸。因此,该项研究结果表明在肉制品加工与贮藏中添加CE可以改善肉制品的功能特性,也为MP与CE的互作机理研究提供一定的理论支持。

