泊沙康唑原料细菌内毒素检查方法的建立
耿 雪,南红燕,范治云,刘 娜,祝清芬,李 军*
(1. 山东省食品药品检验研究院 国家药品监督管理局仿制药研究与评价重点实验室 山东省仿制药一致性评价工程技术研究中心,山东 济南 250101;2. 山东金城医药研究院有限公司,山东 淄博 255000)
泊沙康唑(posaconazole)是伊曲康唑的衍生物,商品名Noxafil,为第二代三唑类抗真菌药物,与第一代相比具有更强、更广的抗菌谱,适用于免疫系统严重受损的患者[1]。作用机制为抑制一种对真菌细胞色素P450具有依赖性的酶-羊毛甾醇14α-去甲基化酶,使麦角甾醇合成受阻从而导致真菌细胞膜上麦角甾醇缺失[2]。泊沙康唑原研厂家为原先灵葆雅公司,2005年11月其口服混悬液在欧洲首次上市,为了适用于需要静脉给药或不能口服用药的患者,后又研制出不同剂型。美国FDA分别于2009年、2013年和2014年批准了Merck公司生产的泊沙康唑口服混悬液(40 mg/ml)、缓释片剂(100 mg/片)及泊沙康唑注射液(16.7 ml:300 mg)上市,此3种剂型也已获得我国国家药品监督管理局(NMPA)批准进口。我国目前已有注射液仿制药产品上市。
细菌内毒素检查为注射剂安全性检查的重要项目。建立泊沙康唑注射液原料的细菌内毒素检查方法也是对其质量进行控制的重要一环。目前,各国药典及原研产品标准对泊沙康唑原料细菌内毒素限度并无规定,国内也尚无相关文献报道,亟需研究建立一种泊沙康唑原料的细菌内毒检查方法。泊沙康唑的分子式为C37H42F2N8O4,相对分子质量700.78,在水和酸性介质中溶解度小[3]。建立细菌内毒素检查方法的前提是样品应溶于水或合适的检查溶剂中[4],常规方法不能实现该原料的细菌内毒素检查,故采用合适的溶剂并进行方法适用性考察是本研究的重点。本研究将为泊沙康唑原料质量标准中制定细菌内毒素检查项提供依据,同时为其他三唑类抗菌产品的细菌内毒素检查提供参考。
1 仪器与材料
1.1 仪器
ZH-2型自动漩涡混合器(天津药典标准仪器厂);ET-96内毒素凝胶法测定仪(天津市天大天发科技有限公司);XSR-205DU电子天平(梅特勒-托利多公司)。
1.2 材料与试剂
鲎试剂1,批号:2010193,标示灵敏度(λ):0.25 EU/ml,湛江博康海洋生物有限公司;鲎试剂2,批号:2006281,λ:0.25 EU/ml,湛江安度斯生物有限公司; 细菌内毒素检查用水(BET水),批号:2002180,规格:5 ml/支,湛江安度斯生物有限公司;细菌内毒素工作标准品(WSE,批号:150601-202089,效价:90 EU/支,中国食品药品检定研究院);泊沙康唑(批号:S07002102001,S07002103001,S07002103002,山东金城昆仑药业有限公司);吐温80(批号:20180420,国药集团化学试剂有限公司);四氢呋喃(批号:20200210,国药集团化学试剂有限公司)。
2 方法与结果
2.1 试剂灵敏度复核
按《中国药典》2020年版四部通则1143细菌内毒素检查法[5]项下鲎试剂灵敏度复核的要求,分别对两批鲎试剂进行灵敏度复核,结果2010193批鲎试剂灵敏度的测定值(λc)=0.177 EU/ml,2006281批鲎试剂λc=0.125 EU/ml,两批鲎试剂λc均在0.5λ~2.0λ之间,两批鲎试剂均可用于试验。
2.2 限值计算
根据泊沙康唑注射液说明书,本品用法用量为:适用于18岁及以上人群,静脉滴注,首日300 mg/次,一天两次;维持剂量,300 mg/次,一天一次。按下式计算细菌内毒素限值(L)。

式中,K为人每千克体重每小时最大可接受的内毒素剂量,注射剂K=5.0 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,人均体重按60 kg计算,得M=5 mg/(kg·h),经计算得泊沙康唑的内毒素限值为1.0 EU/mg,从严制订限值为0.5 EU/mg。
2.3 泊沙康唑溶解方法的确立
泊沙康唑不溶于水,可溶解于二甲基亚砜、无水乙醇等有机溶剂,但进一步用水稀释后会形成沉淀析出。本试验考虑采用有机溶剂加助溶剂吐温80进行配伍溶解供试品。分别将吐温80和四氢呋喃按1:1,1:2,1:4,1:8体积配比配制成混合溶液,作为溶剂溶解供试品,肉眼观察供试品的溶解情况。最终确定四氢呋喃-吐温80(4:1)溶液作为溶剂,可制备成最大浓度为50 mg/ml的供试品溶液(完全溶解),进一步用BET水稀释至1 mg/ml后,形成白色混悬液,可用作细菌内毒素检查。
2.4 供试品干扰试验
2.4.1 干扰试验预试验 目前市售鲎试剂灵敏度一般在0.5~0.015 EU/ml之间,本品细菌内毒素限值为0.5 EU/mg。根据供试品的最小有效浓度(MVC)=鲎试剂的标示灵敏度(λ)/L,计算得到相应的供试品最小有效浓度分别为1,0.5,0.25,0.125,0.06,0.03 mg/ml。
取批号为S07002102001的供试品,批号为2010193的鲎试剂(λ为0.25 EU/ml)进行预试验。取供试品,用四氢呋喃-吐温80(4:1)溶液配制成浓度为50 mg/ml的供试品溶液,并进一步用BET水稀释成为浓度为1,0.5,0.25,0.125,0.062,0.031 mg/ml的供试品溶液(稀释过程中溶液会变浑浊);另分别取用BET水稀释制备的浓度为2,1,0.5,0.25,0.125,0.062 mg/ml的供试品溶液,加入等体积的4.0λ内毒素标准溶液,配制成供试品阳性对照溶液。每一浓度平行做2支供试品管,2支供试品阳性对照管,另设2支阴性对照(BET水)管,2支阳性对照(2.0λ内毒素标准溶液)管。试验结果见表1。经预试,本品在1 mg/ml及以下浓度时对试验无干扰作用。根据预试验结果,采用两个生产厂家的鲎试剂对供试品进行正式干扰试验。
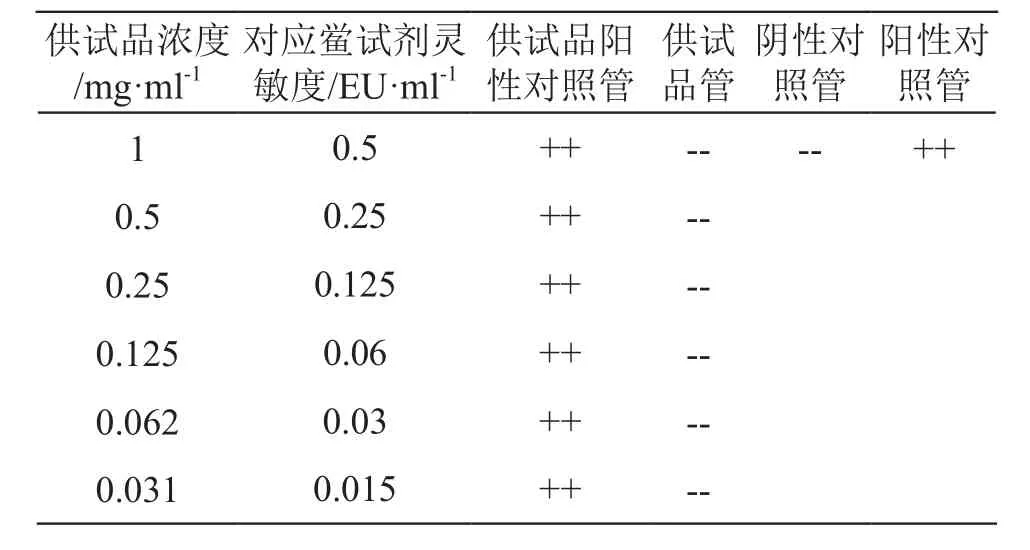
表1 细菌内毒素干扰预试验结果
2.4.2 干扰试验 取供试品,用四氢呋喃-吐温80(4:1)溶液配制成浓度为50 mg/ml的供试品溶液。用BET水将细菌内毒素工作标准品复溶,并稀释制成0.50,0.25,0.125,0.0625 EU/ml细菌内毒素标准品溶液;同时取1.0,0.50,0.25,0.125 EU/ml细菌内毒素标准品溶液,分别加入等体积的2 mg/ml供试品溶液,制备含细菌内毒素的供试品溶液。使用两个生产厂家的鲎试剂(鲎试剂1、鲎试剂2)进行试验,观察供试品浓度为1 mg/ml时对试验的干扰情况。细菌内毒素标准品溶液每一浓度平行做2管,含细菌内毒素的供试品溶液每一浓度平行做4管,同时另取BET水和1 mg/ml供试品溶液各做两支对照管。3批同法操作。
试验结果见表2。分别计算内毒素标准溶液反应终点浓度的几何平均值(Es)和含细菌内毒素的供试品溶液反应终点浓度的几何平均值(Et),判断供试品对试验有无干扰作用。结果表明,供试品溶液和阴性对照溶液(BET水)的所有平行管均为阴性,且系列浓度供试品溶液的结果符合鲎试剂灵敏度复核试验要求(Es均在0.5λ~2.0λ之间),该试验有效。所有批次含细菌内毒素的1 mg/ml供试品溶液的结果符合鲎试剂灵敏度复核试验要求(Et均在0.5λ~2.0λ之间),认为供试品浓度为1 mg/ml时对试验无干扰作用。

表2 细菌内毒素干扰试验结果
2.5 供试品细菌内毒素检查
取供试品,按《中国药典》2020年版四部通则1143细菌内毒素检查法,采用鲎试剂1对3批供试品进行检查。结果3批供试品内毒素含量均小于0.5 EU/mg,符合规定。结果见表3。

表3 泊沙康唑细菌内毒素检查结果
3 讨论
细菌内毒素作为细菌死亡或解体后才释放出来的一种具有生物活性的物质,具有耐热性强、可过滤的特点[6],通过注射进入血液会对人的健康甚至生命安全产生巨大影响。《药品GMP指南》要求,在注射剂(无菌制剂)生产的各个过程都应对细菌内毒素进行控制[7],虽然在各个环节都存在内毒素被带入药物中的风险,但从源头对泊沙康唑原料的细菌内毒素含量进行控制更为有效。
本研究建立了泊沙康唑原料的细菌内毒素检查方法。因本品不溶于水、乙醇、DMSO等溶剂,采用四氢呋喃-吐温80(4:1)溶液作为溶剂先溶解供试品后,进一步用水稀释进行细菌内毒检查。结果表明,泊沙康唑在1 mg/ml及以下浓度时对试验无干扰作用。泊沙康唑原料质量标准建议制订为:取本品,加四氢呋喃-吐温80(4:1)溶液溶解制成每1 ml中含泊沙康唑50 mg的溶液,依法检查(《中国药典》2020年版四部通则1143),每1 mg泊沙康唑中含内毒素的量应小于0.5 EU(供注射用)。此外,对于不溶于水的原料建立细菌内毒素检查方法,应充分考虑非水溶剂对供试品中内毒素的干扰情况。本研究也为其他不溶于水的原料品种建立细菌内毒素检查方法提供了依据。

