党参中多糖和5种化学成分的相关性研究
任 月,陈晓虎,张 毅,
(1. 成都中医药大学 药学院,四川 成都 611137;2. 重庆市食品药品检验检测研究院,重庆市药物过程与质量控制工程技术研究中心,重庆 401121)
党参为桔梗科植物党参Codonopsis pilosula(Franch.) Nannf.、素花党参Codonopsis pilosulaNannf. var.modesta(Nannf.) L. T. Shen和川党参Codonopsis tangshenOliv.的干燥根,具有健脾益肺、养血生津的功效,主要用于脾肺气虚、咳嗽虚喘、气血不足等症[1],是大宗常用的传统补益类中药,常用作人参替代品。研究表明,党参富含多种成分,包括多糖、苯丙素、生物碱、聚乙炔醇和酚酸等[2-4]。现代药理学研究表明,党参有抗氧化、抗衰老、抗肿瘤、抗衰老、调节血脂或血糖等多种作用。《中国药典》2020年版一部及各省、市、区的地方标准中,仅收载有性状、显微特征、薄层鉴别、水分、灰分、浸出物等非特异性项目,并未在化学成分的基础上对其质量进行有效控制。而党参质量的安全性、有效性是其临床应用的有效保障,党参有效成分及含量的测定是制定质量控制标准的重要指标[5]。近年,张丽芬等[6]采用高效液相色谱法(HPLC)测定党参中党参多糖和党参炔苷的含量;贡东军等[7]采用反相高效液相色谱法(RP-HPLC)测定党参中党参内酯和苍术内酯III的含量;关琳静[8]通过党参HPLC特征图谱研究,测定不同来源党参成分含量,进行总体定性分析;陈娟等[9]采用HPLC测定党参中3种成分含量。总体而言,党参药效显著,但成分复杂,活性指标成分不清楚。化学成分含量测定较为单一,难以全面评价党参的内在质量。研究表明,多糖类成分是抗衰老、抗肿瘤的主要药效成分,主要通过提高抗氧化酶活性或清除有机体内的自由基发挥作用。党参多糖是党参补脾作用的重要物质基础之一[10-12];腺苷被认为是补益类中药共有的物质基础,参与代谢过程,是生物细胞维持生命活动的重要元素[13];紫丁香苷作为指标性成分可鉴定纹党参和白条党参[14];党参炔苷对乙醇所致的胃黏膜损伤有较好的保护作用[15]。因此,本文通过比色法建立党参多糖含量测定方法,通过色谱法建立党参中腺苷、色氨酸、紫丁香苷、绿原酸、党参炔苷等5种成分的含量测定方法,对同一来源相同时间采集的党参样本进行初步对比分析研究,探索党参化学成分与党参多糖是否具有相关性,为后续党参质量标准提高及质量控制提供参考。
1 仪器与试药
1.1 仪器
e2695高效液相色谱仪(美国Waters公司),HP8453E型紫外-可见分光光度计(HP公司);AX-205电子天平(梅特勒公司);恒温水浴锅(上海精密公司)。
1.2 试药
腺苷(批号:110879-201703,含量:99.7 %)、色氨酸(批号:140624-201506,含量:99.9 %)、紫丁香苷(批号:111574-201504,含量:94.9 %)、绿原酸(批号:111574-201504,含量:96.2 %)、党参炔苷(批号:111732-201607,含量:96.6 %)、无水葡萄糖(批号:110833-201908,含量:99.8 %)对照品均来自中国食品药品检定研究院;甲醇为色谱醇(安徽时联特种溶液股份有限公司),浓硫酸为分析纯(重庆川东化工有限公司),水由Milli-Q系统(美国密理博公司)制备。
20批党参样品采集自山西壶关,经重庆市食品药品检验检测研究院中药室张毅副主任中药师鉴定为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.的干燥根。
2 方法与结果
2.1 多糖含量测定
2.1.1 标准曲线的制备 精密称取葡萄糖对照品适量,加水制成0.1 mg/ml葡萄糖溶液,分别精密量取0.1,0.2,0.4,0.6,0.8,1.0 ml,加水至2.0 ml,加入5 %苯酚溶液1.0 ml后摇匀,迅速精密加入浓硫酸5.0 ml并摇匀,置水浴中加热15 min,取出,立即冷却至室温,以相应试剂为空白。用紫外-可见分光光度法于490 nm波长处测定吸光度,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。葡萄糖在10.2~102.1 μg/ml浓度范围内线性关系良好。回归方程为A=7.2708X-0.0055,相关系数R²=0.9997。
2.1.2 供试品溶液的制备 取党参细粉约0.2 g,精密称定后,精密加入体积分数为80 %乙醇50 ml回流提取2 h,滤过,残渣用80 %乙醇热洗涤后加水60 ml,水浴加热回流2 h,趁热过滤,残渣及烧瓶用热水30 ml洗涤,分3次洗涤,洗液并入滤液,浓缩至适量,放冷,移入100 ml量瓶,加水定容后摇匀,精密量取供试品溶液0.2 ml,加水至2.0 ml摇匀,加入5 %苯酚溶液1.0 ml摇匀后,迅速精密加入浓硫酸5.0 ml并摇匀,置水浴中加热15 min后,取出,立即冷却至室温,即得。
2.1.3 精密度试验 取同一对照品溶液,于490 nm波长处重复测定6次吸光度,RSD为0.69 %,结果表明,仪器的精密度良好。
2.1.4 稳定性试验 取同一党参样品,按2.1.2项法制备供试品溶液,分别于0,0.5,1,2,3,4 h于490 nm波长处测定吸光度。其RSD为2.71 %,结果表明,党参样品在4 h内稳定性较好。
2.1.5 重复性试验 取同一党参样品6份,按2.1.2项法制备供试品溶液,分别于490 nm波长处测定其吸光度,其RSD为1.35 %,结果表明,供试品重复性良好。
2.1.6 加样回收率实验 取已知含量的供试品0.1 g,共6份,分别称取葡萄糖对照品约18 mg,按2.1.2项法制备供试品溶液,于490 nm波长处测定其吸光度,计算平均回收率,结果见表1。

表1 加样回收率实验
2.1.7 样品多糖含量测定 取本品细粉约0.2 g,按2.1.2项法制备供试品溶液,于490 nm波长处测定吸光度,由标准曲线可知多糖浓度,计算,即得,结果见表5。
2.2 党参中5种成分含量测定
2.2.1 色谱条件 色谱柱Agilent SB-C18(250 mm×4.6 mm,5 μm);柱温:25 ℃;检测波长214,218,257 nm,流动相:A相为乙腈溶液,B相为0.1 %磷酸水溶液;梯度洗脱见表2;流速:1 ml/min;进样量:20 μl。
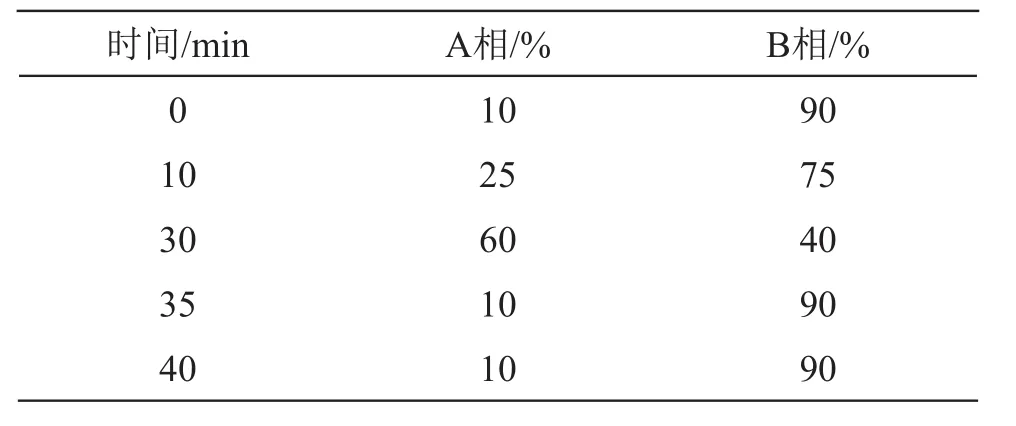
表2 梯度洗脱程序
2.2.2 对照品溶液制备 分别精密称取对照品腺苷20.22 mg、色氨酸20.22 mg、紫丁香苷18.74 mg、绿原酸9.88 mg和党参炔苷9.14 mg,用50 %甲醇制成质量浓度分别为2.016,2.078,1.778,0.950,0.883 mg/ml单一成分对照品储备液。
2.2.3 供试品溶液制备 精密称取党参粉末约1 g,置具塞锥形瓶中,精密加入50 %甲醇25 ml,密塞,称定重量,超声处理60 min,放冷,再称定重量,用50 %甲醇补足减失的重量,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
2.2.4 标准曲线的制备 精密吸取腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷各单一成分对照品储备液1.0,1.0,0.2,1.0,4.0 ml,置入同一20 ml量瓶,摇匀,作为混合对照品溶液。
2.2.5 系统适应性试验 精密吸取对照品溶液及党参供试品溶液,分别进样,记录色谱图,见图1。

图1 党参混合对照品(A)和党参供试品溶液(B)的HPLC色谱图
2.2.6 线性考察 精密吸取混合对照品溶液0.1,0.2,0.4,0.5,1,2,5 ml,置入10 ml量瓶,加入50 %甲醇溶液定容,制成系列对照品溶液。吸取上述对照品溶液,按2.2.1项法测定5个化学成分的峰面积。以所测成分质量浓度X为横坐标,色氨酸、紫丁香苷、绿原酸和党参炔苷的峰面积Y为纵坐标,绘制标准曲线,得回归方程,结果见表3。

表3 5种化合物的标准曲线和线性范围
2.2.7 精密度试验 精密称取同一党参样品,按2.2.3项法制备供试品溶液,按2.2.1项色谱条件连续进样6 次,结果表明,腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷的峰面积的RSD值分别为0.61 %,0.15 %,0.29 %,0.26 %,0.32 %,均小于1.0 %,表明精密度良好。
2.2.8 重复性试验 精密称取同一党参样品6份,按2.2.3项法制备供试品溶液,按2.2.1项色谱条件测定,结果表明,腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷的RSD分别为2.54 %,0.17 %,1.23 %,1.91 %,0.53 %,均小于2.5 %,表明方法重复性较好。
2.2.9 稳定性试验 取同一党参样品,按2.2.3项法制备供试品溶液,分别于制备后0,2,4,8,12,24 h按2.2.1项色谱条件进样测定。结果表明,腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷峰面积的RSD分别为2.60 %,2.13 %,2.00 %,1.06 %,0.30 %,表明党参样品溶液24 h内稳定性较好。
2.2.10 加样回收率实验 取已知含量的党参样品粉末约0.5 g,共6份,精密称定,分别置入具塞锥形瓶,精密加入0.0645 mg/ml腺苷对照品溶液1.5 ml,0.1293 mg/ml色氨酸对照品溶液1.0 ml,0.0213 mg/ml紫丁香苷对照品溶液0.5 ml,0.0570 mg/ml绿原酸对照品溶液1.0 ml,0.3973 mg/ml党参炔苷对照品溶液1.0 ml和50 %甲醇20 ml,按2.2.3项法制备供试品后进样测定,计算回收率。结果见表4。

表4 5种化合物的加样回收率(n=6)
2.2.11 党参5种成分含量测定 取本品细粉约1 g,按2.2.3项法制备供试品溶液,按2.2.1项色谱条件进样测定。结果见表5。通过构建相关性系数图,以相关性系数为指标,其绝对值越接近1,相关性越强。多糖含量与5种化学成分含量的相关性系数图见图2。由图2可见,党参腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷5个成分与党参多糖的相关性系数分别为-0.153,-0.024,-0.141,-0.178,-0.145,因此不具明显相关性。
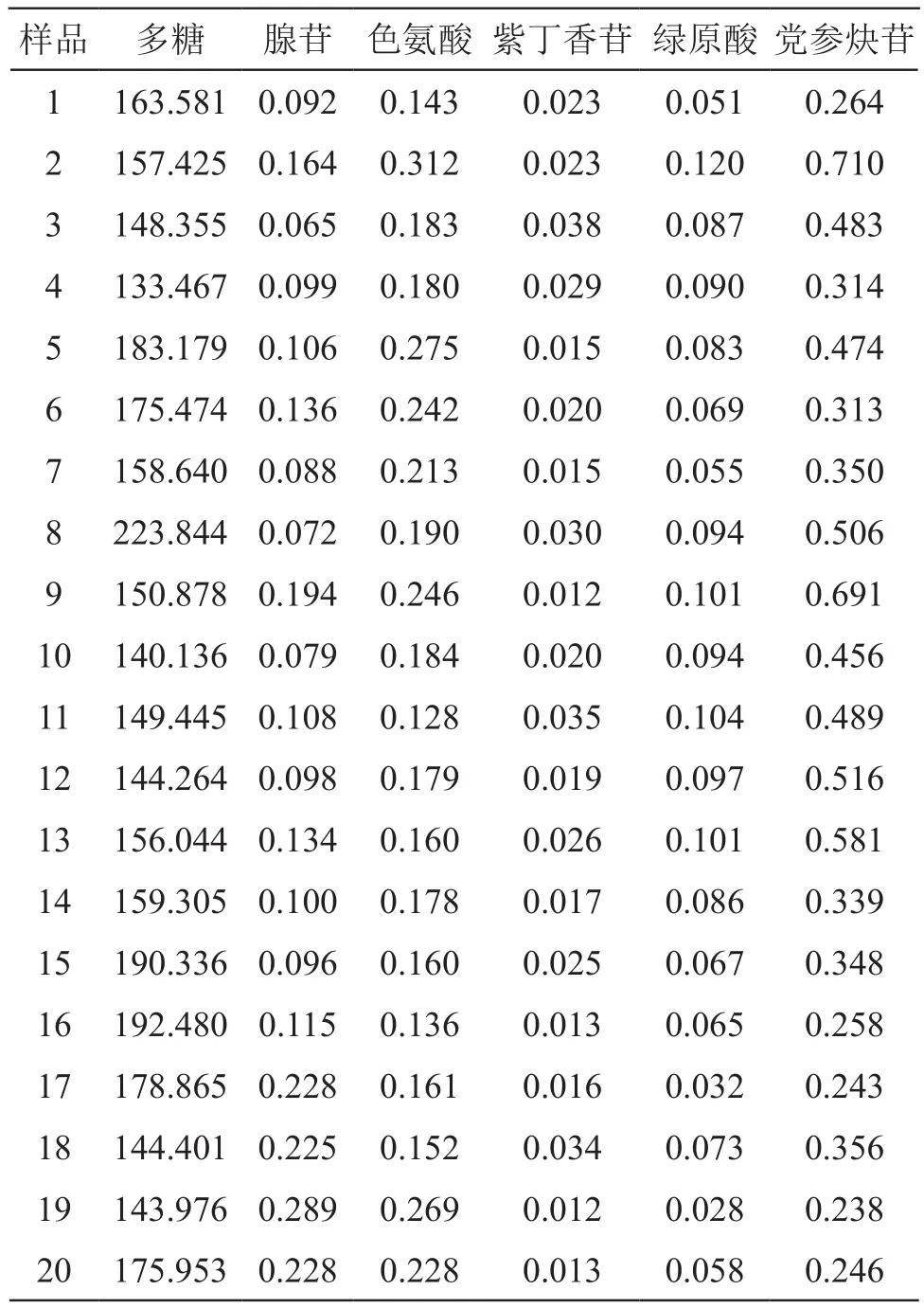
表5 含量测定结果/mg·g-1

图2 党参中多糖和5种化学成分的相关性系数图
3 讨论
3.1 多糖前处理考察
3.1.1 醇除杂考察 取党参药材约0.2 g,精密称定,置入锥形瓶,用80 %乙醇加热回流提取2 h,取提取液,蒸干,用适量水溶解,滤过至100 ml量瓶,定容,精密量取滤过液0.2 ml,加水至2 ml。分别加5 %苯酚溶液1.0 ml,摇匀,迅速精密加入浓硫酸5.0 ml后摇匀,置水浴中加热15 min,取出,立即冷却到室温,进行测定,吸光度值为0,表明该除杂方法可行。
3.1.2 提取考察 通过考察加水量60,80,100 ml,水浴时间1,2,3 h等,对提取进行优化。结果表明,对比60 ml溶剂提取与80 ml溶剂提取相比结果,多糖含量在增加提取液后并无明显变化;每次提取1 h与2 h相比较,多糖含量增加并不明显。因此,从节约成本及时间角度考虑,用水60 ml,每次提取2 h即可。
3.2 党参炔苷前处理考察
对于多组分分析,合适的检测波长是重要的参数[16]。采用波长范围为200~400 nm的紫外检测器对党参中5种成分进行扫描,结果腺苷在257 nm波长处有最大吸收,色氨酸在218,278 nm波长处有最大吸收,紫丁香苷在219,264 nm波长处有最大吸收,绿原酸在218,325 nm波长处有最大吸收,党参炔苷在214,267,283 nm波长处有最大吸收,因此选择腺苷的检测波长为257 nm,色氨酸、紫丁香苷、绿原酸的检测波长为218 nm,党参炔苷的检测波长为214 nm。通过5种成分的分离度、峰形、基线等方面对不同流动相体系,如甲醇~水、甲醇~0.1 %磷酸水溶液、乙腈~水、乙腈~0.1 %磷酸水溶液进行考察,结果在乙腈~0.1 %磷酸水溶液时为流动相进行梯度洗脱时,党参中5种化学成分峰形、分离度较好,因此,选择乙腈~0.1% 磷酸水溶液作为流动相。根据党参5种化学成分的溶出情况,对不同提取方式,如超声、回流等;对不同提取溶剂,如50 %甲醇、75 %乙醇、甲醇等;对不同提取时间,如30,60,90 min等进行单因素考察,结果表明,采用50 %甲醇超声60 min处理样品时,5种成分的溶出情况最好,因此,选择50 %甲醇超声60 min处理样品。
3.3 方法评价
本研究采用硫酸-苯酚比色法建立党参中多糖含量的测定方法,采用HPLC法建立党参中腺苷、色氨酸、紫丁香苷、绿原酸和党参炔苷5种化学成分的测定方法,并对两种方法进行方法学考察,包括重复性、精密度、稳定性、加样回收等。比色法操作简便、成本低廉;色谱法分离度好,准确性高,多种方法同时测定党参质量,建立中药整体质量控制标准,为党参质量评价提供参考。同时,采集山西壶关20批党参药材并测定其党参多糖和党参中特异性成分腺苷、色氨酸、紫丁香苷、绿原酸、党参炔苷的含量,根据相关性系数图,甘肃壶关党参中5种化学成分与党参多糖含量不呈现明显相关性。由此可知,评价党参质量的优劣不应仅从单一方面进行考察,其质量控制不能仅限于一两种成分,多维度多成分对党参进行定性定量等质量综合评价尤为重要,党参内在质量关系仍需进一步研究。

