黄芪注射液对缺血性心肌病大鼠心肌的保护作用*
李少情,张青山 ,赵 婷,白婷婷,宣丽颖,王 羽△,赵 明△
(1.沧州市中心医院,沧州 061000;2.吉林大学基础医学院,长春 130000;3.内蒙古民族大学附属医院,通辽 028000;4.内蒙古蒙药心脑血管药理学重点实验室,通辽 028000)
随着社会经济的快速发展,快节奏的生活常伴随着不良的饮食、作息习惯,这些不良的习惯带来了诸多健康问题,其中包括近年来发病率逐年攀升的心血管疾病,2015年发布的中国心血管病报告称,心血管病占居民疾病死亡构成的40%以上,为我国居民的首位死因。缺血性心肌病的发生,也是临床上较为常见的心血管疾病,也是慢性冠脉疾病的一种,心室扩大及心力衰竭都是临床上常见的表现[1]。其原因是由于长期冠脉缺血导致心肌细胞死亡及纤维组织增生等病理改变引发的心肌重塑。研究表明线粒体在缺血性心肌病心肌重塑中起着独特和关键的作用。异常增高的胞浆中游离Ca2+浓度(intracellular Ca2+concentration,[Ca2+]i) 出现异常增高现象时,可易于诱发线粒体发生功能障碍进而加重心脏的病理损伤[2]。正常心肌中ATP敏感性钾通道 (ATP-sensitive potassium channel,KATP) 由于细胞中高浓度ATP而处于关闭状态,当心肌出现缺血情况下,KATP开放,缩短动作电位时程,K+外流,加速复极,动作电位平台期缩短,进而减低Ca2+内流及细胞内Ca2+浓度。黄芪是常见的中草药之一,对于乏力和气短等症状都有一定的疗效。本团队前期工作发现黄芪注射液(黄芪的一种剂型),通过calumenin介导抑制缺血性心肌病大鼠心肌细胞自噬延缓心室重塑[3],但其机制尚未完全明确,本实验目的明确黄芪注射液是否通过影响KATP,进而减低缺血性心肌病大鼠心肌细胞[Ca2+]i延缓心室重塑改善心脏功能。
1 材料与方法
1.1 动物实验的药品与仪器
雄性SD大鼠(180~220 g)36只(吉林大学基础医学院动物中心),许可证号:SCXKs(吉)20110004。黄芪注射液(成都地奥九泓制药厂:国药准字Z51021776),规格:每支10 ml,每ml含黄芪原药2 g。Mfn1抗体chop抗体(abcam公司),内参β-action(武汉赛维尔生物科技公司)。IKATP采用全细胞膜片钳配置MultiClamp 700A放大器、1550A数模转换器和PCLAMP 10.6采集和分析软件(Molecular Devices,USA)进行分析。SpectraMax Gemini XPS 荧光酶标仪(Molecular Devices,USA)。线粒体Ca2+浓度检测试剂盒(GMS10153.2)购自GENMED公司。
1.2 缺血性心肌病大鼠模型的制备及分组
36只雄性鼠随机分成:对照组(Control group)、缺血性心肌病组(Ischemic cardiomyopathy group)、黄芪注射液组(Astragalus injection group),每组各12只。缺血性心肌病大鼠模型的制备同本团队前期实验方法[3,4],经20%的氨基甲酸乙酯(5 mg/kg)腹腔注射麻醉后,气管插管,结扎冠状动脉前降支,按肢体标准Ⅱ导连接BL420生理仪记录心电图,心电图检测ST段抬高、T波高尖为模型建立成功。黄芪注射液组中每周一次注射黄芪注射液(剂量:10 g/kg体重),每次注射容积1 ml,共注射4次;对照组和缺血性心肌病组,腹腔均注射相同剂量的生理盐水。4周后给予3组大鼠麻醉后行心脏彩超检查后,立即处死大鼠,取大鼠(每组3只)左心室组织放入4%戊二醛溶液中进行固定、脱水、渗透和包埋后用超薄切片机切片,进行切片染色后采用透射电子显微镜进行实验,观测心肌组织超微变化。
1.3 Western blot
取各组大鼠左心室组织制备心脏匀浆,提取总蛋白,蛋白定量后,30 μg的心脏裂解液,采用Western blot方法检测各组大鼠心肌组织中Mfn1、chop 表达。实验过程主要步骤:(1)配好所需浓度分离胶与浓缩胶;(2)加入10 μl样品,SDS PAGE后,进行转膜;(3)封闭2 h;(4)一抗(Mfn1 1∶100、chop 1∶1 000)4℃过夜孵育;(5)二抗孵育1 h;(6)显影;(7)整理数据分析条带。
1.4 心肌细胞ATP敏感钾电流(IKATP)的检测
随机选取对照组中大鼠,将其心脏进行分离,同时将心脏进行主动脉逆行插管,固定后悬挂于Langendorff灌流装置上,以普通Tyrode液灌流3~5 min,灌流速度7 ml/min,静水压70 cm H2O,温度37℃。心肌细胞分离方法同团队前期实验方法[4]。ATP敏感钾电流(IKATP)记录条件:先给予细胞外液加入KATP通道开放剂100 μmol panicidil,然后把细胞膜电位钳制于-70 mV,钳制电压由-70 mV阶跃至-110 mV维持100 ms,然后给予1000 ms Ramp刺激至10 mV,每隔10 s重复采集数据,加入200 g/L黄芪注射液,观察黄芪注射液对心肌细胞IKATP作用,然后给予KATP通道特异性阻断剂格列本脲观察其是否能阻断黄芪注射液对心肌细胞IKATP作用,实验重复三次。
1.5 大鼠心肌组织中线粒体钙浓度检测
线粒体提取选取组织线粒体分离试剂盒(Beyotime),取新鲜的大鼠心脏组织,PBS清洗后置于冰上将组织剪成组织碎片,加入线粒体分离试剂A进行冰浴匀浆,低速离心取上清后,高速离心,沉淀即为分离到的线粒体。使用线粒体Ca2+浓度检测试剂盒及荧光酶标仪检测各组大鼠心肌组织中线粒体Ca2+浓度。具体操作:(1)准备1个黑色96孔板;(2)取100 μl纯化的线粒体样品加入到96孔板中,并做最大对照组和空白对照组;(3)加入10 μl染色工作液;(4)室温孵育30 min后,再放入细胞培养箱中孵育30 min;(5)放入荧光酶标仪中测读。
1.6 统计学处理
2 结果
2.1 大鼠心电图观察
对照组大鼠室早发生率(12±4)%,未记录到室速发生。缺血性心肌病组大鼠室早为(389±56)次,室速发生率(26±7)%。黄芪注射液组中大鼠为(173±31)次,室速发生率(6±2)%。缺血性心肌病组中大鼠比较,黄芪注射液组中大鼠心律失常情况明显减少(图1)。
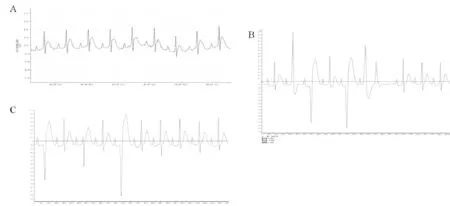
Fig. 1 Changes of electrocardiogram in rats with different treatment
2.2 大鼠心脏彩超观察
如图2和表2,对照组中大鼠心脏超声检查心脏结构及功能未见明显改变,与对照组比较,缺血性心肌病组中大鼠心脏超声检查心室扩大,EF值降低,与缺血性心肌病组中大鼠相比较,黄芪注射液组中大鼠心室缩小,EF值增加,有显著性差异(P<0.01) 。
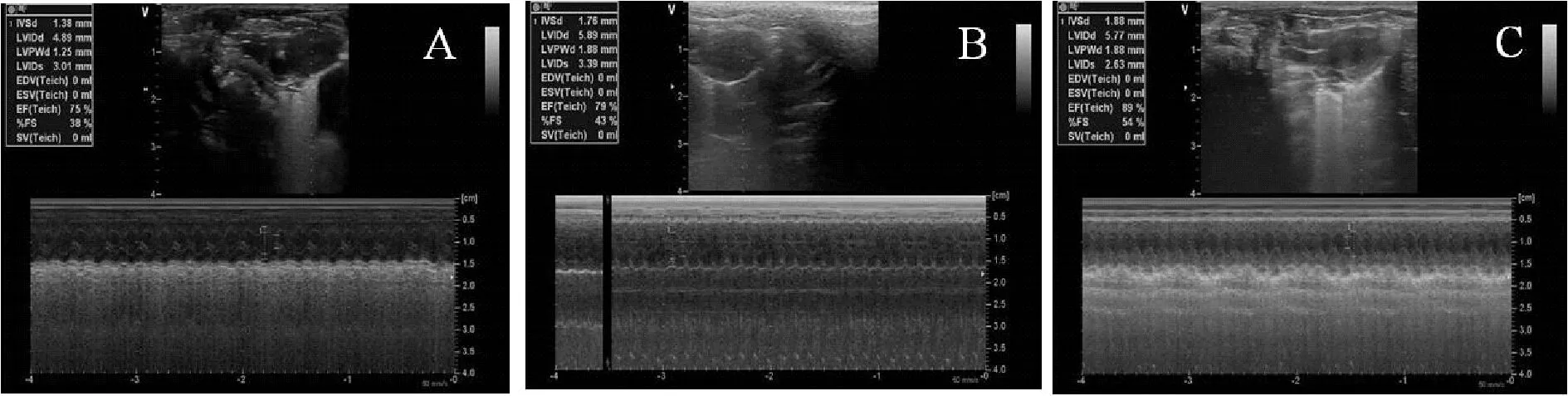
Fig. 2 Comparison of echocardiographic results of rats in each group
2.3 大鼠心肌组织超微结构观察
通过透射电镜结果发现,对照组中大鼠的心肌细胞形态完整,且肌节没有出现缺失,心肌纤维排列有序且整齐,线粒体的形态结构清晰可见;而缺血性心肌病组大鼠的心肌细胞形态发生变化,线粒体出现空泡化情况较为严重,部分心肌纤维发生断裂和缺失;而黄芪注射液组中,大鼠的心肌纤维排列紊乱,肌节完整性受损,线粒体空泡化减轻(图3)。

Fig. 3 Ultrastructural changes of myocadium in rats of each group under electron microscopy (Bar=2.0 μm)
2.4 大鼠心肌细胞动作电位及钙浓度检测
与空白组相比,大鼠心肌细胞动作电位时程APD30,APD50,APD90延长(P<0.01),线粒体Ca2+浓度增多(P<0.01)。与缺血性心肌病组比较,黄芪注射液组中大鼠心肌细胞动作电位时程APD30(P<0.05),APD50(P<0.01),APD90(P<0.01)明显缩短(表1),线粒体Ca2+浓度降低(P<0.01,表2)。
Tab. 1 Action potential of cardiomyocytes in different n=3)
Tab. 2 LVIDd,EF and concentration of mitochondrial Ca2+of cardiomyocytes in different
2.5 大鼠心肌组织中Mfn1、chop 表达
与缺血性心肌病组中大鼠相比较,黄芪注射液可以明显增加Mfn1表达;与缺血性心肌病组中大鼠相比较,黄芪注射液可以明显减少chop 表达(图4,表3)。
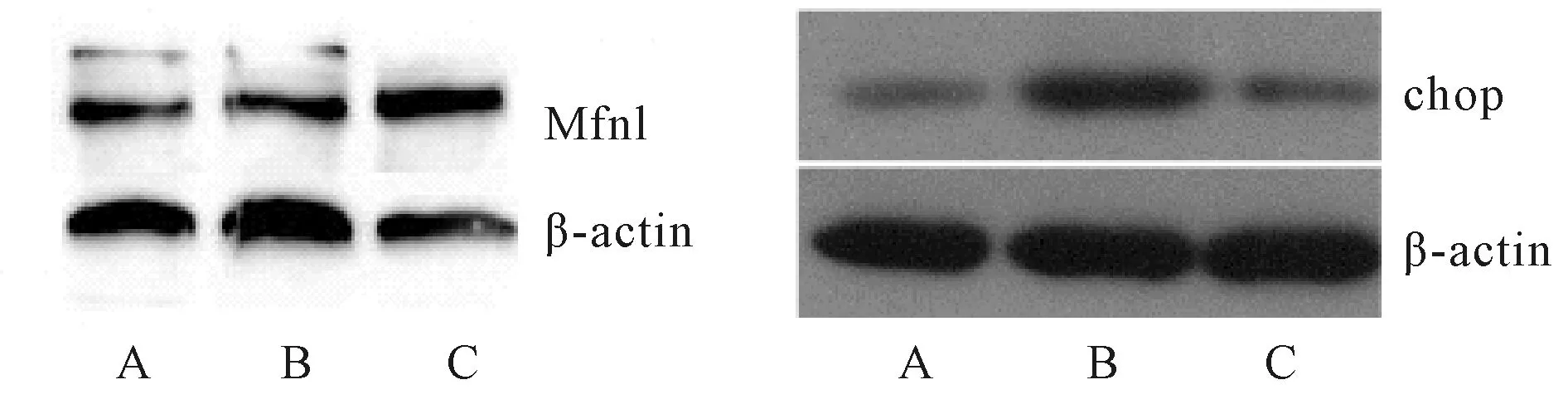
Fig. 4 The expressions of Mfn1and chop in different group
Tab. 3 The expressions of Mfn1 and chop and the I(nA) of IKATP in rats’ heart of each group n=3)
2.6 黄芪注射液对大鼠心肌细胞IKATP的作用
先给予细胞外液加入KATP通道开放剂100 μmol panicidil记录心肌细胞IKATP,然后给予黄芪注射液后记录电流,发现IKATP明显增大,再给予IKATP特异性阻断剂格列本脲后记录电流,观察到IKATP明显减小(图5,表3)。

Fig. 5 Electrocurrent of myocardial cells in each group
3 讨论
随着人们生活方式的改变,心血管疾病患病率和死亡率呈现逐年上涨的趋势,它不但是医学问题,同样也是社会、经济问题。究其原因,缺血性心脏病是其最主要病因。本团队前期实验发现,黄芪注射液可有效改善大鼠心肌缺血现象[3],但原因不明。
为了探明黄芪注射液治疗心肌缺血作用,本研究应用结扎冠状动脉前降支建立大鼠缺血性心肌病模型,以心电图ST段抬高、T波高尖作为模型是否成功的标志。采用预先给予大鼠黄芪注射液四周后,通过心电图和超声心动图的结果可知,黄芪注射液可明显延缓缺血性心肌病大鼠心室重塑及减少心律失常,为明确其作用机制,通过电镜观察各组大鼠心肌超微结构改变,可见缺血性心肌病组中大鼠心肌组织线粒体发生空泡化情况严重,心肌纤维断裂缺失,而黄芪注射液组中大鼠的心肌纤维虽然排列紊乱,肌节完整性受到一定的损伤,但线粒体具有完整性。推测黄芪注射液治疗心肌缺血作用与线粒体相关。线粒体功能紊乱导致的能量供应不足已成为缺血性心肌病的发病机制之一。由于线粒体具有高度动态性的特征,可以持续不断地融合-分裂循环,这一循环过程称为线粒体动力学,线粒体通过这一过程维持其大小,形状和网络受细胞生理学控制,包括对心脏的发育、Ca2+的信号传导及细胞死亡起着重要作用[5]。线粒体融合蛋白Mfn1在线粒体动力学中发挥重要的作用。特异性敲除成年小鼠心脏Mfn1/2基因导致小鼠线粒体功能异常,并伴有严重的心肌细胞呼吸缺陷,最终发展为心力衰竭[6]。本研究观察到黄芪注射液可以明显增加MFN1表达,说明黄芪注射液可调控线粒体融合。线粒体动力学在线粒体钙处理、凋亡中发挥重要的作用[7]。线粒体Ca2+摄取和释放对细胞凋亡产生重要影响,当细胞处于应激状态下,线粒体Ca2+浓度的升高会导致细胞死亡[8]。研究发现黄芪注射液减低缺血性心肌病大鼠心脏线粒体中的钙离子浓度。缺血心肌病由于长期冠脉缺血导致心肌细胞死亡及纤维组织增生等病理改变引发的心肌重塑。心肌细胞死亡有多种形式,心肌细胞凋亡也是主要形式之一,而凋亡产生机制是错综复杂的,相关研究表明线粒体在细胞内源性凋亡中处于中心地位,而且线粒体的断裂以及线粒体嵴重构均出现在细胞凋亡早期[9]。Chop蛋白是凋亡相关因子。大量研究表明敲除chop可以减轻心肌细胞凋亡和炎症反应,改善小鼠心脏再灌注损伤[10]。本研究中发现黄芪注射液可以降低心肌缺血大鼠心肌中chop蛋白的表达。这个结果部分解释了黄芪注射液延缓缺血性心肌病大鼠心室重塑作用机制可能是通过抑制缺血性心肌病大鼠心肌细胞线粒体Ca2+超载,进而减少心肌细胞凋亡所致。与此同时,黄芪注射液可以加大心肌细胞IKATP,该作用能被KATP特异性阻断剂----格列本脲所阻断,因为在缺血/再灌注过程中IKATP对心肌起到保护作用,并且有抗心律失常作用[11,12],同时,线粒体膜上KATP开放可减轻线粒体Ca2+超载减少缺血/再灌注损伤所致心肌细胞凋亡[13],该结果部分说明黄芪注射液延缓缺血性心肌病大鼠心室重塑及减少心律失常是通过加大IKATP所介导的。

